香青兰总黄酮调控Notch1信号通路对ox-LDL诱导的血管平滑肌细胞表型转化的影响
岳茹婧,马晓莉,郭新红,黄川生,王新春,曹文疆
(1 石河子大学药学院,新疆 石河子 832002;2 石河子大学医学院第一附属医院,新疆 石河子 832008)
动脉粥样硬化(Atherosclerosis,AS)是许多心血管疾病的基础血管病变,发病趋势逐年上升,严重影响人们的健康[x]。AS的发病机制复杂,主要有炎症学说、脂质浸润学说等[2],研究者发现多种细胞参与AS的发生发展,其中血管平滑肌细胞扮演着尤为重要角色[3]。
血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)是一种可塑性极强的细胞,在炎症介质、ox-LDL等因素的刺激下,可由成熟的收缩型转化成增殖型、巨噬细胞型甚至是形成泡沫细胞[4,5]。
前期研究表明,香青兰总黄酮(DracocephalumMoldavicaL.total flavonoids,TFDM)对于冠心病、心肌缺血、动脉粥样硬化等心血管疾病具有较好的治疗作用[6,7],但其防治AS的机制有待进一步研究。Notch1信号通路广泛分布于多种组织细胞,控制着细胞增殖、分化和迁移等细胞命运的信号转导,在心血管疾病的治疗中发挥着关键的作用[8]。据此,本实验建立大鼠VSMCs表型转化的细胞模型,探讨TFDM对VSMCs表型转化的影响及可能的机制,为香青兰总黄酮防治AS提供实验依据。
1 材料与方法
1.1 仪器
BBS-SSC型超净工作台(山东BIOBASE生物产业有限公司);CKX31型倒置显微镜(日本Olympus公司);XB70型制冰机(英国Grant仪器有限公司);2-16 K高速冷冻离心机(德国Sigma公司);THM#3131型细胞培养箱(美国Thermo Scientific);酶标仪(瑞士TECAN公司);24D制胶器(天能)、垂直电泳及电转槽、EPS-300数显式稳压稳流电泳仪(上海天能科技有限公司);EC3600型UVP蛋白成像仪(苏州赛恩斯仪器有限公司)。
1.2 试剂及材料
香青兰总黄酮提取物(新疆维吾尔自治区药物研究所,20161109);0.25%胰酶-EDTA消化液、10000U青-链霉素双抗、DMEM/H培养基(Thermo scientific,Gibco);ox-LDL(弈源生物,YB-002);辛伐他汀(索莱宝,IS0170);γ-分泌酶抑制剂(APExBIO,10 mg,DMSO溶解);CCK-8试剂(日本同仁化学,CK04);Anti-SM22α alpha、Anti-alpha SMA(abcam,ab32575-100)、Anti-Hes1(abcam,ab108937)、Anti-RBP-Jκ(abcam,ab180588)、Anti-GAPDH(武汉三鹰,60004-1-lg);Notch1(D1E11)XP Rabbit mab(CST,3608S);Transwell 聚碳酸酯膜嵌套(Corning,3422);PVDF膜(美国密理博);十二烷基硫酸钠—聚丙烯酰胺(SDS-PAGE)凝胶、电泳液、转膜缓冲液、TBST缓冲液、封闭液等为自行配制;水为超纯水。
1.3 细胞
大鼠血管平滑肌A7R5细胞购于富恒生物科技有限公司,NC025。
1.4 方法
1.4.1 细胞培养
将A7R5细胞接种于含10%胎牛血清、1‰青-链霉素的DMEM/高糖培养基(即完全培养基,下同),并于37 ℃、5% CO2的培养箱中培养。待细胞长至融合,使用0.25%胰酶-EDTA进行消化而后传代。细胞长至对数生长期时,用于后续试验。
1.4.2 药物毒性作用考察及浓度确定
采用CCK-8法测定各种刺激对细胞活力的影响。取对数生长期细胞,胰酶消化,1 000 r·min-1离心5 min后重悬于完全培养基,并调整密度至3×104个·mL-1接种于96孔板(100 μL·孔-1);另设空白孔,加等体积完全培养基(无细胞),于37 ℃、5% CO2培养箱中培养12 h,细胞贴壁成形。分别加入含ox-LDL为0(对照组)、5、10、25、50、100 μg·mL-1的完全培养基100 μL,继续培养24 h;弃原培养基,加入含10% CCK-8试剂的无血清培养基100 μL,2 h后于450 nm波长处测定吸光度(OD)。按照公式计算细胞存活率:细胞存活率=[(As-Ab)/(Ac-Ab)]×100%(As:含有细胞的培养基、CCK-8、待测物质,Ac:含有细胞的培养基、CCK-8、没有待测物质,Ab:不含细胞和待测物质的培养基、CCK-8)。同法设置含TFDM 0、5、10、25、50、100 μg·mL-1以及含辛伐他汀为0、10-7、10-6、10-5、10-4、10-3、10-2mol·L-1的剂量组,计算细胞存活率以确定药物刺激的毒性作用,选择细胞存活率大于80%的药物浓度为作用剂量。每组设置6个复孔,试验均重复3次。
1.5 细胞分组
取对数生长期细胞,胰酶消化,1 000 r·min-1离心5 min,重悬于完全培养基后随机分为6组:1)正常对照组;2)模型组(50 μg·mL-1ox-LDL);3)香青兰总黄酮高剂量组(TFDM-H组,50 μg·mL-1ox-LDL+100 μg·mL-1TFDM-H);4)香青兰总黄酮中剂量组(TFDM-M组,50 μg·mL-1ox-LDL+50 μg·mL-1TFDM-M);5)香青兰总黄酮低剂量组(TFDM-L组,50 μg·mL-1ox-LDL+25 μg·mL-1TFDM-L);6)辛伐他汀组(Simvastatin组,50 μg·mL-1ox-LDL+10-5mol·L-1Simvastatin)。各组细胞于铺板12 h后更换培养基,对照组更换完全培养基;处理组细胞更换为含50 μg·mL-1ox-LDL的完全培养基,培养24 h建立VSMCs表型转化模型。TFDM及辛伐他汀组细胞于模型建立后,更换含相应剂量药物的培养基继续培养24 h(各处理组剂量根据“2.2”试验结果,并考虑药效及细胞毒性而确定,下同)。
1.6 TFDM对细胞增殖的影响
取对数生长期细胞接种于96孔板中,密度、分组及细胞处理方法同“2.3”所述。分别于接种后12、36、60 h时,用CCK-8测定450 nm处测定吸光度(OD)值。每组设置6 个复孔,重复测定3次。
1.7 TFDM对细胞迁移的影响
采用Transwell小室检测细胞的迁移能力。取对数生长期的细胞,胰酶消化、离心后重悬细胞并铺入6孔板中,并按“2.3”所述对细胞进行分组处理。收集各组细胞使之重悬于无血清培养基,调整细胞悬液密度为5×104个·mL-1。取150 μL细胞悬液铺入Transwell小室的上室中,下室加入600 μL含15%胎牛血清的完全培养基。24 h后取出 Transwell 小室,弃培养基,PBS浸洗,棉签拭去上层未迁移细胞,甲醇固定30 min,适当风干。0.1% 结晶紫染色 40 min,PBS浸洗,拭去水分后撕下纤维膜封于载玻片、晾干,于显微镜200倍视野下随机选五个视野观察细胞,拍照,记数。
1.8 TFDM对VSMC表型转化标志蛋白及Notch1通路蛋白表达的影响
采用Western blotting法检测各目的蛋白的表达。取对数生长期细胞,消化、离心,铺于6孔板中,按“2.3”项下方法分组、处理细胞。加入含1% PMSF的RIPA裂解液提取总蛋白,将总蛋白稀释成相同浓度。蛋白于10%SDS-PAGE凝胶上电泳分离(80 V,100 V)后,湿法转移(300 mA)至PVDF膜。将膜用5%脱脂奶粉/BSA封闭1 h,而后4 ℃过夜孵育一抗(GAPDH、SM22α、α-SMA、Notch1、a-Notch1、RBP-Jκ、Hes-1及Hes-5的稀释比例分别为1∶4 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶500);次日洗膜后,在室温条件下,于摇床上与HRP偶联的二抗孵育1 h,孵育结束后洗膜,除去多余二抗。使用ECL化学发光液,于凝胶成像仪中显色并拍照。最后,通过Image J软件对条带进行分析。GAPDH为内参,试验重复3次。
1.9 统计学分析
2 实验结果
2.1 药物毒性作用考察及浓度确定
与对照组比较,细胞的增殖率随着ox-LDL对A7R5细胞刺激浓度的升高而升高,在其浓度大于50 μg·mL-1后,这种促进细胞增殖的作用减弱(图1)。
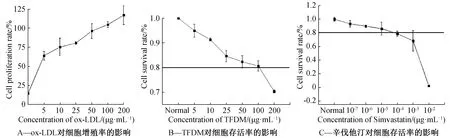
图1 不同浓度的ox-LDL、TFDM及simvastatin对A7R5细胞增殖率、存活率的影响
此外,细胞存活率随着TFDM及辛伐他汀浓度的升高而降低。从细胞存活率及其总体趋势来看,当TFDM刺激浓度达到100 μg·mL-1、辛伐他汀浓度为10-5μg·mL-1时,细胞存活率降低至80%,高于此浓度则存活率显著下降。因此,选择浓度为50 μg·mL-1的ox-LDL作为造模浓度,25、50、100 μg·mL-1的TFDM作为低、中、高给药剂量组,1×10-5mol·L-1作为辛伐他汀的作用浓度。
2.2 香青兰总黄酮对ox-LDL诱导的细胞增殖的影响
表1所示为CCK-8实验的结果,与正常组相比,ox-LDL作用24 h后的各组细胞异常增殖明显增加(P<0.001)。与模型组相比,TFDM-H和辛伐他汀显著抑制了细胞的异常增殖作用(P<0.001),中、低剂量地TFDM对细胞异常增殖有一定的抑制作用但不明显,差异不具有统计学意义。结果表明TFDM对ox-LDL诱导的VSMCs的异常增殖具有抑制作用,且具有一定剂量依赖性。
表1 香青兰总黄酮对ox-LDL诱导的细胞增殖的影响
2.3 香青兰总黄酮对ox-LDL诱导的细胞迁移的影响
Transwell实验发现ox-LDL显著增强VSMCs的迁移能力(P<0.05),中、高剂量的TFDM能明显减弱这种异常的迁移能力(P<0.05)(图2),低剂量的TFDM作用效果不明显。辛伐他汀也能有效抑制细胞迁移,且较TFDM效果更好。TFDM对ox-LDL诱导的VSMCs迁移能力异常具有抑制作用。
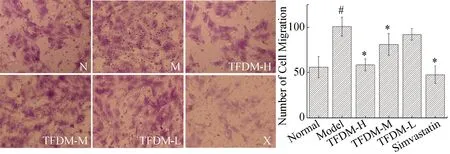
与正常组比较,#P<0.05;与模型组比较*P<0.05;放大倍数:20×10。
2.4 香青兰总黄酮对细胞SM22α,α-SMA蛋白表达的影响
与正常组相比,模型组SM22α和α-SMA蛋白的表达明显降低(P<0.05);与模型组比,药物处理后,TFDM-H组和辛伐他汀组的分化型蛋白SM22α和α-SMA表达均明显升高(P<0.05),差异有统计学意义(图3)。TFDM-M 能显著上调SM22α的表达,对α-SMA表达有上调作用,但不显著。而低剂量的TFDM对SM22α和α-SMA的作用效果有限,其相对表达量与模型组基本无异。SM22α和α-SMA是VSMCs的收缩表型标志蛋白,表达量反映VSMCs的表型。结果表明ox-LDL可诱导VSMCs发生表型转化(由收缩型转变为合成型),而TFDM对ox-LDL诱导的VSMCs表型转化具有抑制作用。
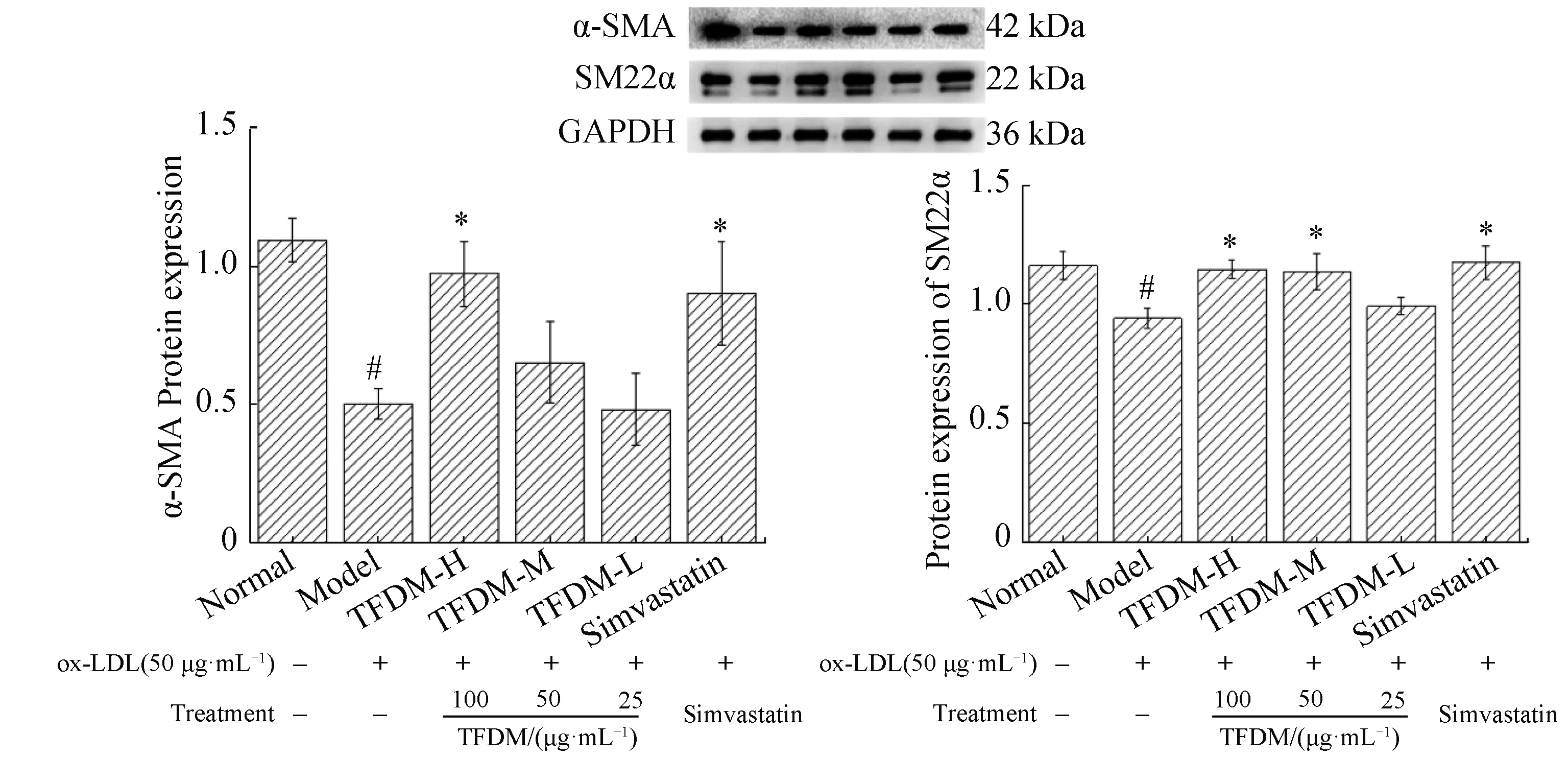
与正常组比较,###P<0.001,##P<0.01,#P<0.05;与模型组比较,***P<0.001,**P<0.01,*P<0.05。
2.5 TFDM对各剂量组对Notch1通路相关蛋白表达的影响
Notch1通路相关蛋白表达的WB实验结果(图4)。
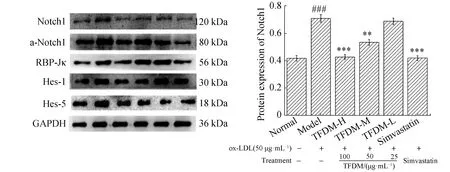
与正常组比较,###P<0.001,##P<0.01,#P<0.05;与模型组比较,***P<0.001,**P<0.01,*P<0.05。
与正常组相比,发生表型转化的VSMCs Notch1、a-Notch1、RBP-Jκ、Hes-1及Hes-5蛋白表达均明显增加(P<0.001,P<0.01或*P<0.05)。而与模型组相比,在分别给细胞加入高、中、低浓度的TFDM后,高剂量的TFDM对Notch1、actived-Notch1、RBP-Jκ、Hes-1及Hes-5表达均有显著的抑制作用(P<0.001,P<0.01或P<0.05);中剂量的TFDM明显抑制Notch1、RBP-Jκ、Hes-1及Hes-5蛋白的表达(P<0.001,P<0.01或P<0.05),而对actived-Notch1的表达没有明显抑制作用;低剂量的TFDM显著抑制a-Notch1和Hes-5的表达(P<0.01或*P<0.05)。显然,ox-LDL诱导VSMCs发生表型转化的过程中,Notch1信号通路被激活且密切参与其中,而TFDM-H对Notch1信号通路的激活有显著的抑制作用,从而起到抑制VSMCs表型转化的作用。
3 讨论
AS斑块的形成与血管壁中各种细胞相互作用有关,包括内皮细胞、淋巴细胞、单核/巨噬细胞和血管平滑肌细胞(VSMCs)等[9]。VSMCs是AS斑块纤维帽中胶原蛋白的主要来源,对斑块的稳定有益且必要。在AS致病因素(细胞因子、脂质刺激和剪应力)的影响下,血管内皮细胞受损、分泌炎症因子,随后中膜的VSMCs受炎症、氧化应激、血流剪切力等的影响,由成熟的收缩表型转变为合成型,这使得VSMCs增殖、迁移能力增加,收缩型标志蛋白SM22α和α-SMA表达减少,敏感性增加而收缩功能消失。随着致病因素表达的增加和脂质的积累,VSMCs表型逐渐向“巨噬细胞型”转化[10],同巨噬细胞一起汇聚至损伤部位,通过内吞作用吞噬脂质,形成肌源性的泡沫细胞,进一步促进AS斑块的形成,加剧AS病变进程[11-12]。因此,抑制VSMCs的表型转化对抑制AS斑块形成及其病情发展有重要意义。
本实验中采用ox-LDL刺激VSMCs发生表型转化,发现其增殖、迁移显著增加,SM22α和α-SMA表达被显著抑制,而香青兰总黄酮对其表型转化具有保护作用,TFDM-H尤为显著地抑制了其异常增殖、迁移,并上调了SM22α和α-SMA的表达。辛伐他汀作为阳性药,是很好的降血脂及抗AS的药物,对VSMCs的异常增殖及迁移具有很好的抑制作用[13-14],但肝、肾毒性较大,实验结果显示TFDM-H对VSMCs表型转化的抑制作用与辛伐他汀组的作用相当。课题组前期的动物实验结果显示,TFDM可以有效抑制AS斑块的形成,降低血脂,抑制炎症反应[15-16]。本实验从细胞水平,进一步解释了TFDM防治AS的作用可能与抑制了VSMCs的表型转化有关,并探讨了可能的机制。
Notch信号通路是高度保守的Ⅰ型跨膜受体蛋白家族,广泛分布于多种组织细胞,Notch1是该家族中最受关注的受体蛋白,通过相邻细胞的交互作用调控细胞的分化[17]。Notch1与其配体结合,使Notch1胞外结构被释放,而胞内域(Notch1 intracellular domain,N1ICD)在γ-分泌酶(γ-secretase protease)的作用下被释放如细胞内[18]。N1ICD进入细胞核与RBP-Jκ结合形成复合体,从而调节转录、激活下游靶基因Hes-1、Hes-5等的表达,进而影响细胞增殖、分化与凋亡[19]。本实验测定Notch1通路相关蛋白表达,结果显示,ox-LDL激活了Notch1通路,相关蛋白的表达量显著升高;而TFDM明显下调了Notch1通路相关蛋白的表达,抑制了通路的激活。因此,本实验的结果表明,TFDM对AS的防治作用可能是通过调控Notch1信号通路,抑制了VSMCs的表型转化实现的。
本研究从另一角度探讨了香青兰总黄酮对动脉粥样硬化的防治作用,发现香青兰总黄酮不仅可以通过降低血脂水平、抑制炎症反应抗动脉粥样硬化,还可通过在AS早期抑制Notch1通路的激活,从而抑制VSMCs的表型转化、过度增殖和异常迁移而实现,对于AS病程的延缓具有重要意义。然而,本实验的研究仅为体外细胞,具体其在机体内是否具有同样的作用机制还需进一步的在体研究深入探讨。

