原花青素抑制Aβ25-35诱导的人神经母细胞瘤细胞系SH-SY5Y分泌Aβ1-42
李 琪,张小强*,陶一凡,朱孟雯,崔丹丹,孙腾腾
(东南大学 1.公共卫生学院; 2.环境医学工程教育部重点实验室, 江苏 南京 210009)
阿尔茨海默病(Alzheimer’s disease,AD)是一种以细胞外β淀粉样斑块沉积、细胞内神经原纤维缠绕形成以及神经细胞死亡为病理特征的神经退行性疾病[1]。阿尔茨海默病患病人数的急剧上升给经济带来巨大负担,预防和控制阿尔茨海默病有重要意义。
Wnt信号通路对细胞增殖、分化、凋亡及细胞极性、肿瘤细胞的迁移和侵袭都有影响,经典Wnt信号通路在维持神经系统和神经元发育中起着重要作用[2-4]。大量研究显示Wnt/β-catenin信号通路的失调在AD多种病因中发挥作用[5-6]。
原花青素(proanthocyanidins, PC)是一种具有抗炎、抗氧化,能够减缓衰老的多酚类物质,对神经损伤有显著的保护作用[1, 7-8]。关于PC对神经系统疾病保护作用的机制尚未完全阐明。本研究以β淀粉样肽(amyloid-β peptide,Aβ)Aβ25-35诱导SH-SY5Y细胞,探究PC对糖原合成酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)、β-连接蛋白(β-catenin)以及Aβ1-42表达水平的影响,并观察应用Wnt/β-catenin信号通路内源性阻断剂Dickkopf-1(Dkk1)后各指标的变化情况,旨在为拓展PC应用领域,预防阿尔茨海默病提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞系:人神经母细胞瘤细胞系SH-SY5Y(中国典型培养物保藏中心)。
1.1.2 药品及主要试剂:原花青素(纯度>95%)(上海阿拉丁生化科技有限公司);Aβ25-35(纯度>99%)(ApexBio公司);重组人Dkk1(Peprotech公司);DMEM高糖培养基(Hyclone公司);胎牛血清(ClarkBio公司);MTT试剂(Sigma-Aldrich公司);BCA蛋白浓度试剂盒(上海碧云天生物技术有限公司);人淀粉样肽(Aβ1-42)ELISA试剂盒(上海酶联生物科技有限公司);β-catenin、GSK-3β、p-GSK-3β抗体和二抗m-IgGκ BP-HRP(Santa Cruz公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:将SH-SY5Y细胞培养于含10%胎牛血清、1%青霉素与链霉素的DMEM完全培养基中,置于5% CO2、37 ℃恒温培养箱中孵育,当细胞汇合度达到80%~90%时进行传代。分为空白组、对照组、Aβ25-35组(1、5、15、20、25 μmol/L)、原花青素组(0.1、1.0、2.5、5.0、7.5、10.0 μg/mL)、原花青素(1.0、2.5、5.0、7.5、10.0 μg/mL)+Aβ25-35(15.0 μmol/L)组、Dkk1(100 ng/mL)组和Dkk1(100.0 ng/mL)+原花青素(7.5 μg/mL)+Aβ25-35(15.0 μmol/L)组。
1.2.2 MTT法检测细胞活力:将SH-SY5Y细胞以1×104个/mL的浓度接种于96孔板,每孔100 μL。测定原花青素对Aβ25-35染毒的SH-SY5Y细胞活力的影响时,原花青素干预组加入含Aβ25-35培养液预处理2 h,更换含原花青素培养液继续培养24 h。MTT法检测细胞活力。用酶标仪在波长492 nm处测定吸光度(A值),计算各组细胞活力。

1.2.3 Western blot 检测相关蛋白表达:将SH-SY5Y细胞以1×104个/mL的浓度接种于6孔板中,每孔2 mL。Dkk1提前1 h加入,其他干预液添加同1.2.2。用添加蛋白酶抑制剂混合物的RIPA裂解液提取蛋白,冰浴操作,BCA法定量蛋白浓度。取适量蛋白进行凝胶电泳分离、转膜、封闭,分别以β-catenin、GSK-3β、p-GSK-3β一抗4 ℃孵育过夜,洗膜后二抗m-IgGκ BP-HRP室温孵育2 h,再次洗膜,加超敏ECL化学发光试剂显影,用Image J软件分析吸光度值。
1.2.4 ELISA检测Aβ1-42的表达:将SH-SY5Y细胞以浓度为1×104个/mL接种于12孔板中,每孔1 mL。收集细胞上清液于灭菌离心管中,4 ℃,3 000 r/min离心15 min,收集上清,按照ELISA试剂盒说明书操作,用酶标仪在波长450 nm处测定吸光度(A)值,根据标准曲线计算Aβ1-42表达水平。
1.3 统计学分析

2 结果
2.1 PC对Aβ25-35诱导的SH-SY5Y细胞活力及Aβ1-42分泌水平的影响
与对照组相比,实验剂量的PC对细胞增殖无明显影响(图1A)。与对照组相比,15、20、25 μmol/L的Aβ25-35使细胞活力降低(P<0.05)(图1B)。与15 μmol/L Aβ25-35组相比,PC干预24 h后细胞活力升高(P<0.05)(图1C)。
与对照组相比,用15 μmol/LAβ25-35诱导细胞后,Aβ1-42的分泌水平升高(P<0.05);以不同浓度PC干预,Aβ1-42的分泌水平降低(P<0.05)。在一定剂量范围内,PC干预可降低Aβ1-42表达水平并呈现剂量-效应关系(r=0.990,P<0.05)(图1D)。

A-C.effects of PC, Aβ25-35 or PC+Aβ25-35 on cell viability; D.secreted Aβ1-42 was measured by ELISA; *P<0.05 compared with control group; #P<0.05 compared with Aβ25-35 group图1 PC和(或)Aβ25-35对SH-SY5Y细胞活力及Aβ1-42分泌水平的影响Fig 1 Effects of PC and (or) Aβ25-35 on the cell viability or the secreted Aβ1-42 in SH-SY5Y n=3)
2.2 PC对Wnt/β-catenin信号通路相关蛋白表达水平的影响
与对照组相比,15 μmol/L Aβ25-35处理后,细胞中β-catenin蛋白及p-GSK-3β(Ser9)蛋白表达水平降低(P<0.05)。用不同浓度PC干预后,细胞中β-catenin蛋白及p-GSK-3β(Ser9)蛋白的表达水平升高(P<0.05)。在一定剂量范围内,PC干预可提高β-catenin蛋白的表达水平并呈现剂量-效应关系(r=0.932,P<0.05)(图2)。
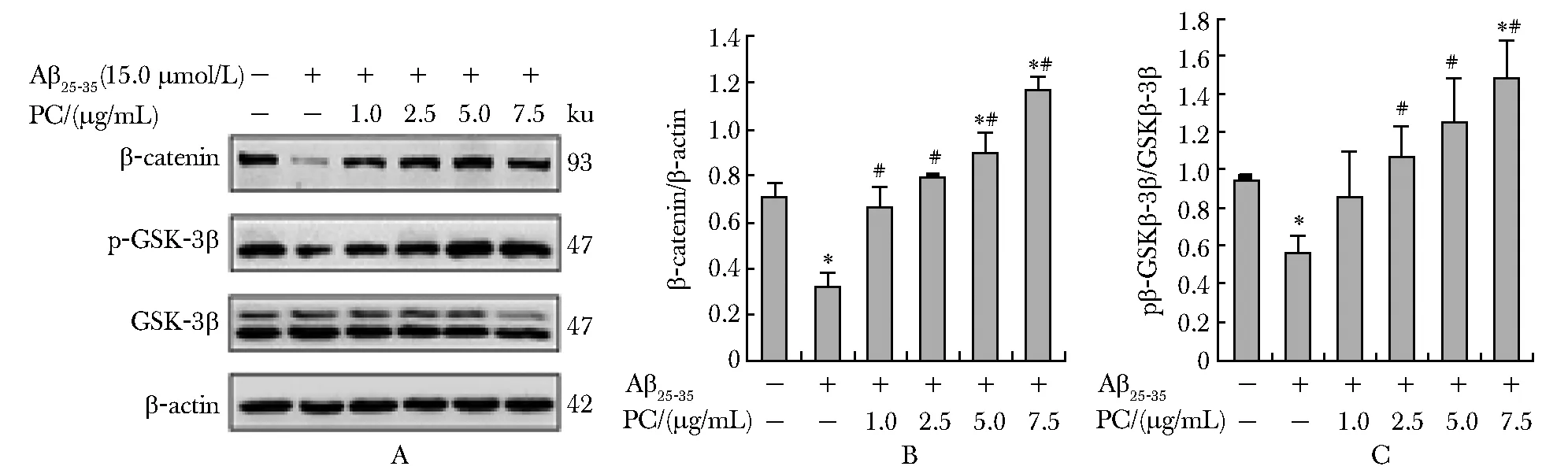
A.Western blot analysis of the β-catenin、GSK-3β or p-GSK-3β(Ser9) protein levels; B,C.effects of PC on β-catenin or p-GSK-3β(Ser9)protein expressions; *P<0.05 compared with control group; #P<0.05 compared with Aβ25-35 group图2 PC干预对Aβ25-35诱导的SH-SY5Y细胞β-catenin和p-GSK-3β(Ser9)蛋白表达的影响Fig 2 Effects of PC on β-catenin or p-GSK-3β(Ser9) protein expressions in SH-SY5Y cells induced
2.3 PC通过Wnt/β-catenin信号通路降低Aβ1-42的分泌
与对照组相比,Aβ25-35组和Dkk1组β-catenin蛋白和p-GSK-3β(Ser9)蛋白表达水平下降(P<0.05),细胞分泌的Aβ1-42增多(P<0.05)。预先加入Dkk1后,与Aβ25-35+PC组相比,细胞中β-catenin蛋白和p-GSK-3β(Ser9)蛋白表达水平下降(P<0.05),Aβ1-42分泌增多(P<0.05)(图3)。
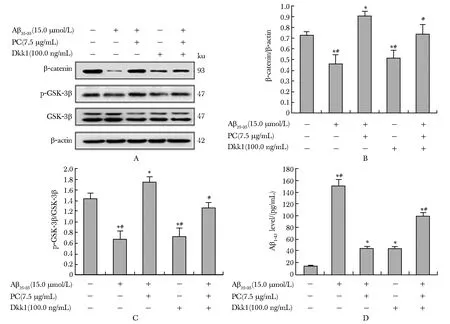
A.Western blot analysis of the β-catenin、GSK-3β or p-GSK-3β(Ser9) protein levels;B,C. effects of PC on β-catenin or p-GSK-3β(Ser9) protein expressions;D.secreted Aβ1-42 was measured by ELISA; *P<0.05 compared with control group;#P<0.05 compared with Aβ25-35 +PC group图3 PC通过Wnt/β-catenin信号通路降低Aβ25-35诱导的SH-SY5Y细胞Aβ1-42的分泌Fig 3 Effects of PC on the regulation of the secreted Aβ1-42 through Wnt/β-catenin signaling pathway in SH-SY5Y cells induced by n=3)
3 讨论
Wnt信号通路在神经系统发育期间就开始发挥功能,并影响成人大脑中的突触可塑性,该途径在预防神经退行性疾病中有重要意义[2]。激活Wnt/β-catenin信号通路可以降低神经炎性反应的发生,减少抑郁行为的出现,阻止小胶质细胞活化等,该作用与GSK-3β抑制以及β-catenin积累有关[6]。
p-GSK-3β(Ser9)作为GSK-3β蛋白磷酸化的抑制性位点,可抑制GSK-3β表达[9]。本研究结果显示,在一定剂量范围内,应用PC可逆转Aβ25-35诱导的SH-SY5Y细胞中p-GSK-3β(Ser9)蛋白表达下降,提高其介导的GSK-3β抑制作用。GSK-3β作为Wnt/β-catenin信号通路的负调节因子,可参与氧化应激、炎性反应、细胞凋亡等大量分子和细胞功能的调节[10]。GSK-3β激活通过调节APP的裂解参与AD脑中Aβ的形成和积累,GSK-3β更是确定的tau蛋白主要激酶[11]。
同时,实验结果还显示,PC干预还可改善Aβ25-35诱导所致细胞β-catenin蛋白表达水平的降低。因此,β-catenin可以看做是Wnt信号传导的下游效应器。在N2a细胞中,促进β-catenin与TCF4结合可抑制BACE1表达,降低Aβ浓度[12]。Wnt/β-catenin信号功能障碍时,在小鼠或者离体细胞水平细胞内Aβ1-40和Aβ1-42的含量会上升[13]。Aβ沉积和tau蛋白过度磷酸化是阿尔茨海默病的重要病理改变。Wnt/β-catenin信号通路有可能是未来预防和治疗阿尔茨海默病治疗中的重要靶点。
本研究结果显示,给予PC干预后,能明显降低Aβ25-35诱导的SH-SY5Y细胞中Aβ1-42分泌。预先加入Wnt/β-catenin信号通路抑制剂Dkk1后,再用原花青素干预Aβ25-35诱导的细胞,细胞中β-catenin、p-GSK-3β(Ser9)的分泌水平较未加入Dkk1组均降低,而Aβ1-42分泌水平上升。说明PC对细胞的保护作用降低,PC可能通过Wnt/β-catenin信号通路发挥对Aβ25-35诱导的SH-SY5Y细胞损伤的保护作用。
综上所述,PC可抑制Aβ25-35诱导的SH-SY5Y细胞Aβ1-42生成,该作用可能与Wnt/β-catenin信号通路有关。本实验结果可为以Wnt/β-catenin信号通路为靶点开发阿尔茨海默病新药物提供实验依据,也为拓展PC应用范围,开发PC新功效提供新思路。

