急性冠状动脉综合征患者经皮冠状动脉介入治疗围术期合并上消化道出血的预后
赵晓琳 黄坤 杨友鹏 高峰 程建平 于久飞
100123 民航总医院(北京大学民航临床医学院)消化肿瘤科(赵晓琳、黄坤、程建平、于久飞),心内科(高峰); 100049 航天中心医院(北京大学航天临床医学院)消化内科(杨友鹏)
急性冠状动脉综合征(acute coronary syndrome,ACS)的抗栓(抗凝或抗血小板)是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的重要组成部分[1],可预防、降低围手术期和长期的缺血性心血管事件,包括支架血栓形成和再发心肌梗死等[2]。然而,抗栓治疗增加出血事件的发生。其中,消化道出血(gastrointestinal bleeding,GIB)发生率为10%~15%[3-4]。GIB会影响预后,增加早期(住院期间和出院30 d)和晚期发生不良心血管事件(major adverse cardiac event,MACE)风险[5-7]。因此,需要重视发生GIB的高危患者。
我们回顾性分析2014年12月1日至2019年10月31日在民航总医院和航天中心医院心内科行PCI的ACS患者,探讨随访1年发生出血事件和缺血事件的风险。
1 对象和方法
1.1 研究对象
双中心回顾性病例对照研究。2014年12月1日至2019年10月31日在民航总医院和航天中心医院行PCI治疗的ACS患者共有3 582例,其中男性2 029例(56.6%),平均年龄为56.9岁。根据PCI围术期是否发生GIB,分为GIB组(69例)和对照组(3 513例)。
纳入标准:(1)年龄18~85岁,男女不限;(2)有胸痛等缺血症状,经心电图、心肌酶等检查明确诊断为ACS;(3)均接受PCI术;(4)临床资料完整;(5)同意随访。排除标准:(1)年龄<18岁,或>85岁;(2)有消化系统恶性肿瘤病史;(3)有肝硬化食管胃底静脉曲张或门脉高压性胃病;(4)有出血倾向的血液系统疾病或自身免疫性疾病;(5)心、肺、肝、肾等脏器功能严重障碍;(6)脑卒中等脑血管事件;(7)近期行大手术史;(8)神志不清,不能配合治疗;(9)拒绝随访。本研究符合医学伦理学要求,获得本院伦理委员会审核批准。
1.2 方法
收集并记录患者人口学资料(年龄、性别、吸烟史、体质指数)、既往病史(高血压、糖尿病、高脂血症、心房颤动、慢性肾脏病、消化性溃疡)、ACS类型(不稳定性心绞痛、非ST段抬高型心肌梗死、ST段抬高型心肌梗死)、心功能(左室射血分数、左室舒张末期容积、左室收缩末期容积)、治疗[阿司匹林、氯吡格雷、替格瑞洛、低分子肝素、血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂、口服抗凝药(华法林、利伐沙班、达比加群酯)、非甾体抗炎药、类固醇和质子泵抑制剂(proton pump inhibitor,PPI)]和PCI治疗情况(罪犯血管、病变血管数、GRACE评分、Killip分级>Ⅱ级率、术后TIMI血流3级率、完全血运重建率、抽吸导管)。
GIB患者均行消化内镜检查,并根据内镜下出血分级(Forrest分级)评估再出血风险,包括(1)Ⅰa级:可见喷射性的动脉出血;(2)Ⅰb级:可见活动性渗血;(3)Ⅱa级:溃疡处可见裸露的血管;(4)Ⅱb级:溃疡处可见血凝块附着;(5)Ⅱc级:溃疡为黑色基底,未见出血及血凝块;(6)Ⅲ级:基底洁净。
1.3 观察指标和随访
主要通过门诊和电话随访,评估PCI术后1年再发出血事件和MACE事件。其中,出血事件参照出血学术研究会(bleeding academic research consortium,BARC)出血定义[7]。轻微出血为BARC 1型出血,严重出血为BARC 3型和5型出血,有临床意义的出血为BARC 2型、3型和5型出血。MACE事件包括全因死亡、再发心肌梗死、再次行血运重建和因心力衰竭住院。
1.4 统计学方法
2 结果
2.1 GIB组患者的出血病因分析
69例(1.9%)围术期发生GIB。中位出血时间为PCI术后3.0 d,胃镜检查发现,3例(4.3%)贲门黏膜撕裂综合征,43例(62.3%)胃溃疡,3例(4.3%)胃癌、3例(4.3%)出血性胃炎,1例(1.4%)胃息肉,16例(23.1%)十二指肠溃疡。
2.2 GIB组和对照组患者的基线临床资料比较
如表1所示,与对照组相比,GIB组患者年龄更大、女性更多、体质指数较低,更多合并高血压、心房颤动、慢性肾脏病和消化性溃疡病史(均为P<0.05);此外,GIB组患者的替格瑞洛和口服抗凝药使用率显著高于对照组(均为P<0.05),而PPI的使用率显著低于对照组(P<0.05)。
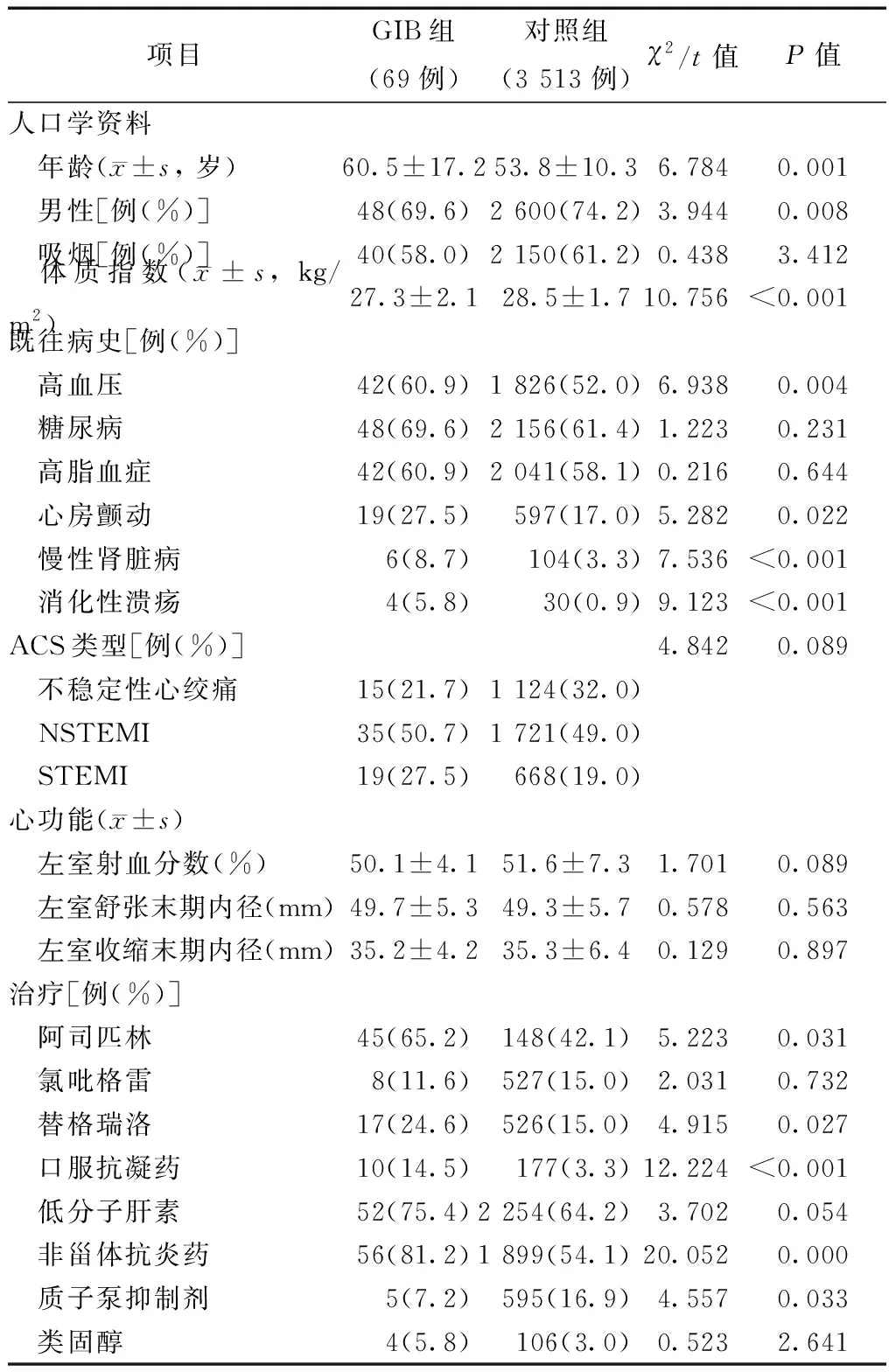
表1 GIB组和对照组的基线临床资料比较
2.3 GIB组和对照组患者的围术期资料比较
GIB组的右冠状动脉为罪犯血管率(34.8%比24.4%)、GRACE评分[(170.9±28.1)分比(165.7±20.3)分]、替罗非班使用率(34.8%比21.1%)和抽吸导管使用率(17.4%比9.5%)均显著高于对照组(均为P<0.05),而三支冠状动脉病变率(47.8%比62.0%)和完全血运重建率(69.6%比78.5%)显著低于对照组(均为P<0.05),但两组的Killip分级>Ⅱ级和术后TIMI血流3级率等均相似(均为P>0.05)。
2.4 患者预后
平均随访(12.4±3.3)个月,失访509例(14.2%)。随访期间,与对照组比较,GIB组的全因死亡(4.7%比3.3%)、再发心肌梗死(13.0%比8.3%)、再行血运重建(8.7%比7.3%)、因心力衰竭住院(8.7%比7.2%)和MACE事件(34.8%比27.7%)、轻微出血(BARC 1型)(29.0%比20.4%)和严重出血(BARC 3型和5型)(4.3%比2.4%)的发生率均相似(均为P>0.05),但GIB组的有临床意义出血(17.1%比8.8%)的发生率显著高于对照组(P<0.05)。
2.5 影响有临床意义出血的相关因素
将单因素logistic分析中所有可能影响有临床意义出血的因素(P<0.2),进一步纳入多因素logistic回归模型,结果显示,年龄>65岁(RR=1.813,95%CI:1.021~3.219)、女性(RR=2.014,95%CI:1.253~3.237)、消化性溃疡病史(RR=2.152,95%CI:1.156~4.006)、慢性肾脏病≥2期(RR=1.623,95%CI:1.196~2.202)和口服抗凝药(RR=1.352,95%CI:1.032~1.771)均为影响有临床意义出血的独立危险因素,而PPI为其保护因素(RR=0.573,95%CI:0.345~0.952)。
3 讨论
围术期发生出血增加了ACS患者随访发生缺血事件风险[8-9]。ACUITY试验纳入了13 819例ACS患者,随访发现,GIB的发生率为1.3%,GIB是影响随访30 d发生不良缺血事件的重要因子,复合缺血事件的HR为1.94[10]。在PAMI研究中,发现GIB显著增加6个月随访的死亡风险(14%比4.6%)[11]。与既往研究不同,本研究发现与对照组比较,GIB组的全因死亡(4.7%比3.3%)、再发心肌梗死(13.0%比8.3%)、再行血运重建(8.7%比7.3%)、因心力衰竭住院(8.7%比7.2%)和MACE事件(34.8%比27.7%)的发生率均相似(均为P>0.05),但GIB组的有临床意义出血(BARC 2型、3型和5型)(17.1%比8.8%)的发生率显著高于对照组(P<0.05)。因此,需要重视围术期发生GIB的高危患者。
抗栓等可增加出血的发生风险。研究发现,双联抗血小治疗通常会增加GIB的风险[11]。此外,大量研究证实高龄、ST段抬高型心肌梗死、心脏骤停、贫血、吸烟、糖尿病和既往出血史或消化性溃疡病等均显著增加GIB的发生风险[12-13]。与既往研究相似,本研究发现,年龄>65岁(RR=1.813)、女性(RR=2.014)、消化性溃疡病史(RR=2.152)、慢性肾脏病≥2期(RR=1.623)和口服抗凝剂(RR=1.352)均为影响有临床意义出血的独立危险因素。
PPI可降低PCI治疗患者短期再发出血的风险[14]。COGENT试验纳入3 761例ACS接受PCI治疗的患者,随访180 d发现,PPI组的明显或隐匿的GIB、有症状的十二指肠溃疡或糜烂、阻塞或穿孔等复合事件风险显著降低(HR=0.34,95%CI:0.18~0.63)[14],明显的出血发生率显著降低(HR=0.13,95%CI:0.03~0.56)。此外,根除幽门螺旋杆菌有利于降低GIB的发生风险[15]。同既往研究结果类似,本研究发现,PPI为有临床意义出血的保护因素(RR=0.573)。因此,对于此类GIB高危患者,我们建议消化科就诊,推荐使用泮托拉唑、雷贝拉唑等PPI,并定期行消化内镜随访。
总之,ACS患者随访1年,围术期GIB可显著增加有临床意义出血的发生风险,PPI可降低再发出血风险。但本研究有一定局限性,为回顾性病例对照研究,纳入的周期较长,未评估长期随访情况,故需更多研究证实。
利益冲突:无

