瘤胃液对全株甜高粱青贮质量的影响
任海伟,卢娜娜,路力榕,孙文丽,王治业,李金平,3,4,李志忠
瘤胃液对全株甜高粱青贮质量的影响
任海伟1,2,3,卢娜娜1,路力榕1,孙文丽1,王治业2,李金平1,3,4,李志忠1※
(1. 兰州理工大学生命科学与工程学院/西部能源与环境研究中心,兰州 730050; 2. 甘肃省科学院生物研究所,兰州 730000;3. 甘肃省生物质能与太阳能互补供能系统重点实验室,兰州 730050;4. 西北低碳城镇支撑技术协同创新中心,兰州 730050)
甜高粱是一种重要的能源作物,为实现长时间贮存并提升糖化效率,该研究分析了瘤胃液不同添加量对全株甜高粱青贮品质和酶解糖化效果的影响。设置R1、R3、R5和R7共4个瘤胃液处理组(添加量依序分别为1、3、5和7 mL/100 g原料)和1个对照组(CK,等量蒸馏水),考察了瘤胃液不同添加量对全株甜高粱青贮过程中有机组分、发酵品质和酶解性能等质量指标的动态影响,并跟踪解析青贮期间微生物菌群的动态演绎。结果表明,添加瘤胃液能明显减少青贮甜高粱中的干物质、水溶性碳水化合物、粗蛋白以及木质纤维组分含量,使青贮pH和氨氮含量显著下降(<0.05),并与瘤胃液添加量呈负相关。青贮中的乳酸、乙酸含量随瘤胃液添加量和青贮发酵时间延长而明显增加(<0.05),瘤胃液强化了青贮发酵并有助于减少干物质损失,尤其在较高添加量时,青贮60 d时的甜高粱综纤维素含量反而有所增加。4种瘤胃液处理组的门水平优势细菌主要为厚壁菌和变形菌,厚壁菌相对丰度随时间延长和瘤胃液添加量的增加而逐渐增加,变形菌门丰度则逐渐下降;属水平主要以乳酸杆菌、泛菌和醋酸杆菌为主,乳酸杆菌丰度与时间、瘤胃液添加量呈正相关,而泛菌则呈减少趋势。瘤胃液强化青贮后的甜高粱还原糖得率显著提升,尤其瘤胃液添加量为7 mL/100 g的R7处理组的糖得率较原料分别提高了11.06%(30 d)和19.28%(60 d)。添加瘤胃液能有效改善青贮甜高粱的发酵质量和生物降解性能,起到生物强化的预处理作用,为甜高粱的乙醇化利用奠定了基础。
甜高粱;青贮质量;瘤胃液;微生物菌群;酶解糖化
0 引 言
甜高粱又称糖高粱,是一种具有优良生长特性的C4“高能植物”,具有生长速度快、高光合作用、耐旱涝、耐盐碱、耐瘠薄等优点[1]。甜高粱常被用于生产动物饲料、生物能源、生物材料等,但由于甜高粱收获的季节性、时效性等特点,只有及时高效贮存才能减少采后植株水分和养分的损失,抑制茎秆木质化,并实现原料的周年可持续供给[2]。另一方面,甜高粱茎秆含有大量纤维素、半纤维和木质素等组分,形成天然的抗降解屏障网络结构,大大限制了生物降解性能,进而影响生物能源制备的生化转化效率[3]。
青贮不仅能通过湿法保存技术实现生物质原料的跨季节贮存,还对木质纤维生物质有一定预处理作用[4]。研究表明,添加微生物菌剂、酶制剂等外源生物制剂能有效改善青贮发酵品质,提高木质纤维组分的降解和转化利用效率。Nkosi等[5]发现甜高粱青贮过程中添加植物乳杆菌和酶制剂(纤维素酶与半纤维素酶复合)能显著提高乳酸浓度,降低pH值、丁酸、氨氮和纤维组分含量。Li等[6]发现产阿魏酸酯酶乳酸菌和纤维素酶能提高玉米秸秆青贮质量,并促进纤维素转化效率。Zhang等[7]认为添加植物乳杆菌与纤维分解菌能有效促进玉米青贮发酵进程,提高木质纤维降解速率。然而,由于青贮体系中的木质纤维降解菌群相对较少且不专一,致使青贮过程兼具的内源性生化预处理作用相对较弱,对木质纤维结构解聚和组分优化效果较为有限[8]。若能在甜高粱青贮过程中导入适宜的外源生物转化系统来强化木质纤维分解,则对提高其生化转化效率具有积极作用。
“鲜活”的反刍动物瘤胃液栖息有大量天然微生物菌群(主要包括普氏杆菌、瘤胃球菌等纤维分解菌,以及溶纤维丁酸弧菌、嗜淀粉瘤胃杆菌等蛋白降解菌)及其代谢酶系(纤维素酶、半纤维素酶和蛋白酶等),是一类能有效克服木质纤维屏障的天然特异性“生物处理系统”[9]。稻草经瘤胃液生物强化处理后,木质纤维组分含量显著下降,产甲烷量增加83%,纤维素降解时间缩短40%[10]。玉米青贮过程中添加瘤胃真菌CN6 CGMCC能显著降低pH值以及乙酸、酸性洗涤纤维和中性洗涤纤维含量,提高乳酸、粗蛋白和可发酵糖含量[11]。可见,反刍动物瘤胃微生物在青贮发酵过程中能发挥生物强化作用。而且,瘤胃液还具有与青贮过程耦合协同的环境基础(如厌氧、低pH值等)、物质基础(有机酸)和代谢纽带[12]。鉴此,本文将肉牛瘤胃液作为一种外源生物活性添加剂用于甜高粱青贮过程,着重从有机成分、木质纤维组分、发酵品质、酶解特性等方面探究添加不同剂量瘤胃液对青贮质量和生物降解性能的影响,并结合微生物菌群分析瘤胃液强化青贮的作用机理,拟为甜高粱青贮和能源化利用奠定基础。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
全株青绿甜高粱取自中科院近代物理研究所武威种植基地,切碎至2~3 cm备用;肉牛瘤胃液取自武威顶乐生态牧业有限公司,冷冻保存、活化后备用。甜高粱与瘤胃液的主要化学指标如表1所示。
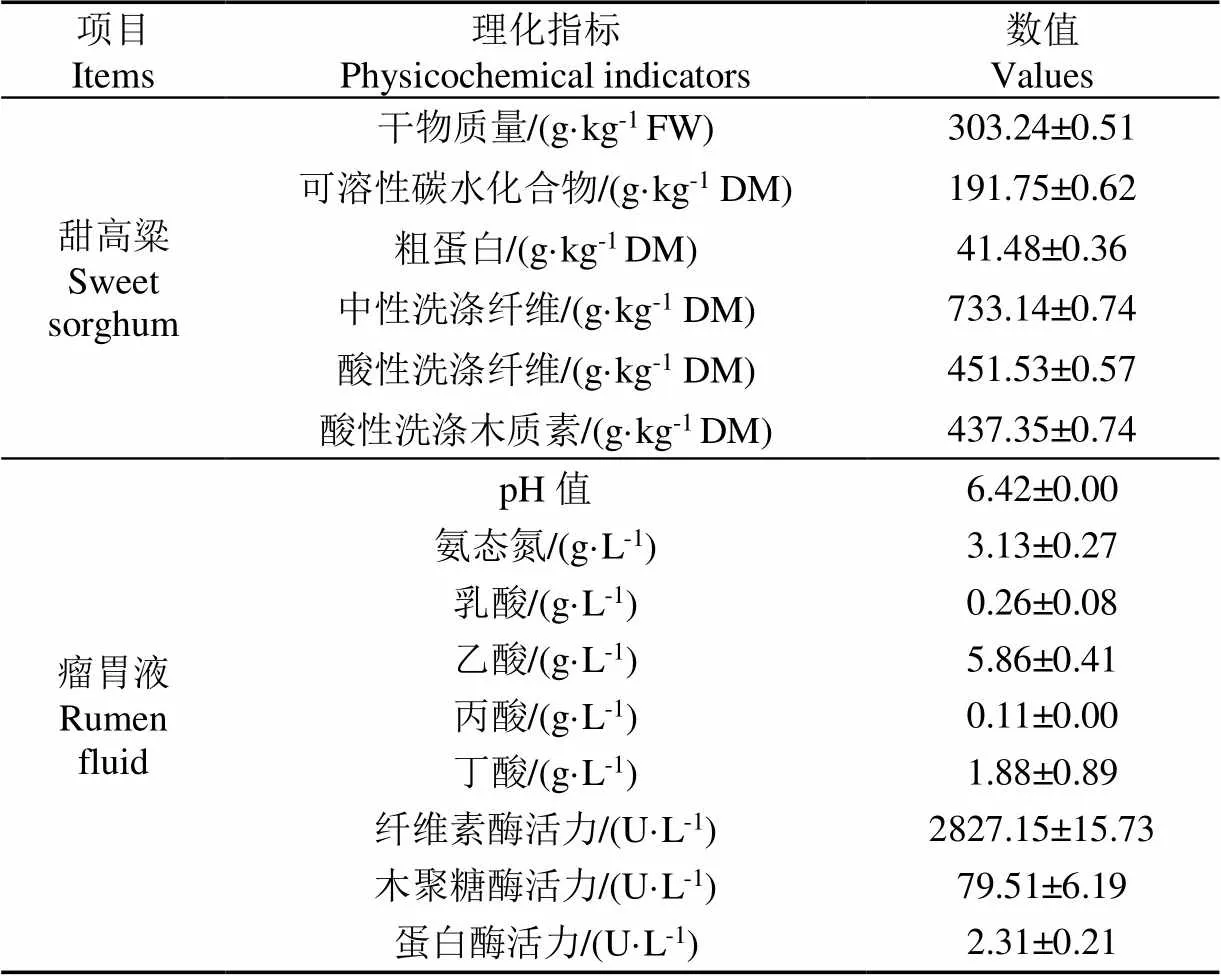
表1 全株甜高粱和瘤胃液的理化指标
注:FW,鲜质量;DM,干物质。纤维素酶活力以滤纸酶活性 (FPU)表示。下同。
Note: FW, fresh weight; DM, dry matter. Cellulase activity was expressed based on the filter paper cellulase activity unit (FPU). The same below.
1.1.2 仪器与设备
F800全自动纤维分析仪测定,山东海能科学仪器有限公司;K9840半自动凯氏定氮仪,山东海能科学仪器有限公司;Agilent 1260 高效液相色谱仪,安捷伦科技公司。
1.2 青贮试验设计与取样
准确称量30份1.5 kg切碎的甜高粱,分别将活化后的肉牛瘤胃液按照1、3、5和7 mL/100 g原料的剂量均匀喷洒至表面,迅速混匀后装入塑料桶中密封,4个瘤胃液青贮组分别命名为R1、R3、R5和R7。空白对照组(CK)喷洒等体积蒸馏水,每个试验组3个平行,置于(20±2)℃恒温环境青贮发酵60 d,并分别于30和60 d时进行质量分析,青贮样品取样与浸提液制备方法参考文献[13]进行。
1.3 青贮质量分析
干物质(Dry Matter,DM)测定采用105 ℃烘干恒重法;水溶性碳水化合物(Water Soluble Carbohydrates,WSC)测定采用3,5-二硝基水杨酸比色法;粗蛋白(Crude Protein,CP)测定采用凯氏定氮法;氨氮(Ammonia Nitrogen,AN)采用苯酚-次氯酸钠分光光度法;中性洗涤纤维(Neutral Detergent Fiber,NDF)、酸性洗涤纤维(Acid Detergent Fiber,ADF)和酸性洗涤木质素(Acid Detergent Lignin,ADL)测定采用全自动纤维分析仪;纤维素(Cellulose,CL)、半纤维素(Hemicellulose,HC)和综纤维素(Holocellulose,HoC)含量计算参考文献[13]。干物质损失率(Dry Matter Loss,LDM)计算公式为
式中DM为干物质含量,g/kg FW。
青贮浸提液pH值测定采用UB-7酸度计;乳酸由(Lactic Acid,LA)、乙酸(Acetic Acid,AA)、丙酸(Propionic Acid,PPA)、丁酸(Butyric Acid,BA)等有机酸分析测定采用高效液相色谱法(High Performance Liquid Chromatography,HPLC),测试条件参考Li等[6]文献报道。
1.4 青贮发酵过程的微生物菌群分析
参照文献[13]中的方法,使用试剂盒提取青贮样品中的总DNA,然后进行16S rRNA 基因的PCR扩增,扩增区域为 16SrRNA (V3+V4) 区,扩增产物经纯化、定量和均一化后形成测序文库,委托北京百迈客生物科技有限公司Illumina HiSeq 2500测序。测序结果与NCBI基因库进行比对,按照97%相似性水平划分操作分类单元(OTU),采用QIIME软件计算Shannon和Chao1指数等Alpha多样性指数,选取相对丰度高于0.1%的细菌类群进行门、属水平菌群分析。
1.5 酶解糖化试验
准确称取0.5 g甜高粱原料或青贮样品于50 mL离心管,以1:20(g/mL)料液比加入柠檬酸缓冲液(pH值4.8,0.05 mol/L),再依次添加纤维素酶(1 000 U/g)、半纤维素酶(500 U/g)、-葡聚糖苷酶(1 U/g),密封后于150 r/min条件下恒温(50±0.5)℃振荡酶解72 h。间隔12 h取样,采用3,5-二硝基水杨酸(DNS)法测定还原糖浓度。每个样品3次平行,对照组用等体积蒸馏水代替酶液。还原糖得率的计算公式[14]为
式中RSY为还原糖得率,mg/g DM;为酶解液中还原糖浓度,g/mL;为酶解液体积,mL;为酶解底物质量,g;0.9为换算系数。
1.6 数据分析
所有数据用平均值±标准差表示,经Excel 2007 软件整理原始数据后采用 SPSS 20.0和Origin 9.0软件进行统计分析并制作图表。对不同处理组数据进行单因素和一般线性模型分析,<0.05代表数据差异显著,>0.05代表数据差异不显著。
2 结果与分析
2.1 添加瘤胃液对青贮期间主要有机组分影响
2.1.1 干物质含量
由图1可知,与原料相比,5个青贮试验组(CK、R1、R3、R5和R7组)的干物质含量均随青贮时间延长和瘤胃液添加量的增加而显著降低(<0.05),且存在明显剂量效应。Borreani等[15]认为生物质青贮后的干物质含量越高,说明营养物质的损失越少,发酵品质越好。本试验中青贮甜高粱干物质含量显著下降的主要原因在于,一方面,常规青贮发酵过程中以优势乳酸菌为主的微生物菌群所参与的生化反应过程需要消耗大量可溶性糖、蛋白质等营养物质作为代谢底物,并产生CO2和挥发酸等物质[15]。另一方面,青贮甜高粱中原本分解相对缓慢的纤维素、淀粉等营养物质很容易被瘤胃液中的纤维分解菌、淀粉分解菌等厚壁菌群及其酶系所分解,从而加剧干物质损失[16]。但值得注意的是,4个添加剂组的干物质损失率均低于CK组(表2)。可见,添加瘤胃液进行强化青贮有助于更好地减少干物质损失,且高剂量瘤胃液对抑制干物质损失的效果更明显。
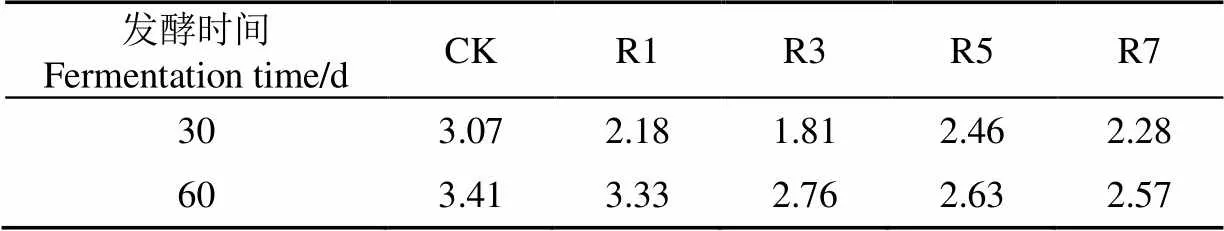
表2 瘤胃液添加量对干物质损失率的影响
2.1.2 水溶性碳水化合物含量
如图2所示,与青贮前原料(192 g/kg DM)相比,整个发酵期间青贮甜高粱的水溶性碳水化合物(Water Soluble Carbohydrates,WSC)含量均明显下降,且随时间延长而呈现显著下降趋势(<0.05)。这主要是因为在发酵过程中,WSC作为微生物菌群繁殖代谢的重要底物被乳酸菌群等有益菌发酵生成乳酸、乙酸等挥发酸产物所致[17]。另一方面,青贮发酵30和60 d时,4个添加剂组的WSC含量均显著低于CK组,且随着瘤胃液添加量的增加而显著降低(除60 d时R7组,<0.05)。这是因为添加瘤胃液后会引入常规青贮体系中所缺少的黄色瘤胃球菌、白色瘤胃球菌等木质纤维分解菌群,进而加速可溶性糖的代谢利用[18]。然而,当瘤胃液添加量处于较高剂量时,甜高粱青贮中所含的淀粉、纤维素等大分子碳水化合物又会被瘤胃微生物菌群及其酶系共同作用,降解生成一定量的可溶性糖,从而使糖含量处于动态平衡状态[16]。总之,青贮发酵时间的延长以及瘤胃液添加量的增加均显著降低了全株甜高粱青贮中的水溶性碳水化合物含量。
2.1.3 粗蛋白含量和木质纤维组分
粗蛋白(CP)也是评价青贮品质优劣的重要指标,青贮期间蛋白质损失主要缘于植物蛋白酶、微生物菌群及其酶系引起的分解作用[19]。由表3可知,除R7组外,CK、R1、R3和R5组的粗蛋白含量均随发酵时间延长而显著降低(<0.05)。同时,由于强化青贮体系中存在溶纤维丁酸弧菌、嗜淀粉瘤胃杆菌等瘤胃微生物及其消化酶系的降解作用,使整个青贮期间蛋白质含量随瘤胃液剂量增加而呈显著下降趋势,并存在剂量效应[20]。说明过长时间的青贮发酵和较高瘤胃液添加量均不利于粗蛋白的保存。
木质纤维组分的构成及含量高低也是影响甜高粱生物降解潜力和生化转化的重要因素。如表3所示,与原料相比,5个试验组的酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)和酸性洗涤木质素(ADL)含量均显著下降,且三者含量均随发酵时间延长而显著降低(除个别组)。这3种组分共同构成了复杂的木质纤维抗降解屏障结构,经过长时间的酸性青贮环境、微生物菌群及其酶系的共存作用使其结构软化,进而导致纤维素和半纤维素含量的联动变化[13]。由于甜高粱细胞壁的纤维素和半纤维素组分被瘤胃液中的瘤胃球菌、普氏杆菌等纤维素降解菌及其分泌酶所降解,使二者含量与发酵时间呈负相关(瘤胃液添加量<3%时)[21],但瘤胃液添加量较高时,二者含量则随时间延长保持不变。Baba等[22]也发现适宜的青贮条件和瘤胃液添加量有利于木质纤维素的降解。另一方面,随着瘤胃液添加量的增加,青贮期间ADF、ADL和NDF等木质纤维组分的含量也呈显著下降趋势,而较低含量的ADF、ADL和NDF有助于提高消化降解率[13]。青贮发酵60 d时,R3和R5组的综纤维素含量均显著高于CK组(<0.05),说明通过长时间、添加较高剂量瘤胃液的强化青贮过程有助于保存甜高粱中的能量物质综纤维素。
总之,青贮时间、瘤胃液添加量以及二者交互作用对粗蛋白、木质纤维组分均有极显著影响。

表3 青贮过程中不同添加量瘤胃液对粗蛋白和木质纤维组分的动态影响
注:*<0.05,影响显著;**<0.01,影响高度显著;***<0.001,影响极显著。下同。
Note: *<0.05, significant effects; **<0.01, very significant effects; and **<0.001, extremely significant effects. The same below.
2.2 青贮期间发酵品质的动态变化
pH值的迅速下降是成功青贮并获得高品质青贮的关键。如表4所示,发酵30 d时,CK组的pH值下降至4.52,濒临青贮腐败变质的临界值;而4个瘤胃液处理组的pH值则下降迅速且均低于4.0,尤其高剂量R7组的pH值为3.55,处于优良青贮范围[23]。青贮发酵pH值的下降主要归因于微生物菌群代谢产生的乳酸和乙酸等有机酸累积,其中乳酸对pH值下降的贡献度相对较高,因为乳酸的酸度系数(pKa=3.86)低于乙酸(pKa=4.77)。另一方面,各试验组的pH 值均随着青贮时间的延长而呈显著下降趋势,Xing等[24]也有类似研究报道。
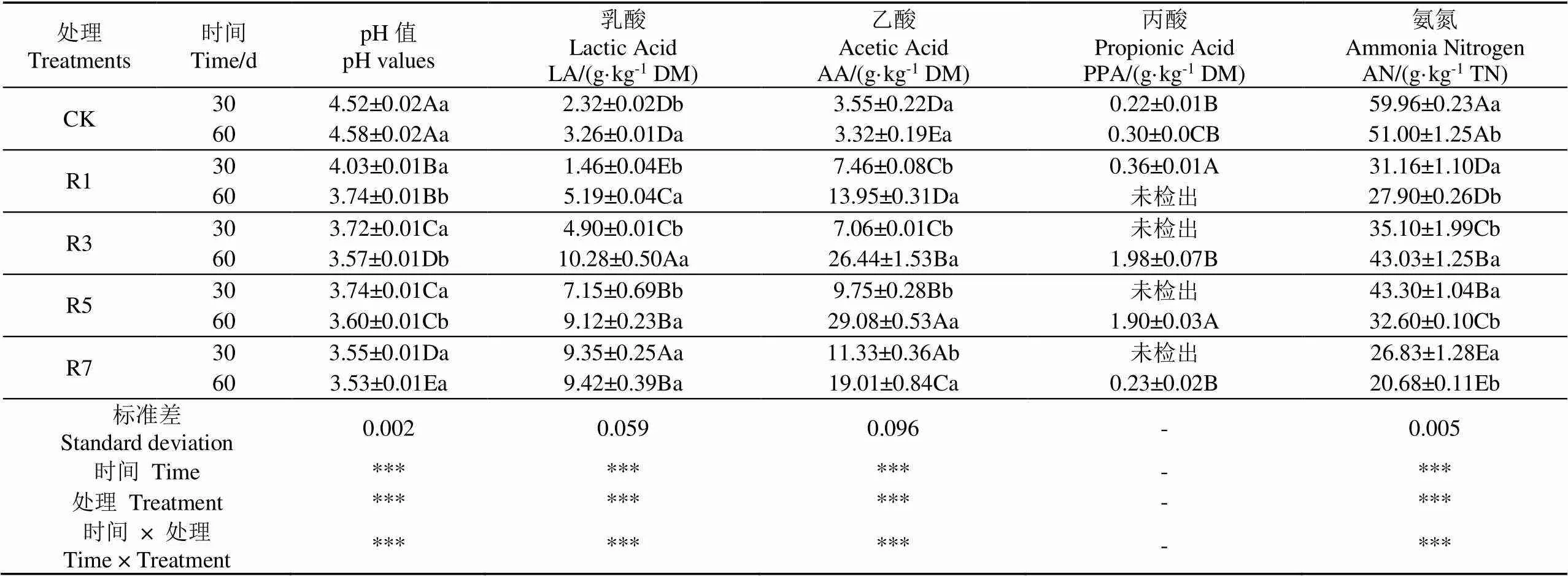
表4 不同处理时添加瘤胃液对青贮发酵品质的动态影响
乳酸和乙酸是青贮发酵过程中微生物菌群产生的重要有机酸,二者含量均随时间延长而显著增加,这与pH值变化趋势相一致。同时,4个添加剂处理组的乳酸、乙酸含量均显著高于CK组,且均随瘤胃液添加量的提高而显著增加,青贮发酵60 d时,乳酸和乙酸含量高达9.42 g/kg DM(R7)和 29.08 g/kg DM(R5),这是因为反刍动物瘤胃液中含有丰富的细菌、真菌、原虫等微生物菌系,能有效分解木质纤维组分和淀粉并将其转化为可发酵糖,从而和原料本身所含的可发酵糖一起供有益乳酸菌群发酵代谢,产生更多的乳酸[16]。乙酸含量的增加主要归因于瘤胃液自身所含的泛菌、乙酸杆菌和葡糖杆菌等产乙酸菌群。此外,个别试验组检测出微量丙酸,而丁酸未检出,说明整体青贮品质良好。
氨氮含量是评价蛋白质分解的重要指标,氨氮含量越高说明蛋白质分解越严重,优质青贮一般不超50 g/kg TN[25]。由表4可知,青贮发酵期间,4个添加剂处理组的氨氮值都远低于50 g/kg TN,且均显著低于CK组,这得益于较低pH值的酸性青贮环境和高含量的乙酸等抗真菌物质。
总体而言,添加瘤胃液能显著降低青贮甜高粱的pH值和氨氮含量,增加乳酸和乙酸含量,进而提高发酵品质。
2.3 青贮过程中的细菌多样性分析
2.3.1 Alpha多样性指数
Alpha多样性即为物种多样性,Chao1和ACE指数反映了微生物群落物种种类的丰富度;Shannon和Simpson指数反映了细菌群落多样性[26]。如表5所示,4个添加剂处理组的Chao1、ACE和Shannon指数均明显高于原料和CK组,Simpson指数显著低于原料,说明添加瘤胃液使青贮甜高粱体系中的微生物菌群与原料相比更丰富且多样化。此外,随着青贮时间的延长,4个添加剂处理组的Shannon指数显著降低,Simpson指数显著增加,说明细菌群落多样性随青贮时间延长而下降,因为发酵过程中乳酸菌逐渐演变为青贮体系中的优势菌群,青贮60 d时的乳酸菌群丰度介于45%~81%范围,也印证了这一点。可见,添加瘤胃液有助于强化青贮发酵体系中细菌群落丰富度和多样性。
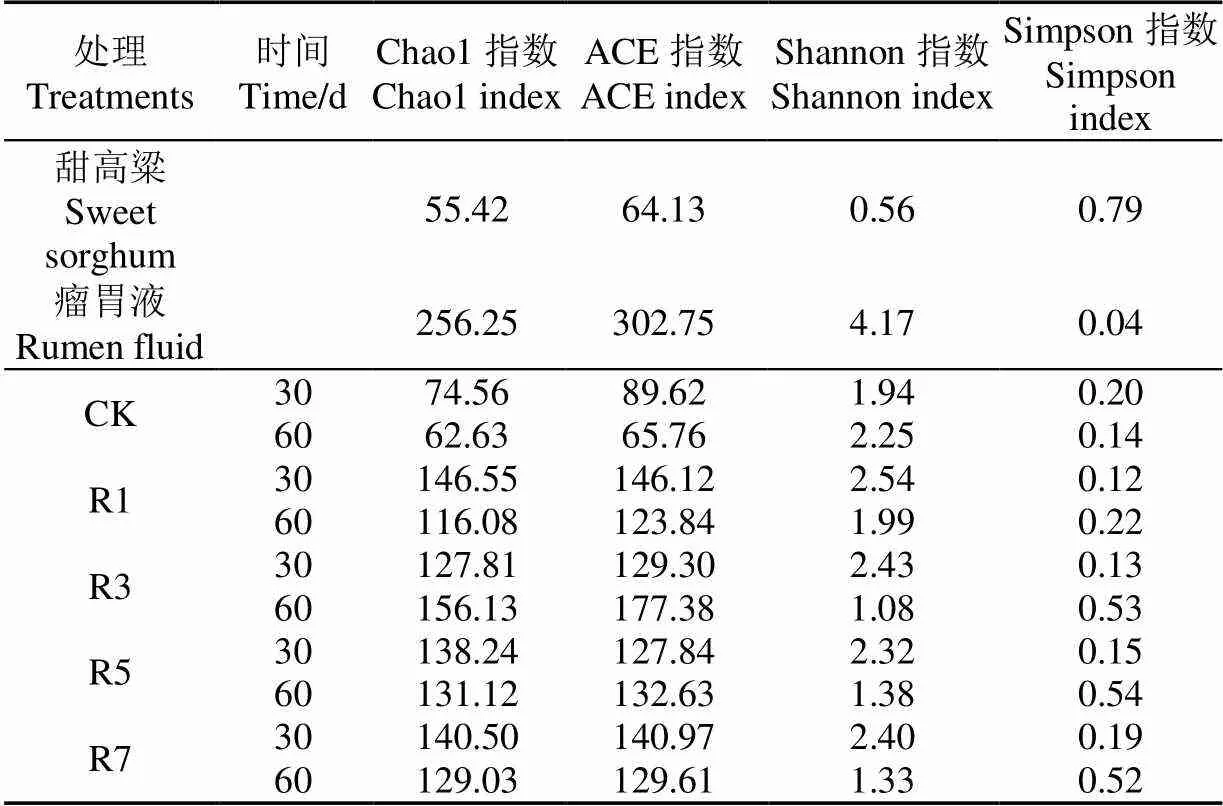
表5 不同瘤胃液添加量时的Alpha多样性
2.3.2 门分类水平细菌群落组成
由图3可知,原料甜高粱表面附着的门水平优势细菌主要为变形菌(Proteobacteria,93.49%),还含有少量放线菌(Actinobacteria,4.46%)和厚壁菌(Firmicutes,2.00%)。青贮发酵后细菌群落发生了不同的演变趋势,其中CK组仍以变形菌门为主,相对丰度在30 d和60 d时分别达到96.1%和81.2%,而4个瘤胃液强化青贮处理组则演绎形成了变形菌和厚壁菌共存的微生态结构。而且,随着青贮时间的延长和瘤胃液添加量的增加,厚壁菌门相对丰度逐渐增加,变形菌门相对丰度逐渐下降,尤其在60 d时R7组中的厚壁菌门相对丰度高达84.84%,这可能是因为优势乳酸菌群隶属于厚壁菌门所致。同时,瘤胃液自身也含有较为丰富的厚壁菌(相对丰度61.12%),两方面因素共同作用使厚壁菌们变得更加丰富[27]。再者,有研究发现,青贮发酵过程和低pH环境也有助于促进厚壁菌生长,抑制变形菌繁殖[28]。另外,整个青贮发酵期间,4个添加剂组的厚壁菌门相对丰度均显著高于CK组,说明添加瘤胃液对青贮发酵的微生物群落结构有很大影响,这与Zhao等[29]研究结果一致。
2.3.3 属分类水平细菌群落组成
如图4所示,甜高粱原料表面附着的属水平优势菌群主要为泛菌(,35.78%)和假单孢杆菌(,13.27%),此外还含有少量鞘氨醇单孢菌(,8.46%)、微杆菌(,4.34%)和不动杆菌(,2.36%)等。经青贮发酵后,5个试验组的属水平细菌种群明显增多,其中CK组含有较为丰度的泛菌(41.75%)、葡糖杆菌(,30.54%)和肠杆菌(,15.61%)等微生物类群。4个瘤胃液强化青贮组的优势菌群演变为乳酸杆菌()、泛菌和醋酸杆菌(),同时还包括少量瘤胃球菌()、肠杆菌()、沙雷氏菌()等28个属。
另一方面,青贮发酵30 d时,随着瘤胃液添加量的增加,乳酸菌和醋酸杆菌的富集量分别为18.2%~46.2%和3.61%~18.0%。而随着青贮时间的延长,5个试验组中的泛菌、醋酸杆菌相对丰度均显著降低,而乳酸杆菌的相对丰度则显著增加,尤其青贮发酵60 d时乳酸杆菌的相对丰度随瘤胃液添加量急剧增加,由45.2%(R1)增加到81.1%(R7),Gallagher等[30]研究结果也有类似发现。同时,4个添加剂处理组的乳酸杆菌和瘤胃球菌的相对丰度均显著高于CK组,且随着瘤胃液添加量的提高而显著增加;而肠杆菌、泛菌、沙雷氏菌和志贺氏菌等不良微生物菌群的相对丰度明显低于CK组,说明添加瘤胃液不仅能促进有益乳酸菌群的发酵并为其提供良好生长环境,而且还有助于抑制不良微生物。
2.4 酶解糖化分析
酶解糖化是评价生物降解性能的常用方法[6]。如图5所示,甜高粱原料和青贮甜高粱的还原糖得率均随着酶解时间延长而显著增加,青贮发酵30 d时,各处理组的还原糖产量分别比甜高粱原料提高26% (CK)、30% (R1)、34% (R3)、40% (R5)和44% (R7),且青贮处理组的还原糖得率均明显高于对照组。这可能是因为青贮能改变木质纤维生物质的微观结构与宏观组成,并打破纤维素-半纤维素-木质素的网络结构,增加纤维素和半纤维素对水解酶的可及面,从而释放出较多的可发酵单糖[6]。
另一方面,与对照CK组相比,由于瘤胃液中瘤胃球菌、普氏杆菌等纤维素降解菌及其分泌酶对顽固的木质纤维生物质具有较高的降解能力,能有效分解木质纤维组分和淀粉并将其转化为可发酵糖,因此4个瘤胃液处理组在72 h时的还原糖得率显著提高[31]。无论青贮发酵时间为30或60 d,R7组的还原糖得率均达到最大值,分别为730.3 mg/g DM和795.4 mg/g DM,分别比对照组增加了11%和19%;同时也优于Zhao等[32]和Botella等[33]分别采用蒸汽爆破和可逆酸预处理甜高粱的酶解糖化结果。孟尧等[34]也认为瘤胃液添加量越高,玉米秸秆的水解率越高。可见,瘤胃液强化青贮能显著提高甜高粱的还原糖得率,且与瘤胃液添加量呈正相关;这与理论计算得出的生物降解潜力变化趋势也基本一致(图6)。因此,较高的瘤胃液添加量有助于释放青贮甜高粱中的可发酵糖分,在青贮发酵过程中起到明显的生物强化预处理作用。
3 结 论
1)添加瘤胃液显著降低了青贮甜高粱中的木质纤维组分含量,增加了乳酸菌等有益微生物的相对丰度,改善了乳酸和乙酸等发酵强度,乳酸和乙酸含量在青贮发酵60 d时高达9.42 g/kg DM(R7)和29.08 g/kg DM(R5),从而降低青贮体系pH值(低于4.0)和氨氮含量(低于50 g/kg TN),获得高质量青贮品质。
2)较高剂量的瘤胃液生物强化作用和长时间青贮发酵,有助于破坏甜高粱茎秆的木质纤维抗降解屏障结构,减少木质素组分,释放更多综纤维素,获得较高的酶解糖化得率,青贮发酵30 d和60 d时,R7组的还原糖得率分别高达730.3 mg/g DM和795.4 mg/g DM。
甜高粱青贮过程中加入瘤胃液进行生物强化,使其青贮质量和降解性能均得到了显著改善,是实现甜高粱保质贮存和转化利用的一种有效方式。结合生产实际,本文推荐瘤胃液添加量为100 g新鲜全株甜高粱原料中加入7 mL瘤胃液。下一步,课题组还将继续从瘤胃液中分离一系列降解性能较高的微生物菌系进行有针对性地靶向研究,进而开发出作用明显、适用性更强的生物强化青贮用微生物菌剂。
[1]陈朝儒,王智,马强,等. 甜高粱茎汁及茎渣同步糖化发酵工艺优化[J]. 农业工程学报,2016,32(3):253-258.
Chen Chaoru, Wang Zhi, Ma Qiang, et al. Optimization of ethanol production from bagasse and juice of sweet sorghum stem by simultaneous saccharification and fermentation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(3): 253-258. (in Chinese with English abstract)
[2]梅晓岩,刘荣厚,曹卫星. 植物生长调节剂对甜高粱茎秆贮藏中糖分变化的影响[J]. 农业工程学报,2012,28(15):179-184.
Mei Xiaoyan, Liu Ronghou, Cao Weixing. Effects of pretreatment of sweet sorghum stalk with plant growth regulator on its sugar content during storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(15): 179-184. (in Chinese with English abstract)
[3]Głąb L, Sowiński J, Chmielewska J, et al. Comparison of the energy efficiency of methane and ethanol production from sweet sorghum (Sorghum bicolor (L.) Moench) with a variety of feedstock management technologies[J]. Biomass and Bioenergy, 2019, 129: 105332.
[4]Zhao J, Dong Z H, Li J F, et al. Ensiling as pretreatment of rice straw: The effect of hemicellulase andplantarum on hemicellulose degradation and cellulose conversion[J]. Bioresource Technology, 2018, 266: 158-165.
[5]Nkosi B D, Vadlani P V, Brijwani K, et al. Effects of bacterial inoculants and an enzyme on the fermentation quality and aerobic stability of ensiled whole-crop sweet sorghum[J]. South African Journal of Animal Science, 2012, 42(3): 232-240.
[6]Li F H, Ding Z T, Ke W C, et al. Ferulic acid esterase-producing lactic acid bacteria and cellulase pretreatments of corn stalk silage at two different temperatures: Ensiling characteristics, carbohydrates composition and enzymatic saccharification[J]. Bioresource Technology, 2019, 282: 211-221.
[7]Zhang F, Wang X, Lu W, et al. Improved quality of corn silage when combining cellulose-decomposing bacteria andbuchneri during silage fermentation[J]. BioMed Research International, 2019,4361358.
[8]刘晶晶,高丽娟,师建芳,等. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果[J]. 农业工程学报,2015,31(9):295-302.
Liu Jingjing, Gao Lijuan, Shi Jianfang, et al. Lactic acid bacteria community andimproving silaging effect of switchgrass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(9): 295-302. (in Chinese with English abstract)
[9]Yue Z B, Li W W, Yu H Q. Application of rumen microorganisms for anaerobic bioconversion of lignocellulosic biomass[J]. Bioresource Technology, 2013, 128: 738-744.
[10]Zhang H, Zhang P, Ye J, et al. Improvement of methane production from rice straw with rumen fluid pretreatment: A feasibility study[J]. International Biodeterioration & Biodegradation, 2016, 113: 9-16.
[11]Wang D, Zhao C, Liu S M, et al.Effects ofsp. CN6 CGMCC 14449 on fermentation quality, nutrient composition and the in vitro degradation rate of whole crop maize silage[J]. AMB Express, 2019, 9(1): 121-129.
[12]孟尧. 玉米秸秆厌氧发酵瘤胃仿生工艺研究[D]. 北京:清华大学,2016.
Meng Yao. Study on Bionic Technology of Maize Straw Anaerobic Fermentation Rumen[D]. Beijing: Tsinghua University, 2016. (in Chinese with English abstract)
[13]任海伟,王莉,朱朝华,等. 白酒糟与菊芋渣混合青贮发酵品质及微生物菌群多样性[J]. 农业工程学报,2020,36(15):235-244.
Ren Haiwei, Wang Li, Zhu Zhaohua, et al. Ensiling co-fermentation quality and microbial community diversity of grain stiller and inulin processing residue from[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(15): 235-244. (in Chinese with English abstract)
[14]Wang W Z, Zhang L, Xu T F, et al. Improving lignocellulose enzymatic saccharification in a bioreactor with an applied electric field[J]. Industrial Crops & Products, 2017, 109: 404-409.
[15]Borreani G, Tabacco E, Schmidt R J, et al. Silage review: Factors affecting dry matter and quality losses in silages[J]. Journal of Dairy Science, 2018, 101(5): 3952-3979.
[16]周斐然. 甜高粱青贮有氧稳定性、瘤胃降解率及其对瘤胃菌群影响的研究[D]. 阿拉尔:塔里木大学,2017.
Zhou Feiran. Effects of Sweet Sorghum Silage on Sumen Degradation, Aerobic Stability and Ruman Flora[D]. Alar: Tarim University, 2017. (in Chinese with English abstract)
[17]张旭,郭盼盼,金锡九,等. 不同温度条件下发酵时间对完全混合发酵日粮(TMF)发酵品质的影响[J]. 中国畜牧兽医,2018,45(3):673-681.
Zang Xu, Guo Panpan, Jin Xijiu, et al. Effects of fermentation time on fermentation quality of the Total Mixed Fermentation Ration (TMF) at different fermentation temperature[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(3): 673-681. (in Chinese with English abstract)
[18]买尔哈巴·艾合买提. 瘤胃中纤维素分解菌的分离、鉴定及其在青贮饲料中的应用研究[D]. 乌鲁木齐:新疆大学,2013.
Marhaba·Ahmet. Study on Isolation and Identification of Cellulose-degrading Bacteria from Rumen and Its Application on Silage[D]. Urumchi: Xinjiang University, 2013. (in Chinese with English abstract)
[19]李荞荞,王曙阳,董妙音,等. 甜高粱青贮饲料中乳酸菌最佳添加剂量的探讨[J]. 中国酿造,2019,38(3):160-165.
Li Qiaoqiao, Wang Shuyang, Dong Miaoyin, et al. Discussion on the optimum addition of lactic acid bacteria in sweet sorghum silage[J]. China Brewing, 2019, 38(3): 160-165. (in Chinese with English abstract)
[20]吴建民,王雍,周协琛,等. 基于宏基因组学解析瘤胃微生物调节荷斯坦奶牛乳蛋白含量的研究[J]. 动物营养学报,2020,32(8):3843-3855.
Wu Jianmin, Wang Yong, Zhou Xiechen, et al. Rumen microorganism regulating milk protein content in holstein dairy cows based on metagenomic analysis[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3843-3855. (in Chinese with English abstract)
[21]Li F, Zhang P Y, Zhang G M, et al. Enhancement of corn stover hydrolysis with rumen fluid pretreatment at different solid contents: Effect, structural changes and enzymes participation[J]. International Biodeterioration & Biodegradation, 2017, 119: 405-412.
[22]Baba Y, Matskuti Y, Mori Y, et al. Pretreatment of lignocellulosic biomass by cattle rumen fluid for methane production: Bacterial flora and enzyme activity analysis[J]. Journal of Bioscience and Bioengineering, 2017, 123(4): 489-496.
[23]Chen L, Dong Z H, Li J F, et al. Ensiling characteristics, in vitro rumen fermentation and microbial communities and aerobic stability of low-dry matter silages produced with sweet sorghum and alfalfa mixtures[J]. Journal of the Science of Food and Agriculture, 2019, 99(5): 2140-2151.
[24]Xing L, Chen L J, Han L J, et al. The effect of an inoculant and enzymes on fermentation and nutritive value of sorghum straw silages[J]. Bioresource Technology, 2009, 100(1): 488-491.
[25]He L W, Chen W, Wang C, et al. Improving fermentation, protein preservation and antioxidant activity of moringa oleifera leaves silage with gallic acid and tannin acid[J]. Bioresource Technology, 2020, 297: 122390.
[26]王旭辉,徐鑫,宝哲,等. 高通量测序分析新疆沼液中发酵微生物的多样性[J]. 农业工程学报,2019,35(5):219-225.
Wang Xuhui, Xu Xin, Bao Zhe, et al. Analysis of fermentation microbial diversity in biogas slurry by using high-throughput sequencing in Xinjiang, China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(5): 219-225. (in English with Chinese abstract)
[27]朱见深,胡明,齐静,等. 基于高通量测序分析青贮玉米微生物多样性[J]. 山东农业科学,2020,52(4):68-72.
Zhu Jianshen, Hu Ming, Qi Jing, et al. Analysis of microbial diversity of maize silage by high-throughput sequencing[J]. Shandong Agricultural Sciences, 2020, 52(4): 68-72. (in Chinese with English abstract)
[28]Liu B, Huan H, Gu H, et al. Dynamics of a microbial community during ensiling and upon aerobic exposure in lactic acid bacteria inoculation-treated and untreated barley silages[J]. Bioresource Technology, 2019, 273: 212-219.
[29]Zhao Y, Yu J, Liu J, et al. Material and microbial changes during corn stalk silage and their effects on methane fermentation[J]. Bioresource Technology, 2016, 222: 89-99.
[30]Gallagher D, Parker D, Allen D J, et al. Dynamic bacterial and fungal microbiomes during sweet sorghum ensiling impact bioethanol production[J]. Bioresource Technology, 2018, 264: 163-173.
[31]苏良湖,陈梅,孙旭,等. 谷类秸秆接种瘤胃液的厌氧消化性能和三维荧光光谱特征[J]. 生态与农村环境学报,2018,34(11):1034-1041.
Su Lianghu, Chen Mei, Sun Xu, et al. The anaerobic digestion performance of cereal straw inoculated with rumen fluid and its three-dimensional excitation emission matrix fluorescence spectroscopic characteristics[J]. Journal of Ecology and Rural Environment, 2018,34(11): 1034-1041. (in Chinese with English abstract)
[32]Zhao G Z, Kuang G, Wang Y, et al. Effect of steam explosion on physicochemical properties and fermentation characteristics of sorghum (Sorghum bicolor (L.) Moench)[J]. Food Science and Technology, 2020, 292: 121975.
[33]Botella C, Zhang K, Baugh A, et al. Reversible acid pretreatment scale up studies for the production of cellulosic ethanol from ensiled sweet sorghum[J]. Biochemical Engineering Journal, 2019, 150: 107266.
[34]孟尧,魏志谋,郑明霞,等. 瘤胃液用于玉米秸秆产酸的影响因素[J]. 环境工程学报,2017,11(1):497-502.
Meng Yao, Wei Zhimou, Zheng Mingxia, et al. Influencing factor of VFA production with corn straw inoculated with rumen fluid[J]. Chinese Journal of Environmental Engineering, 2017, 11(1): 497-502. (in Chinese with English abstract)
Effects of rumen fluid addition on the ensiling quality of whole-plant sweet sorghum
Ren Haiwei1,2,3, Lu Nana1, Lu Lirong1, Sun Wenli1, Wang Zhiye2, Li Jinping1,3,4, Li Zhizhong1※
(1./730050; 2.730000; 3.730050; 4.730050)
Sweet sorghum is a variety of promising energy crops with high sugar content, rapid growth rate, and strong resistance to saline-alkaline soils. Appropriate storage is highly required to utilize this feedstock for continuous bioenergy production, particularly harvested in a seasonal manner in China. In this study, the addition of rumen fluid was introduced to sweet sorghum for better ensiling quality during long-term (30 to 60 days) storage. A systematic investigation was made on the ensiling profile, including the organic components, fermentation quality, and enzymatic hydrolysis of sweet sorghum silage. Furthermore, an experimental analysis was performed on the dynamic process of microbial community during ensiling. The sweet sorghum was ensiled at 5 different dosages of rumen fluid: CK, silage without the addition of additive; R1, silage with rumen fluid at 1 mL/100 g, R3 at 3 mL/100 g, R5, 5 mL/100 g, R7 at 7 mL/100 g substrate. The results showed that the contents of dry matter (DM), water-soluble carbohydrates (WSC), crude protein (CP), and ammonia nitrogen (AN) decreased significantly, as both ensiling time and dosage increased in four treatments with the addition of rumen fluid, compared with the CK silages without rumen fluid. The increased rumen fluid and prolonged ensiling contributed to reducing the content of acid detergent fiber (ADF), neutral detergent fiber (NDF), cellulose, and hemicellulose, while elevating the abundance of beneficialin silages. Lignin in silages at ensiled for 60 days was effectively removed when the maximum dosage of rumen fluid was up to 7 g/100 g. There was a significant decrease in the contents of lactic acid and acetic acid, as well as the pH values in five treatments (CK, R1, R3, R5, R7), with the extension of the ensiling period (<0.05). The contents of lactic acid and acetic acid in R7 and R5 were higher than those of treatments after 60 days, which were 9.42 g/kg (R7) and 29.08 g/kg (R5), respectively. The dominant phylum in CK silages was stillafter ensiling, where the relative abundance was up to 96.1% and 81.2% after 30 and 60 days, respectively. However, the bacterial communities changed significantly, due to the fact the bioaugmentation of rumen fluid resulted in the coexistence ofandin bioaugmented silages. After bioaugmented ensiling for 30 days,andbecame enriched in the range of 18.2-46.2% and 3.61-18.0%, respectively, as the dosage of rumen fluid increased. After 60 days of ensiling, the relative abundance ofincreased from 45.2 (R1) to 81.1% (R7) with the increase of rumen fluid dosage. The addition of rumen fluid also enhanced the reducing sugar yield during enzymatic saccharification for 72 h. Specifically, the yields of reducing sugars in all treatments at 30 days significantly increased by 26% (CK), 30% (R1), 34% (R3), 40% (R5), and 44% (R7), respectively, compared with the raw sweet sorghum. The bioaugmented ensiling improved substantially the yield of reducing sugars, compared with the CK silages, indicating a positive correlation to the dosage of rumen fluid. It was also found that the 72 h reducing sugars yields of all silages at 60 days were significantly higher than those at 30 days. The R7 silage achieved the highest reducing sugars yield of 795.4 mg/g after 60 days of silage, indicating a linear correlation to the high biodegradation potential. The addition of rumen fluid can effectively improve the ensiling quality and biodegradability of ensiled sweet sorghum, thereby serving as biological pretreatment via bioaugmentation. This finding can provide the promising ethanol utilization of sweet sorghum.
sweet sorghum; ensiling quality; rumen fluid; microbial community; enzymatic saccharification
10.11975/j.issn.1002-6819.2021.05.025
TS209
A
1002-6819(2021)-05-0216-08
任海伟,卢娜娜,路力榕,等. 瘤胃液对全株甜高粱青贮质量的影响[J]. 农业工程学报,2021,37(5):216-223.doi:10.11975/j.issn.1002-6819.2021.05.025 http://www.tcsae.org
Ren Haiwei, Lu Nana, Lu Lirong, et al. Effects of rumen fluid addition on the ensiling quality of whole-plant sweet sorghum[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(5): 216-223. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.05.025 http://www.tcsae.org
2020-11-23
2021-02-15
国家自然科学基金项目(51666010);中国博士后科学基金面上项目(2018M631217);兰州理工大学红柳杰出青年人才支持计划(JQ2020)和一流学科计划(0807J1)
任海伟,博士,教授,研究方向为生物质资源转化利用。Email:rhw52571119@163.com。中国农业工程学会高级会员(E041200735S)
李志忠,教授,研究方向为可再生能源与环境工程。Email:zzli@lut.cn
中国农业工程学会会员:李志忠(E042700009M)

