多囊卵巢综合征患者胰岛素抵抗情况及影响因素分析
邵莉莉,栗夏莲
(郑州大学第一附属医院 全科医学科,河南 郑州 450052)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是生活中常见的育龄期女性生殖内分泌紊乱疾病,临床表现主要包括月经不规律、不孕、多毛、痤疮等。PCOS患者糖代谢异常发生率较高,最重要的内分泌代谢改变是胰岛素抵抗(insulin resistance,IR),更有人提出把PCOS更名为卵巢胰岛素抵抗综合征。研究表明,PCOS患者中50%~70%存在IR[1],在PCOS的发病机制中IR和高胰岛素血症占据着中心环节[2]。本研究分析PCOS患者伴或不伴IR的一般资料、性激素水平、甲状腺激素水平、糖脂代谢指标差异,分析稳态模型胰岛素抵抗指数(homeostasis model assessment insulin resistance index,HOMA-IR)与各观察指标的相关性,探讨PCOS患者发生IR的影响因素,为临床治疗提供依据。
1 资料与方法
1.1 一般资料参照2003年鹿特丹诊断标准[3],收集2015年5月至2019年5月在郑州大学第一附属医院住院的250例PCOS患者的资料。排除标准:(1)雄激素分泌增多的疾病,如雄激素肿瘤、先天性肾上腺皮质增生症、库欣综合征等,高泌乳素血症,糖尿病等内分泌系统疾病及冠心病、高血压、恶性肿瘤、肝肾功能不全等重要器官器质性病变;(2)既往有甲状腺疾病、甲状腺功能异常病史;(3)既往3个月内应用激素类药、降糖降脂药等。根据HOMA-IR判断是否存在IR,分为IR组和非IR组,IR组的年龄为18~41岁,平均(25.72±4.78)岁,非IR组的年龄为18~37岁,平均(26.80±4.06)岁。两组一般资料比较,差异无统计学意义(P>0.05)。患者均签署知情同意书,且本研究获得郑州大学第一附属医院伦理委员会审核批准。
1.2 研究方法记录所有患者年龄、身高、体质量,隔夜空腹8 h以上,次日晨抽肘静脉血。检测卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)、睾酮(testosterone,T)、催乳素(prolactin,PRL)水平,所用方法为电化学发光法,所需试剂购自美国罗氏公司。测定血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)水平,所用方法为化学发光法,仪器为美国Unicel DxI 800化学发光仪。测定总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,所用方法为酶法,仪器为德国罗氏全自动生化分析仪。所有患者均接受口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)、胰岛素释放试验,采用罗氏微量血糖仪测指尖血糖,采用化学发光法(美国Abbott)测定胰岛素水平。计算体质量指数(body mass index,BMI)。计算LH/FSH比值。采用HOMA-IR评估患者的IR程度,根据全国糖尿病专家共识,若HOMA-IR≥2.69,则判定为IR。

2 结果
2.1 性激素和甲状腺激素水平IR组BMI、LH、LH/FSH、TSH高于非IR组,FSH低于非IR组(P<0.05);两组PRL、E2、T、FT3、FT4比较,差异无统计学意义(P>0.05)。见表1。

表1 两组一般资料、性激素及甲状腺激素指标比较
2.2 糖脂代谢指标IR组FPG、FINS、HOMA-IR、TG高于非IR组,HDL-C低于非IR组(P<0.05);两组TC、LDL-C比较,差异无统计学意义(P>0.05)。见表2。

表2 两组糖脂代谢指标比较
2.3 HOMA-IR与其他指标的相关性分析HOMA-IR与BMI、LH、LH/FSH、TSH、TG呈正相关(r=0.465、0.149、0.259、0.134、0.176,P<0.05),与FSH、HDL-C呈负相关(r=-0.230、-0.337,P<0.05)。见表3。

表3 HOMA-IR与各激素指标及糖脂代谢指标的相关性分析(r)
2.4 多因素logistic回归分析因变量为HOMA-IR(≥2.69为1,<2.69为0),将两组比较差异有统计学意义的指标作为自变量:BMI、FSH、LH、LH/FSH、TSH、TG、HDL-C,变量的进入方式选择逐步向前法。结果显示,校正FSH、LH、TG、HDL-C等因素的影响后,BMI(OR=1.236,95% CI:1.131~1.351,P<0.05)、LH/FSH(OR=1.764,95% CI:1.031~3.018,P<0.05)、TSH(OR=1.376,95% CI:1.009~1.877,P<0.05)是PCOS患者发生IR的独立危险因素。见表4。
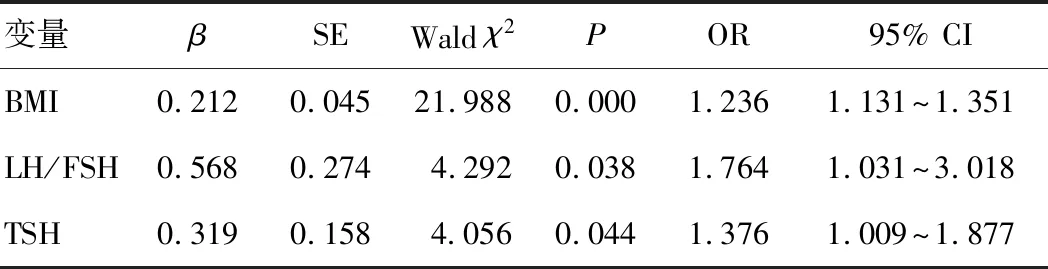
表4 PCOS患者发生IR的多因素logistic回归分析
3 讨论
PCOS是常见的女性性腺轴功能紊乱性疾病,除月经紊乱、不孕等生殖系统异常外,可有多系统表现(多毛症、痤疮、心血管疾病、阻塞性呼吸睡眠暂停综合征、乳腺癌和子宫内膜癌等),严重危害育龄期妇女的身心健康。根据流行病学统计,PCOS发病率逐年增长。PCOS病因不明,研究表明,IR在PCOS的发生、发展过程中有关键的作用和地位。伴IR的PCOS患者发生代谢综合征、2型糖尿病、心血管疾病的风险增加[4]。
目前公认评价IR的金标准是高胰岛素-正葡萄糖钳夹试验,但操作不便,应用较少。本研究通过HOMA-IR值的高低评价IR程度。研究表明,育龄期PCOS患者IR的发病率高达50%[1]。本研究结果显示,PCOS患者中有60%(150/250)伴IR,与上述研究结果一致。IR组FPG、FINS、HOMA-IR高于非IR组,可能是由于代偿机制,IR组患者胰岛素分泌过多,但胰岛素的增多并没有导致葡萄糖摄取和转化能力的提高。众多研究表明,IR与PCOS患者性激素紊乱密切相关,这可能是由于胰岛素抑制性激素结合球蛋白的分泌,增加细胞色素P45017α-羟化酶的活性,从而促进卵巢分泌过多雄激素[5]。雄激素转化为雌酮,过多的雌酮及E2可正反馈增加LH的分泌,负反馈减少FSH的分泌,并且PCOS患者体内过多的抑制素也会减少FSH分泌[6],最终导致严重的性激素紊乱。本研究结果显示,IR组LH、LH/FSH高于非IR组,FSH低于非IR组,两组差异有统计学意义。虽IR组T、E2水平升高,但两组差异无统计学意义,相关分析进一步显示T、E2与HOMA-IR相关性不明显,提示IR可能不是导致PCOS患者雌雄激素紊乱的主要因素。
肥胖是PCOS患者主要的临床表现之一,在肥胖PCOS患者中IR的发病率较高,约为75%[7]。本研究得出结论,存在IR的PCOS患者BMI明显增高,相关性分析显示,BMI与HOMA-IR呈正相关。这提示肥胖患者葡萄糖的摄取和利用减少,发生IR的风险增加。多因素回归分析也得出BMI是PCOS患者发生IR的独立危险因素的结论,与既往研究结果[8]一致。有研究分析发现,PCOS患者的IR与血脂异常发生率密切相关,IR组TG升高,HDL降低,这种差异随HOMA-IR值的增大而愈加明显[9]。在本研究中,与非IR组相比,IR组TG升高,HDL-C降低,提示伴IR的PCOS患者更容易发生脂代谢异常,与上述研究结果[9]一致。其可能机制为,胰岛素可以促进肝脏分泌极低密度脂蛋白,降低HDL的水平,加速胆固醇从HDL向极低密度脂蛋白的转化,同时降低脂肪限速酶的活性,抑制脂肪分解,从而导致TG合成增加[10]。
有文献报道称,PCOS患者的IR程度与TSH水平之间存在显著相关性[11-12]。Mueller等[13]研究得出结论,TSH独立于年龄、BMI与IR显著相关。在另一项类似研究中,TSH≥2.5 mIU·L-1的患者的空腹胰岛素水平及IR指数更高[14]。本研究可以观察到,伴IR的PCOS患者其TSH水平升高,且TSH是PCOS伴IR的独立危险因素,与既往研究结果[13]一致。其可能机制为,TSH与脂肪细胞的TSH受体结合,激活cAMP依赖的蛋白激酶,最终诱导脂肪细胞的增殖、分化,脂肪细胞增多导致肥胖,异常脂肪沉积在IR的发展中起着至关重要的作用[15-16]。因此,脂肪细胞可能是联系TSH和IR的关键因素之一。上述研究提示,可能正常参考范围的TSH水平升高,PCOS患者血糖及胰岛素代谢紊乱更加严重,应引起重视,这对于PCOS发病机制的研究,可能提供了新的思路。
综上所述,IR是PCOS内分泌代谢异常的重要环节,伴IR的PCOS患者存在更严重的性激素紊乱、糖脂代谢异常。BMI、LH/FSH、TSH是PCOS伴IR的独立危险因素,所以,积极治疗原发病、控制体质量、监测和适当干预甲状腺激素水平有利于改善PCOS患者的IR程度,预防相关并发症的发生,这对临床治疗有一定的指导意义。本研究尚需进一步大样本证实IR对PCOS的影响,探索相应干预手段,为PCOS治疗提供依据。

