脑啡肽原(PENK-A)评估急性缺血性脑卒中严重程度 及预后的研究
郑文雪
(苏州大学附属第一医院,江苏 苏州 215000)
0 引言
脑啡肽,是中枢神经系统中的类吗啡性神经递质,与阿片受体结合,具有镇痛,免疫调节,调节细胞增殖等作用[1]。他们参与了多种神经系统疾病的病理生理过程,如帕金森病,阿尔茨海默病和严重的头部损伤[2]。曾有研究表明急性脑梗死患者血浆甲硫氨酸脑啡肽水平升高[3]。因为阿片受体激活在脑梗死中有无神经保护作用都曾被报道过,所以脑啡肽在急性脑梗死中的作用尚不清楚[4,5]。脑啡肽原,以前称为脑啡肽原A(因为脑啡肽原B更名为为强啡肽原),是内源性阿片类多肽激素脑啡肽的前体,通过蛋白水解切割可以生成活性脑啡肽和蛋白水解片段。缺血性脑卒中是神经内科常见的一种疾病,占脑血管疾病的70%~80%,其致残率及致死率均较高,严重威胁国民的身心健康和生活质量。早期识别急诊卒中单元中高危险性的患者在临床评估与决策中有重要意义,然而,与急性心肌梗死相比,目前缺少评估急性脑梗死严重程度及预后的有效标志物[6-8]。既往所研究的关于急性脑梗死的标志物可分为两类,一类是梗死面积相关的标志物(例如,星形胶质细胞蛋白S-100B),另一类是血脑屏障损伤相关的标志物(例如c-Fn,基质金属蛋白酶9(MMP9))[9]。最近研究发现PENK-A119-159片段是血脑屏障完整性的有效标志物[10],患者血浆中PENK-A 119-159片段含量与卒中严重程度,梗死面积大小,预后相关[11]。
1975年,Hans Kosterlitz等人报道了一种可以与吗啡受体相互作用的内源性吗啡样物质,后来,他们提纯了这种物质并命名为脑啡肽[12]。脑啡肽是一种五肽神经肽,由8号染色体上的PENK基因编码的脑啡肽参与人体的各种生理过程[13]。在人体中,阿片受体主要有mu(MOR),delta(DOR),kappa(KOR)三种,受体合成主要发生在背根神经节,并且通过轴突运输到中枢及外周神经,其中与脑啡肽亲和力最高的受体是DOR[14]。研究表明,中枢神经系统中,DOR在大脑皮层,壳核,伏隔核,尾状核,颞叶,海马中高度表达,这种分布与DOR在运动和认知当中的功能相关;在外周,DOR主要分布在肾上腺髓质,心脏,胰腺,小肠,肺,肾,胸腺,许多的免疫细胞如淋巴细胞,巨噬细胞中[15]。
前脑啡肽原A由267个氨基酸组成[16,17],通过特异性信号肽酶去除N末端信号序列产生脑啡肽原A(PENK-A)前体蛋白(243aa)[18],其在成对碱性氨基酸残基处进一步切割后产生活性脑啡肽[19],即四个拷贝的甲硫氨酸脑啡肽,一个拷贝的亮氨酸脑啡肽,一个拷贝的甲硫氨酸脑啡肽-精氨酸甘氨酸亮氨酸,一个拷贝的甲硫氨酸脑啡肽-精氨酸苯丙氨酸和一个拷贝的enkelytin[20,21]。
甲硫氨酸脑啡肽和亮氨酸脑啡肽在体外是不稳定的,在人血浆中的半衰期不到15分钟[22]。而PENK-A 119-159具有抗降解作用,在体外室温下有超过48小时的稳定性,更适合进行实验室和临床研究,被认为是不稳定脑啡肽的稳定替代指标[10,23]。尽管脑啡肽在人体中有很多功能,PENK-A 119-159作为前体PENK-A的连接肽在血液循环中可能是没有功能的,目前没有证据表明它在血液循环中与蛋白质结合[23]。研究表明,脑脊液(CSF)中的PENK-A 119-159的量比循环中的高约100倍,是迄今为止浓度梯度最高的CSF蛋白质[10],因此它作为血脑屏障完整性的标志物,与许多神经系统疾病的发病过程相关。
1 材料和方法
1.1 研究对象和分组
(1)病例组选取2016年至2019年以急性脑梗死为诊断收入盛京医院第三神经内科病房的患者102人,对照组选择同期以头晕、椎基底动脉供血不足、面神经麻痹等为诊断住院治疗的患者107人,磁共振未发现新发梗死病灶。
(2)病例组纳入标准:1)符合《中国急性缺血性脑卒中诊治指南2014》的诊断准;2)急性起病,患者抽血时距离发病时间小于72小时;3)患者均行头磁共振DWI证实新发梗死病灶。
病例组排除标准:1)非血管性病因;2)影像学检查示脑出血;3)可能影响血清PENK-A 水平的疾病:包括严重感染,脓毒血症,心肌梗死,严重的肝肾疾病,严重心衰;4)临床病例资料不完整。
1.2 资料的收集与样本的检测
1.2.1 一般病例资料的收集
患者入院后收集患者的一般情况:年龄、性别、吸烟史、饮酒史、实验室检查结果,病例组患者入院24小时内按美国国立卫生研究所脑卒中量表(NIHSS)评分评估患者出入院的神经功能缺损程度。根据入院后头磁共振DWI序列,用不规则物体体积公式计算梗死体积,根据梗死体积分组,梗死体积大于5cm3为大面积脑梗死组,小于等于梗死体积大于5cm3为其他脑梗死组。90天后对患者进行电话随访,用改良Rankin量表(mRS)进行行神经功能评估,mRS评分≤2分者为预后良好组,mRS评分>2分者为预后不良组。
1.2.2 样本采集与检测
血液样本:EDTA作为抗凝剂,血样抽取后立即将样本离心,然后储存至-80度冰箱直至分析。
PENK-A 119-159片段浓度的测量:应用双抗体夹心酶联免疫法测定血样中PENK-A水平,试剂盒购买于上海酶联生物公司,按照说明书规范测量。按说明书规范测量得样本在450nm波长处的吸光度OD值,根据标准品的浓度和OD值计算出线性回归方程,带入样品吸光度再乘稀释倍数,获得样本浓度值。通过标准曲线计算样品中PENK-A含量。
1.3 统计学分析
统计分析:应用R version 3.6.2进行统计分析。计量资料用Shapiro-Wilk正态性检验检验正态性,若服从正态分布,用平均数±标准差表示,两样本间均数的比较采用独立样本t检验,若不服从正态分布,采用Mann-Whitney U检验,计数资料采用频数表示,两样本均数的比较采用卡方检验。病例组发病7天时和急性期PENK-A浓度的比较因不服从正态分布,采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义,均为双侧检验。
2 结果
2.1 研究对象的基本情况
急性脑梗死病例组平均年龄(62.74±13.41)岁,其中男性65人。对照组平均年龄(61.42±12.18)岁,其中男性69人。两组患者年龄服从正态分布,满足方差齐性,在平均年龄,性别比例方面差异无统计学意义,具有可比性。
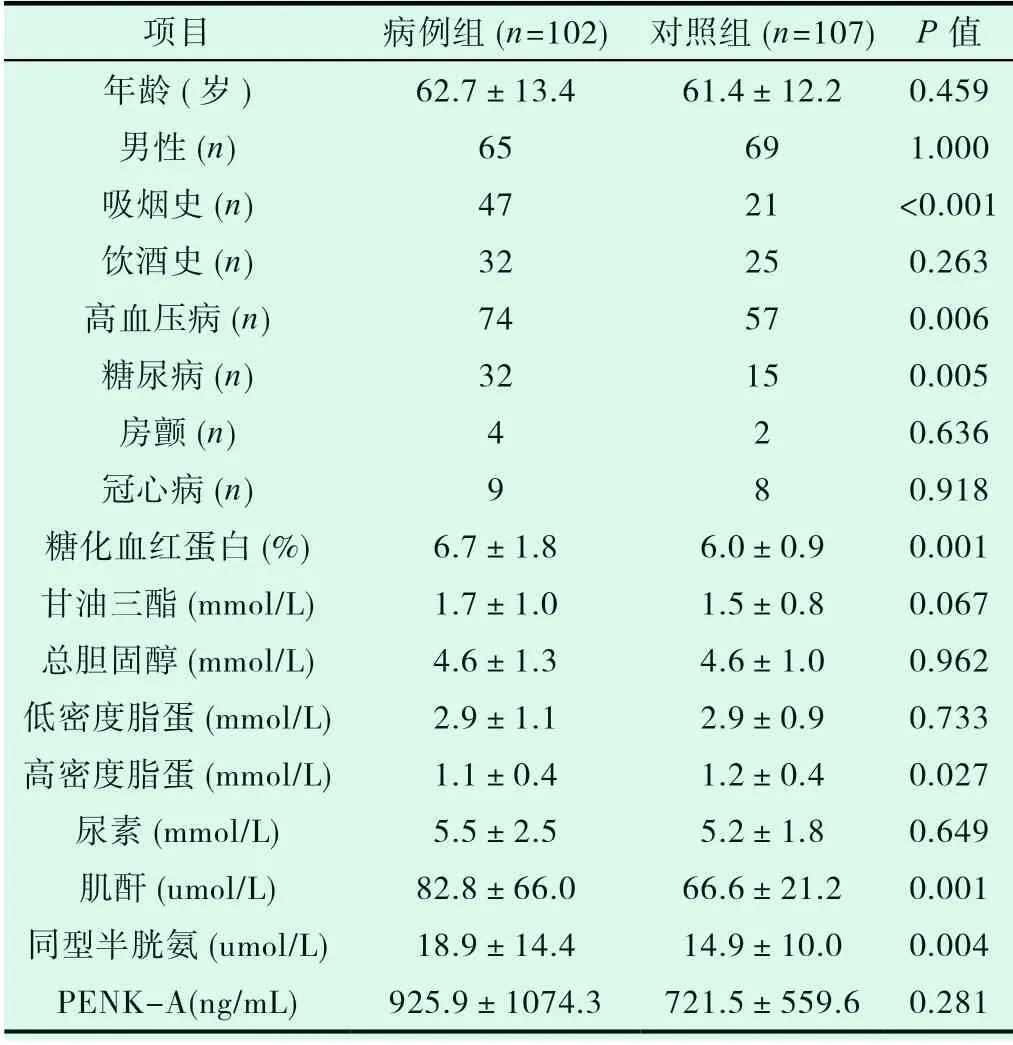
表1 病例组和对照组基本情况
由上图可见,病例组吸烟、高血压病、糖尿病比例,糖化血红蛋白、肌酐、同型半胱氨酸水平高于对照组,高密度脂蛋白水平低于对照组,差异有统计学意义(P<0.05),血浆PENK-A水平高于对照组,差异无统计学意义,暂不能说明PENK-A水平升高与急性脑梗死发病相关。
2.2 病例组急性期和发病7天时血浆PENK-A浓度的比较

表2 病例组急性期和发病7天时血浆PENK-A浓度的比较
患者发病7天后血浆中PENK-A水平较急性期下降,差异无统计学意义,暂不能说明两者间存在差异。
2.3 血浆PENK-A水平与梗死体积的关系
利用不规则物体体积公式计算梗死体积,将梗死体积大于5cm3的样本定义为大面积脑梗死,其中大面积脑梗死患者共31人,其他脑梗死患者71人。统计显示,大面积脑梗死患者血浆PENK-A浓度大于其他脑梗死患者血浆PENK-A浓度,差异有统计学意义(P<0.001)。使用Spearman相关性分析显示,血浆中PENK-A浓度与梗死体积呈正相关(r=0.818,P<0.001)。
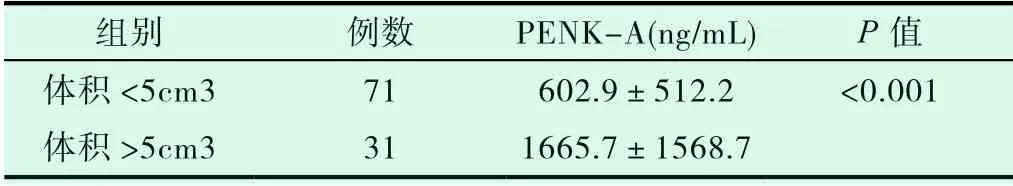
表3 血浆PENK-A水平与梗死体积的关系
2.4 血浆PENK-A水平与临床预后的关系
病例组90天电话回访失访4例,最终进入队列研究的患者共有98例,其中24例为预后不良组(24.49%),74例为预后良好组(75.51%),以mRS评分x小于等于2分为预后良好组,大于2分为预后不良组,两组临床资料比较见表3.4.1,可见预后不良组PENK-A水平明显高于预后良好组,差异有统计学意义(P<0.001)。将临床预后与血浆PENK-A浓度进行logistic回归,显示预后不良与高PENK-A浓度正相关(OR值:1.000851,95%可信区间CI:1.000339~1.001687,P=0.009)。

表4 预后良好组与预后不良组临床资料比较

表5 脑梗死预后logistic回归分析
3 结论
3.1 急性脑梗死病例组血浆PENK-A浓度高于对照组,差异无统计学意义,暂不能说明急性脑梗死患者PENK-A浓度升高。
3.2 发病7天后血浆中PENK-A水平较急性期下降,差异无统计学意义,暂不能说明两者间存在差异。
3.3 大面积脑梗死患者血浆PENK-A浓度高于其他脑梗死患者血浆PENK-A浓度,差异有统计学意义;相关性分析显示,血浆中PENK-A浓度与梗死体积呈正相关。
3.4 预后不良组PENK-A水平明显高于预后良好组,差异有统计学意义;logistic回归示预后不良与高PENK-A浓度正相关。
4 讨论
通过急性脑梗死病例组与对照组临床资料的对比发现,病例组吸烟、高血压病、糖尿病比例,糖化血红蛋白、肌酐、同型半胱氨酸水平高于对照组,高密度脂蛋白水平低于对照组,差异有统计学意义(P<0.05),病例组血浆PENK-A水平(925.9±1074.3 ng/mL)高于对照组(721.5±559.6 ng/mL),差异无统计学意义(P=0.281),结果与Doehner W等人研究不符[24],他们通过研究发现,急性脑梗死患者发病24小时内血浆PENK-A浓度较对照组显著升高,可能由于①本研究样本量较小,其中小面积轻症患者病例数较多,推测为小面积轻度脑梗血脑屏障破坏较轻,引起PENK-A水平变化不显著导致。②因研究条件限制,本研究采集的是患者发病72小时内的血液样本,不排除浓度随时间下降的影响。因此暂不能说明PENK-A水平升高与急性脑梗死发病相关。通过病例组发病急性期与发病7天时血浆PENK-A浓度的对比发现,病例组急性期PENK-A浓度(925.9±1074.3 ng/mL)高于发病7天时PENK-A浓度(897.3±957.1 ng/mL),差异无统计学意义(P=0.712),暂不能说明发病7天后血浆PENK-A浓度较急性期降低。进一步研究考虑对血浆PENK-A水平进行动态监测,探寻血浆PENK-A浓度与发病时间的关系,以判别是否可以作为脑梗死急性期的标志物。
通过对大面积脑梗死组样本资料和其他脑梗死组样本资料的对比发现,大面积脑梗死组患者血浆PENK-A浓度(1665.7±1568.7ng/mL)较其他面积脑梗死组(602.9±512.2ng/mL)显著升高,差异有统计学意义(P<0.001),用Spearman相关性分析显示,血浆中PENK-A浓度与梗死体积呈正相关(r=0.818,P<0.001)。研究发现,梗死体积大时,PENK-A浓度明显升高,因此,PENK-A浓度可以作为评估脑梗死严重程度的标志物。通过预后不良组与预后良好组临床资料的对比,发现预后不良组血浆PENK-A浓度(1663.0±1785.0ng/mL)显著高于预后良好 组(683.1±582.1ng/mL),差 异 有 统 计 学 意 义(P<0.001)。logistic回归示预后不良与高PENK-A浓度正相关(OR值:1.000851,95%可 信 区 间CI:1.000339~1.001687,P=0.009)。因此对PENK-A的研究可以为临床工作提供指导,可以作为预测脑梗死预后的标志物,但还需要更多的临床实验加以验证。
本研究尚存在一些不足之处,①因研究条件受限,病例组和对照组样本均出自同一医院,可能会存在选择性偏倚。 ②因研究条件限制,本研究采集的是患者发病72小时内的血液样本,不排除浓度随时间下降的影响;未能对PENK-A浓度进行动态监测,探寻血浆PENK-A浓度与发病时间的关系,以判别是否可以作为脑梗死急性期的标志物。③未能去除心衰、感染等可能引起PENK-A浓度变化的混杂因素的影响。④病例组、对照组样本量较小,需扩大样本量进一步研究。

