N-乙酰半胱氨酸对PM2.5引起HaCaT细胞损伤的保护作用
李锦濯 林志鹏 曾倩雯 孙仁山
陆军军医大学大坪医院皮肤科,重庆,400042
PM2.5是大气悬浮颗粒物(particulate matter, PM)中的细颗粒物,空气动力学直径≤2.5 μm,其粒径小,危害大,是空气污染重要的监测指标。随着全球经济快速发展,空气污染严重,PM2.5污染引发的健康问题也受到广泛关注,我国于2012年制定了PM2.5的空气质量标准[1]。PM2.5可以长时间悬浮于空气中,表面富集有多种有害物质,其主要成分为:NH4+、SO42-、NO3-等无机盐,多环芳烃等有机物,有机碳、无机碳等含碳组分,多种重金属元素以及一些致病微生物[2]。
流行病学研究报道PM2.5可以影响呼吸系统[3]和心血管系统[4]疾病的发病率和死亡率。皮肤作为机体最大的器官,长期处于环境PM2.5中,PM2.5中含有脂溶性成分如多环芳烃等,容易渗透进入皮肤[5]。目前研究认为,PM2.5中的有毒物质既可以直接经皮吸收,也可以经过呼吸系统进入人体后通过血液循环到达皮肤,进而诱导皮肤细胞氧化应激,激活细胞内多种炎症信号通路,导致皮肤损伤[6]。角质形成细胞在皮肤炎症反应的启动与加重过程中发挥重要作用,与多种炎症性皮肤病的发生发展密切相关。本课题组前期发现PM2.5可降低HaCaT细胞存活率,促进细胞凋亡,且可能通过诱导NF-κB信号通路活化进而上调CCL20表达[7],但PM2.5导致皮肤细胞损伤的具体机制以及如何进行防治尚不清楚。NAC作为一种高效的抗氧化剂,可以清除细胞内活性氧自由基来降低氧化应激状态,通过研究NAC是否对PM2.5诱导的HaCaT细胞损伤发挥保护作用,探讨氧化应激在PM2.5诱导的HaCaT细胞损伤中可能的作用。
1 材料和方法
1.1 材料
1.1.1 主要仪器 CO2培养箱(美国Thermo)、倒置显微镜(日本OLYMPUS IX70)、SpectraMax i3x多功能酶标仪(美国Molecular Devices)、CFX Connect real-time PCR仪(美国BIO-RAD)、ChemiDocTM Touch Imaging System化学发光成像仪(美国BIO-RAD)、NanoDrop2000超微量核酸蛋白测定仪(美国Thermo)等。
1.1.2 主要试剂 DMEM培养基(SH30022美国Hyclone)、ROS试剂盒(S0033S上海碧云天)、CCK-8试剂盒(CK04日本同仁)、ELISA试剂盒(E-EL-H0149c H1598c H2402c武汉Elabscience)、NAC(S0077上海碧云天)、Phospho-NF-κB p65 Rabbit mAb(3033美国CST)、NF-κB p65 Rabbit mAb(8242美国CST)、重组Anti-GAPDH抗体(ab181602美国abcam)、RT-PCR引物(上海生工)、SYBR Green试剂盒(QPK-201日本toyobo)等。
1.2 方法
1.2.1 PM2.5混悬液制备 PM2.5收集膜由重庆市生态环境监测中心馈赠。将收集好PM2.5的滤膜剪成小块,放入试管,加三蒸水,超声震荡5 h,收集震荡液后过滤。滤液移至平皿,真空冷冻干燥48 h后收集絮状产物,-20℃储存。称取适量颗粒物,超净工作台内紫外照射30 min,用无菌PBS配成10 mg/mL的储存液,4℃储存。实验前用培养液稀释成不同浓度PM2.5混悬液(0~400 μg/mL)。
1.2.2 细胞培养 HaCaT细胞由重庆市陆军军医大学防原教研室馈赠。采用含10%胎牛血清的DMEM培养基,在37℃,5% CO2细胞培养箱中培养细胞,使用0.25%胰酶进行消化传代。取对数生长期,稳定生长的HaCaT细胞进行实验。
1.2.3 实验分组与NAC干预 实验分组:对照组和实验组。对照组:PM2.5浓度为:0 μg/mL。实验组:不同浓度PM2.5刺激实验:设五个PM2.5浓度:25、50、100、200、400 μg/mL。NAC干预实验:PM2.5浓度为:200 μg/mL,NAC干预浓度:细胞增殖实验为2.5、5、10 mmol/L,根据细胞增殖实验结果,其余干预实验NAC浓度均为5 mM。每组至少设三个平行孔。
NAC干预:NAC干预组用DMEM配制相应浓度的NAC工作液预处理1 h,其余各组加同等剂量的DMEM。随后NAC干预组及PM2.5组细胞再予以200 μg/mL浓度的PM2.5混悬液刺激24 h,对照组给予同等剂量的DMEM全培养液孵育24 h,再进行后继实验。
1.2.4 DCFH-DA探针法检测ROS 选取对数生长期的HaCaT细胞,消化离心重悬后,细胞接种96孔板,待细胞融合至80%左右,弃培养基。根据1.2.3实验分组,PM2.5染毒24 h,弃培养基。缓冲液洗涤,避光条件加入100 μL DCFH-DA(浓度:10 μmol/L),在37℃下CO2培养箱中孵育20 min。缓冲液冲洗3次,采用多功能酶标仪检测荧光强度。以实验组与对照组荧光值之比表示ROS相对水平。
1.2.5 CCK-8法检测细胞存活率 细胞接种96孔板,PM2.5染毒24 h后,弃培养基。PBS洗涤3次,加100 μL含l0%胎牛血清的DMEM培养基及10 μL CCK-8检测试剂,孵育2 h。使用酶标仪在450 nm模式下检测光密度值(OD值)。细胞存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×l00%。
1.2.6 RT-PCR法检测炎症因子mRNA表达水平 细胞接种于6孔板,PM2.5染毒24 h后,提取总RNA。根据逆转录试剂盒步骤说明,逆转录合成cDNA。SYBR Green法检测IL-1β、TSLP、IL-33的mR-NA表达水平。PCR运行程序为:95℃ 3 min,95℃ 10 s,58℃ 5 s,72℃ 20 s,40个循环。以GAPDH为内参,分析目的基因的相对表达量。引物见表1。

表1 RT-PCR引物
1.2.7 ELISA法检测炎性因子分泌水平 细胞接种于12孔板,PM2.5染毒24 h后,收集细胞培养上清液:离心,取上清液。按照试剂盒操作说明,检测上清液中IL-1β、TSLP、IL-33水平。
1.2.8 Western blot法检测NF-κB信号通路相关蛋白 细胞接种于6孔板,PM2.5染毒24 h后,加入RIPA裂解液提取蛋白。根据Western blot操作方法进行上样,电泳,转膜,封闭,免疫反应,显影。用Image J软件分析蛋白灰度值,以p-p65与p65灰度值之比来表示蛋白相对表达量。
2 结果
2.1 不同浓度PM2.5对HaCaT细胞生成ROS水平的影响 暴露于25 μg/mL PM2.5后,HaCaT细胞内ROS生成水平高于对照组,差异有统计学意义(P<0.05),50~400 μg/mL浓度组细胞内ROS水平显著高于对照组(P<0.01),且ROS水平呈浓度梯度性增高,400 μg/mL浓度组细胞内ROS生成水平最高。表明PM2.5诱导HaCaT细胞内ROS产生增多,导致细胞内氧化应激反应(图1)。
2.2 不同浓度PM2.5对HaCaT细胞表达及分泌炎症因子的影响 如图2a所示,与对照组比较,HaCaT细胞内炎性因子IL-1β、IL-33、TSLP mRNA表达水平,暴露于较高PM2.5浓度(200、400 μg/mL)后,均明显升高,差异有统计学意义(P<0.05);如图2b所示,与对照组比较,当PM2.5刺激浓度≥50 μg/mL时,HaCaT细胞分泌IL-1β水平明显增高,差异有统计学意义(P<0.05);当PM2.5刺激浓度≥25 μg/mL,HaCaT细胞分泌TSLP、IL-33水平显著增高(P<0.01)。

图1 不同浓度PM2.5刺激后HaCaT细胞生成ROS水平与对照组(0 μg/mL)比较,*P<0.05,**P<0.01

图2 不同浓度PM2.5刺激后炎症因子mRNA表达水平及其分泌浓度与对照组比较,*P<0.05,**P<0.01
2.3 NAC干预后,PM2.5对HaCaT细胞增殖活性的影响 对照组HaCaT细胞存活率为(100±3.718)%,200 μg/mL PM2.5组细胞存活率为(74.88±3.487)%,与对照组相比,PM2.5组存活率显著降低(P<0.01);不同浓度NAC预处理细胞1 h,继而用200 μg/mL PM2.5颗粒染毒24 h,2.5 mM NAC干预组存活率与PM2.5组比较无明显差别;5 mM、10 mM NAC干预组存活率分别为(87.92±3.034)%,(86.98±2.223)%,与PM2.5组比较,存活率均明显增高(P<0.05),但仍低于对照组存活率,表明NAC可以部分拮抗PM2.5对HaCaT细胞增殖的抑制作用(图3)。细胞存活率随NAC浓度升高而逐渐增高,5 mM NAC提高细胞活力最明显,后续实验将5 mM作为的NAC干预组工作液浓度。
2.4 NAC干预后,PM2.5对HaCaT细胞ROS生成水平的影响 与对照组比较,PM2.5组HaCaT细胞产生ROS水平显著增高(P<0.01);与PM2.5组比较,NAC干预组ROS水平显著降低(P<0.01),减少约43.35%。但仍高于对照组ROS水平,表明NAC可以部分降低PM2.5诱导的ROS生成(图4)。
2.5 NAC干预后,PM2.5对HaCaT细胞分泌炎症因子水平的影响 与对照组相比,PM2.5组HaCaT细胞分泌IL-1β、TSLP、IL-33水平显著增高(P<0.01);与PM2.5组相比,NAC干预组细胞分泌IL-1β、TSLP、IL-33水平显著降低(P<0.05),但仍高于对照组水平,表明NAC可以部分降低PM2.5诱导HaCaT细胞分泌IL-1β、TSLP、IL-33的水平(表2)。

表2 NAC干预后HaCaT细胞分泌炎症因子水平
2.6 NAC干预后,PM2.5对HaCaT细胞表达NF-κB信号通路相关蛋白的影响 与对照组比较,PM2.5组细胞内NF-κB p-p65蛋白表达水平显著上调(P<0.01),提示PM2.5可以激活细胞内NF-κB信号通路;与PM2.5组相比,NAC干预组NF-κB p-p65蛋白表达水平显著下调(P<0.05),但仍高于对照组水平,表明NAC可以部分降低PM2.5诱导的HaCaT细胞内NF-κB p-p65蛋白表达水平(图5)。
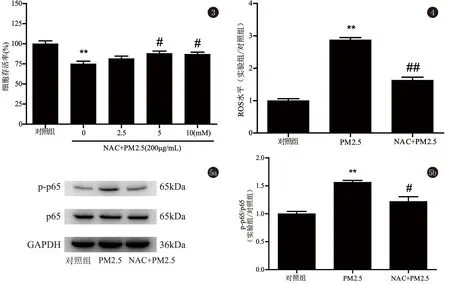
图3 NAC干预后HaCaT细胞存活率与对照组比较,**P<0.01,与PM2.5组(200 μg/mL)比较,#P<0.05
3 讨论
研究表明PM2.5与特应性皮炎(atopic dermatitis,AD)、痤疮、湿疹等炎症性皮肤病以及皮肤老化密切相关[8]。Kim等[9]发现PM2.5浓度与AD症状之间呈正相关,PM2.5每增加1 μg/m3,特应性皮炎症状增加0.67%。课题组通过meta分析发现PM2.5浓度每增高10 μg/m3,对过敏性皮肤病影响的合并效应量为1.0066(95%CI:1.0033~1.0100),亚组分析发现PM2.5对AD影响的合并效应量为1.0320(95%CI:1.0056~1.0590),对湿疹影响的合并效应量为1.0066(95%CI:1.0029~1.0103),表明PM2.5会一定程度增加AD以及湿疹的发病率[10]。研究还发现环境中PM2.5浓度升高与寻常痤疮门诊量的增加显著相关[11]。暴露于高浓度的PM2.5还可导致皮肤老化明显,面部出现更多的色素斑,并增加鼻唇沟褶皱[12]。
PM2.5诱导氧化应激和炎症级联反应是其皮肤损伤的主要机制,而抗氧化剂和抗炎药物可能是针对PM2.5引起的皮肤损伤的防治药物[13]。氧化应激是PM2.5诱导细胞产生的主要损伤效应,ROS是一种常用的反映氧化应激的指标。ROS是一组含氧的高度活性的化学物质,由氧代谢产生,包括羟基自由基、超氧阴离子、过氧化物、单线态氧等[14]。ROS作为细胞内信号分子,与细胞增殖及凋亡密切相关,同时参与许多炎症相关信号通路如丝裂原活化蛋白激酶(MAPK)信号通路和NF-κB信号通路的激活[15]。过量的ROS通过损伤脂质、蛋白质和DNA等生物大分子,引起细胞器应激,导致细胞氧化损伤[16]。本研究结果显示,ROS生成水平呈PM2.5浓度依赖性增高,提示PM2.5能引起细胞内氧化应激反应,与Piao等[17]研究结果,PM2.5引起HaCaT细胞内ROS生成增多,导致细胞损伤一致。
炎症反应是PM2.5诱导细胞产生的另一种损伤效应。NF-κB是PM2.5引起炎性损伤过程中较早出现的转录因子,可以入核调控TNF-α、IL-8、IL-6、IL-1β等多种炎症因子的基因转录[18]。这些炎症因子进而可以招募或激活不同类型的免疫细胞,如记忆T细胞和效应T细胞及朗格汉斯细胞等,从而调节免疫反应[19]。氧化应激与炎症反应是紧密相关的过程,在PM2.5诱导的炎症反应中,氧化应激起主要作用,NF-κB能被多种刺激因素激活,ROS为重要因素之一。一方面PM2.5通过产生ROS诱导NF-κB激活,进而释放下游炎性因子,启动炎症因子的级联反应,导致广泛的炎症损伤;另一方面,NF-κB反过来诱导ROS和NO产生[20]。本研究发现,PM2.5刺激后细胞内NF-κB p-p65蛋白表达水平较对照组显著增高(P<0.01),提示细胞内NF-κB信号通路激活。随着PM2.5刺激浓度增高,炎症因子IL-1β mRNA表达水平及分泌浓度呈逐渐升高趋势。IL-1β的转录受NF-κB信号通路调控,IL-1β可诱导免疫细胞的浸润及其他炎症因子的生成,引起炎性损伤。IL-1β与IL-1受体I(IL-1R I)结合发挥作用,IL-1R I在许多靶细胞上表达,IL-1β通过上调淋巴细胞IL-2受体、促进B细胞增殖或促进辅助性T细胞17(Th17)分化等途径参与调节免疫反应[21]。皮肤中IL-1信号传导对于皮肤的内环境稳态是必不可少的,证据表明,IL-1β参与许多炎症性皮肤病的发病机制[22]。
TSLP、IL-33是过敏反应相关的细胞因子,主要通过激活DC细胞,促进Th2型过敏反应,与AD等过敏性疾病密切相关。研究认为AD易感人群角质形成细胞受外界环境因素影响表达TSLP、IL-33等多种关键炎症因子增多,继而通过激活皮肤DC细胞,激活并诱导Th2细胞产生IL-4, IL-13,IL-31等细胞因子,反过来作用于角质形成细胞,形成炎症循环,在AD的发病机制中至关重要[23]。本研究结果显示,随着PM2.5刺激浓度增高,炎症因子TSLP、IL-33 mRNA表达水平及分泌浓度呈逐渐升高趋势,与姚骐羽等[24]研究结果一致,姚骐羽等研究发现PM2.5诱导人原代角质形成细胞表达TSLP、IL-33、IL-1α上调,引起细胞内皮肤屏障相关蛋白表达改变,可能导致皮肤屏障损伤。
为探究氧化应激与PM2.5诱导的细胞增殖及炎症反应改变之间的关系,我们采用抗氧化剂NAC作为干预条件。NAC是细胞内还原型谷胱甘肽(GSH)的前体,可以促进细胞内GSH合成,减少ROS的生成,清除已生成的ROS,发挥抗氧化应激的作用,维持细胞氧化还原状态平衡[25]。课题组前期研究发现,PM2.5引起HaCaT细胞增殖受限,凋亡率增高,NF-κB p-p65蛋白表达逐渐上调,呈浓度依赖性,当PM2.5浓度为200 μg/mL时对HaCaT细胞造成的损伤较为明显[7]。因此,本研究中NAC干预实验PM2.5浓度定为200 μg/mL,结果显示NAC干预后,细胞内ROS生成水平减少,细胞存活率增高,同时NAC还可以显著抑制PM2.5诱导的NF-κB的活化及IL-1β、TSLP、IL-33分泌水平。NAC干预实验结果间接表明PM2.5诱导的细胞增殖抑制,NF-κB信号激活,IL-1β、TSLP、IL-33表达上调可能与其引起的细胞氧化应激有关。本实验结果与Wang等[26]研究一致,Wang等发现PM诱导支气管上皮细胞内ROS生成增多,并且激活MAPK信号通路和NF-κB信号通路,导致IL-1β、IL-6、IL-8的表达上调,而NAC干预可以显著减少ROS生成并抑制MAPK和NF-κB通路的激活以及IL-1β、IL-6、IL-8的表达,结果表明氧化应激是PM诱导肺部炎症反应的关键因素。而课题组既往研究表明NAC可以抑制PM2.5诱导的肥大细胞内ROS生成及肥大细胞活化脱颗粒释放IL-4和β-Hex[27]。此外,Zhen等[28]发现抗氧化药物烟酰胺可以抑制PM2.5诱导的HaCaT细胞内ROS生成,进而减轻PM2.5诱导的如脂类、蛋白质和DNA分子氧化及细胞凋亡。Jin等[29]研究表明NAC可以减弱PM诱导的角质形成细胞以及小鼠皮肤的炎症,认为PM导致的皮肤炎症反应与ROS密切相关。这些研究结果均提示应用抗氧化剂可以保护细胞对抗PM2.5引起的氧化损伤及炎症损伤。
综上,本研究发现PM2.5可以诱导HaCaT细胞内ROS生成增多,抑制细胞增殖,引起细胞内NF-κB信号通路激活及炎症因子IL-1β、TSLP 、IL-33表达上调,这可能是PM2.5导致皮肤炎症损伤的病理机制之一。抗氧化剂NAC可以在一定程度上拮抗PM2.5引起的细胞增殖抑制和炎症反应,表明氧化应激与PM2.5诱导的细胞损伤密切相关,而NAC可以作为一种有效的保护剂,这为进一步研究PM2.5引起皮肤损伤的机制及其防治提供了参考。

