大黄素对重症急性胰腺炎大鼠肺损伤的保护作用及对MAPK通路的影响
新乡医学院第三附属医院 河南,新乡 450003
急性胰腺炎(acute pancreatitis,AP)是临床上病情凶险、并发症多、病死率高的急腹症,临床表现为腹痛、呕吐、发热以及淀粉酶和脂肪酶升高,约有20%的患者由于病情较重而发展为重症急性胰腺炎(severe acute pancreatitis,SAP)[1]。SAP可导致胰腺及其周围组织坏死,这种坏死和炎症反应可能涉及到远端器官,导致多器官衰竭[2]。急性肺损伤是SAP患者死亡的重要原因,可进一步发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),而ARDS是SAP最严重的肺部并发症[3]。有研究显示,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号通路参与多种原因诱导的肺损伤,抑制MAPK信号通路的活化则可缓解肺组织病理性损伤,抑制炎症反应,减少细胞凋亡[4-5]。大黄是我国传统中药材,具有清热泻火、凉血解毒、利湿退黄的作用,与其他药物配伍可用于治疗Ap、急性胆囊炎、急性肠梗阻等急腹症[6-7]。大黄素(Emodin)是大黄的主要有效成分,研究证明大黄素可显著减轻AP模型大鼠胰腺组织损伤,降低血清淀粉酶和脂肪酶的水平,是治疗SAP的有效天然产物[8],但目前大黄素在SAP合并肺损伤中的作用研究较少,其机制尚不清楚。本研究通过建立SAP肺损伤大鼠模型,以MAPK信号通路为切入点,观察大黄素对SAP大鼠肺损伤的影响并初步探究其机制,为AP及其并发症的药物治疗提供理论依据。
1 材料和方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)级SD大鼠80只,雌雄各半,6周龄,体质量180~220g,购于北京维通利华实验动物技术有限公司[实验动物生产许可证号码:SCXK(京)2017-0011],饲养于河南省实验动物中心实验室独立动物房[实验动物使用许可证号码:SYXK(豫)2016-0002]。饲养条件:室温(22±2)℃,湿度(50±10)%,每天定时换气,保持12h:12h光暗照明,食水不限。研究方案获本院伦理委员会批准。
1.2 药品与试剂 大黄素购于上海一基实业有限公司(纯度>98%,批号:518-82-1);牛黄胆酸钠、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、中性树胶、羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)均购于北京索莱宝科技有限公司(批号:T8510、G1121、G8590、IS9000);脂肪酶、淀粉酶、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附检测(enzyme linked immunosorbent assay,ELISA)试剂盒均购于武汉伊莱瑞特生物科技有限公司(批号:EEL-M2448c、E-EL-R2545c、E-EL-R2856c、E-ELR0015c);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒均购于南京建成生物工程研究所有限公司(批号:A001-3-2、A003-1-2);B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein gene,Bax)、磷酸化p38丝裂酶原激活蛋白激酶 (phosphorylated p38 mitogen-activated protein kinase,p-p38 MAPK)、磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase 1/2,p-ERK1/2)、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK) 兔源单克隆抗体均购于美国CST公司 (批号:3498、5023、4511、4370、4668);羊抗兔二抗购于达文生物有限公司(批号:DW-GAR007);RevertAidTMFirst Strand cDNA Synthesis Kit购于美国Thermo Scientific公司 (批号:K1622);蛋白定量试剂盒购于武汉博士德生物工程有限公司(批号:AR0146)。
1.3 仪器 GEM Premier 3000血气分析仪购于Instrumentation Laboratory Company公司;DW-86L626超低温冰箱为海尔集团产品;IX53显微镜购于日本奥林巴斯公司;G:BOX多功能凝胶成像系统购于Syngene公司;Multiskan MK3酶标仪购于Thermo Fisher Scientific公司;TGL16MB高速冷冻离心机为长沙湘智离心机仪器有限公司产品。
1.4 方法
1.4.1 分组与造模 将80只SD大鼠随机分为对照组、模型组、大黄素高剂量组和大黄素低剂量组,每组20只。除对照组外,其余组大鼠均使用牛磺脱氧胆酸钠建立SAP大鼠模型[9]。造模方法:大鼠提前12h禁食,腹腔注射10%水合氯醛麻醉,麻醉剂量为0.3mL·100g-1,仰卧位固定,腹部备皮、消毒,沿腹中线打开腹腔,暴露胰腺,找到十二指肠乳头,在十二指肠乳头旁用26G留置针穿破肠壁,进入胰管,微血管钳夹闭肝门处胰管,以0.1mL·min-1的速度泵入3.5%牛磺脱氧胆酸钠,剂量为0.1mL·100g-1,2min后取下微血管钳。观察大鼠胰腺组织变化,如胰腺出现充血、水肿、点状出血、皂化斑和坏死等现象则说明造模成功,随后将胰腺复位,缝合腹部。对照组大鼠仅开腹,适当翻动胰腺后关腹。模型组、大黄素高、低剂量组均造模成功,造模完成后无大鼠死亡。
1.4.2 给药方法 于造模完成大鼠苏醒后的1h及6h给药。根据预实验结果,大黄素高、低剂量组大鼠分别以60mg·kg-1、30mg·kg-1大黄素(临用前用0.5% CMC-Na混合均匀)灌胃,给药体积为1mL·100g-1,对照组和模型组大鼠灌服等量0.5% CMC-Na。
1.4.3 血清脂肪酶、淀粉酶、TNF-α、IL-6含量检测 造模12h后大鼠腹主动脉穿刺取血,4℃静置2h,3 000r·min-1离心10min,离心半径为12.5cm,分离血清检测大鼠血清脂肪酶、淀粉酶、TNF-α、IL-6的含量,操作按照试剂盒说明进行。
1.4.4 氧分压(partial pressure of oxygen,PaO2)、二氧化碳分压(partial pressure of carbon dioxide,Pa-CO2)、氧合指数(oxygenation index,OI)、肺组织湿干重比(wet-to-dry weight ratio,W/D)检测 大鼠腹主动脉取血3mL,采用血气分析仪检测PaO2、PaCO2,并计算OI。OI=PaO2/FiO2,FiO2即吸氧浓度,未吸氧情况下FiO2值为空气中氧浓度0.21。随后分离各组大鼠右上肺叶用于W/D检测,其余肺叶一部分以4%多聚甲醛固定用于HE染色,另一部分-80℃冻存用于ELISA、实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,RT-qPCR)和Western blot。以吸水纸擦干肺组织表面水分后称重,记录为湿重(wet weight,W),随后将肺组织放入80℃恒温干燥箱中烘干,24h后称重,记录为干重(dry weight,D),并计算W/D。
1.4.5 HE染色观察肺组织病理变化 取各组大鼠肺组织,以4%多聚甲醛固定48h,蒸馏水洗涤,梯度乙醇脱水,制作组织蜡块,冰上预冷4μm切片,二甲苯脱蜡30min,梯度乙醇复水,使用苏木精和伊红染液分别染细胞核和细胞质,脱水、透明后中性树胶封片,镜下观察各组大鼠肺组织病理变化。
1.4.6 肺组织SOD活力、MDA含量检测 取适量大鼠肺组织,加入预冷的磷酸盐缓冲溶液(phosphate buffer saline,PBS),冰上研磨匀浆,10 000r·min-1离心10min后取上清液,离心半径为12.5cm,EP管分装,-80℃保存。按照试剂盒说明书步骤测定肺组织SOD活力和MDA含量。
1.4.7 RT-qPCR检测肺组织Bcl-2、Bax mRNA表达 称取0.1g大鼠肺组织,冰上研磨,加1mL Trizol裂解液提取组织总RNA,使用RevertAidTMFirst Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara公司设计合成,所有样品均以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。反应体系:dNTPs 0.5μL,5×Buffer5μL,Taq酶0.3μL,MgCl21.5μL,cDNA模板2μL,上下游引物分别为1μL,加去离子水至总体积25μL。反应条件:95℃预变性5min,95℃变性30s,62℃退火30s,72℃延伸30s,重复40个循环,最后72℃延伸10min,4℃ 5min终止反应。反应完成后,从PCR仪导出并确认各基因扩增曲线和熔解曲线。实验重复3次,采用2-△△CT的方法计算目的基因mRNA相对表达水平。引物序列见表1。
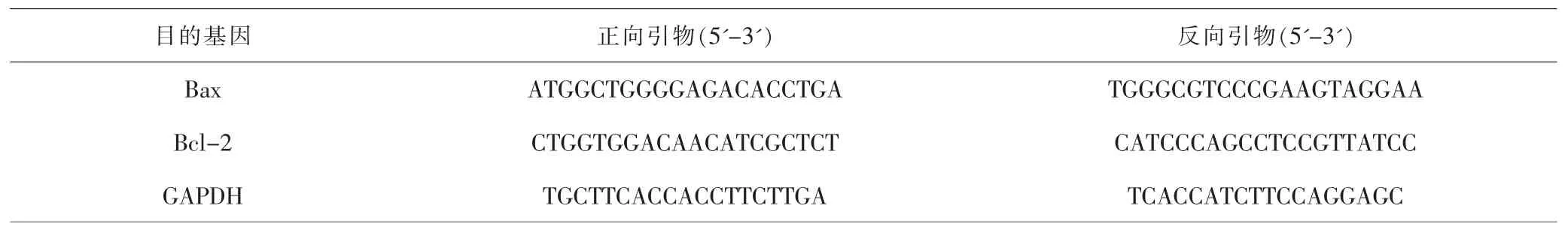
表1 引物序列Tab.1 Primer sequences
1.4.8 Western blot检测肺组织Bcl-2、Bax、p-p38 MAPK、p-ERK1/2、p-JNK蛋白表达 称取0.1g大鼠肺组织,研磨后离心取沉淀,加入裂解液提取肺组织蛋白,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒测定蛋白浓度,配置15%的分离胶和5%的浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),上样后80V电泳2h,60V转膜2h,5%脱脂奶粉封闭2h,随后将膜放入10mL Bcl-2、Bax、p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、JNK、p-JNK兔源一抗稀释液中,稀释比例均为1:1 000,4℃孵 育12h。次日以Tris-Tween缓冲盐溶液(Tris buffered saline tween,TBST)洗涤3次,每次10min,然后加入羊抗兔二抗(稀释比例1:2 000)中,37℃孵育2h,TBST清洗3次后滴加电化学发光液,反应1min后置于凝胶成像系统显影。以GAPDH为内参蛋白,采用Image J软件分析各条带灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.5 统计学分析 采用SPSS 25.0统计软件进行统计学分析,实验重复3次,计量资料以±s表示,多样本比较采用单因素方差分析,两样本比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清脂肪酶、淀粉酶、TNF-α、IL-6含量比较 各组间总体比较,血清脂肪酶、淀粉酶、TNF-α、IL-6含量差异均有统计学意义(P<0.01)。进一步比较显示,与对照组比较,模型组、大黄素高、低剂量组大鼠血清中脂肪酶、淀粉酶、TNF-α、IL-6含量升高,差异有统计学意义(P<0.05);与模型组比较,大黄素高、低剂量组脂肪酶、淀粉酶、TNF-α、IL-6含量均降低,差异有统计学意义(P<0.05);与大黄素高剂量组比较,大黄素低剂量组脂肪酶、淀粉酶、TNF-α、IL-6含量升高,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠血清脂肪酶、淀粉酶、TNF-α、IL-6含量比较(±s,n=3)Tab.2 Comparison of serum lipase,amylase,TNF-α,IL-6 content in each group(±s,n=3)
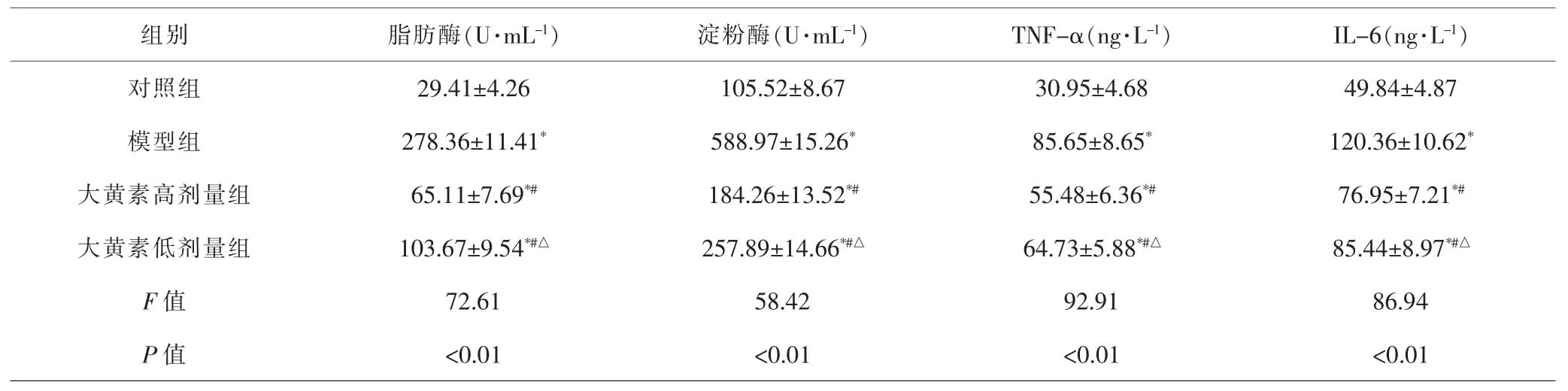
表2 各组大鼠血清脂肪酶、淀粉酶、TNF-α、IL-6含量比较(±s,n=3)Tab.2 Comparison of serum lipase,amylase,TNF-α,IL-6 content in each group(±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与大黄素高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared withe modin high-dose group,△P<0.05
组别 脂肪酶(U·mL-1) 淀粉酶(U·mL-1) TNF-α(ng·L-1) IL-6(ng·L-1)对照组 29.41±4.26 105.52±8.67 30.95±4.68 49.84±4.87模型组 278.36±11.41* 588.97±15.26* 85.65±8.65* 120.36±10.62*大黄素高剂量组 65.11±7.69*# 184.26±13.52*# 55.48±6.36*# 76.95±7.21*#大黄素低剂量组 103.67±9.54*#△ 257.89±14.66*#△ 64.73±5.88*#△ 85.44±8.97*#△F值 72.61 58.42 92.91 86.94 P 值 <0.01 <0.01 <0.01 <0.01
2.2 各组大鼠肺组织W/D及PaO2、PaCO2、OI比较 各组间总体比较,W/D、PaO2、PaCO2、OI差异均有统计学意义(P<0.01)。进一步比较显示,与对照组比较,模型组、大黄素高、低剂量组W/D和PaCO2显著升高,PaO2和OI显著降低,差异有统计学意义(P<0.05);与模型组比较,大黄素高、低剂量组W/D和PaCO2均降低,PaO2和OI均升高,差异有统计学意义(P<0.05);与大黄素高剂量组比较,大黄素低剂量组W/D和PaCO2升高,PaO2和OI降低,差异有统计学意义(P<0.05)。见表3。
表3 各组大鼠肺组织W/D及PaO2、PaCO2、OI比较(±s,n=20)Tab.3 Comparison of W/D,PaO2,PaCO2,OI of lung tissues in each group(±s,n=20)
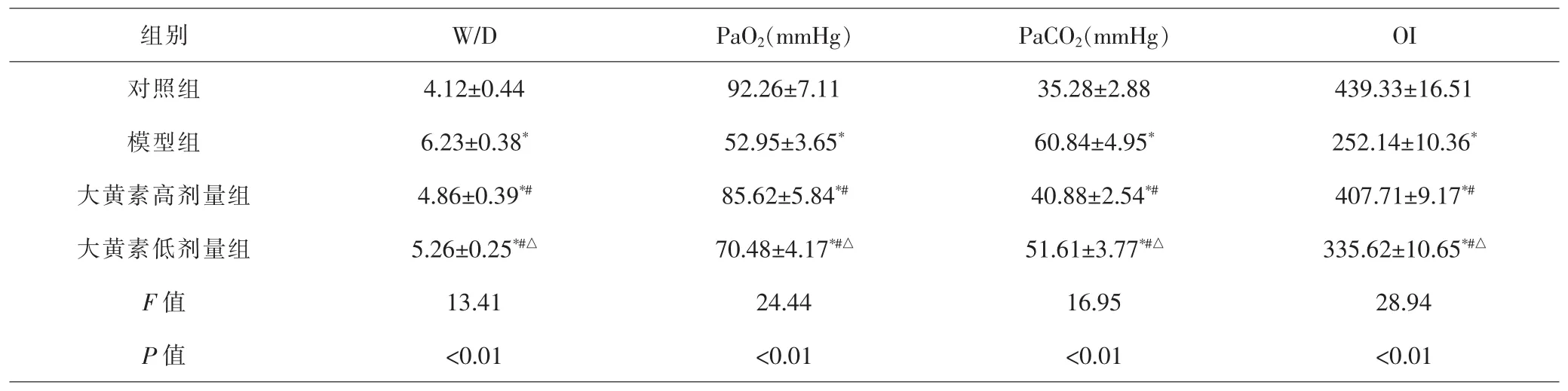
表3 各组大鼠肺组织W/D及PaO2、PaCO2、OI比较(±s,n=20)Tab.3 Comparison of W/D,PaO2,PaCO2,OI of lung tissues in each group(±s,n=20)
注:1mmHg=0.133kPa。与对照组比较,*P<0.05;与模型组比较,#P<0.05;与大黄素高剂量组比较,△P<0.05Note:1mmHg=0.133kPa.Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with emodin high-dose group,△P<0.05
组别 W/D PaO2(mmHg) PaCO2(mmHg) OI对照组 4.12±0.44 92.26±7.11 35.28±2.88 439.33±16.51模型组 6.23±0.38* 52.95±3.65* 60.84±4.95* 252.14±10.36*大黄素高剂量组 4.86±0.39*# 85.62±5.84*# 40.88±2.54*# 407.71±9.17*#大黄素低剂量组 5.26±0.25*#△ 70.48±4.17*#△ 51.61±3.77*#△ 335.62±10.65*#△F值 13.41 24.44 16.95 28.94 P 值 <0.01 <0.01 <0.01 <0.01
2.3 各组大鼠肺组织病理学变化比较 HE染色结果显示,对照组大鼠肺组织结构正常,肺泡完好,无增厚和炎症细胞浸润;与对照组比较,模型组大鼠肺泡壁明显增厚,肺间质充血、水肿,并有大量炎症细胞浸润;与模型组比较,大黄素高、低剂量组大鼠肺组织肺损伤改善,肺泡壁增厚和肺组织充血现象减轻,炎症细胞浸润减少。见图1。
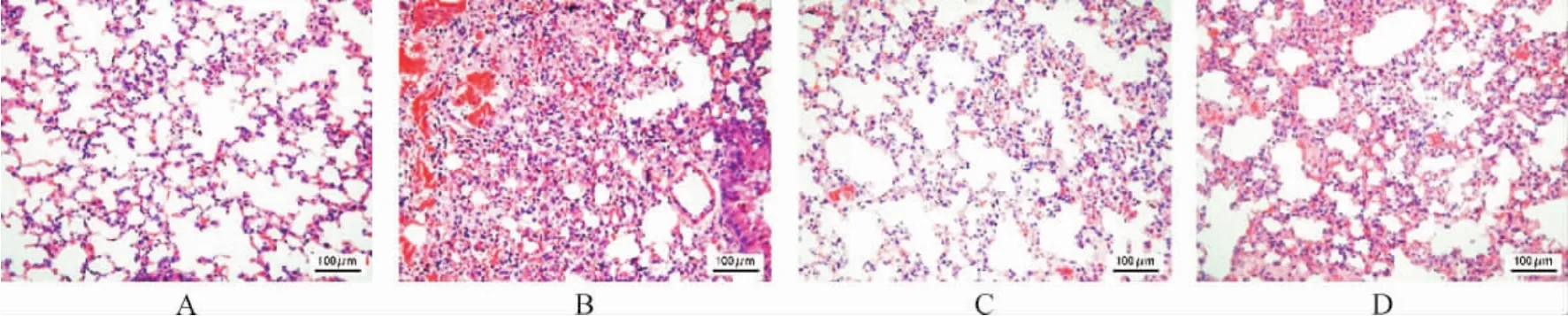
图1 各组大鼠肺组织病理变化(HE染色,200×)Fig.1 Pathological changes of lung tissues in each group (HE staining,200×)
2.4 各组大鼠肺组织SOD活力、MDA含量比较 各组间总体比较,大鼠肺组织SOD活力、MDA含量差异均有统计学意义(P<0.01)。进一步比较显示,与对照组比较,模型组、大黄素高、低剂量组大鼠肺组织SOD活力降低,MDA含量升高,差异有统计学意义(P<0.05);与模型组比较,大黄素高、低剂量组SOD活力升高,MDA含量降低,差异有统计学意义(P<0.05);与大黄素高剂量组比较,大黄素低剂量组SOD活力降低,MDA含量升高,差异有统计学意义(P<0.05)。见表4。
表4 各组大鼠肺组织SOD活力、MDA含量比较(±s,n=3)Tab.4 Comparison of SOD activity and MDA content in lung tissues in each group(±s,n=3)
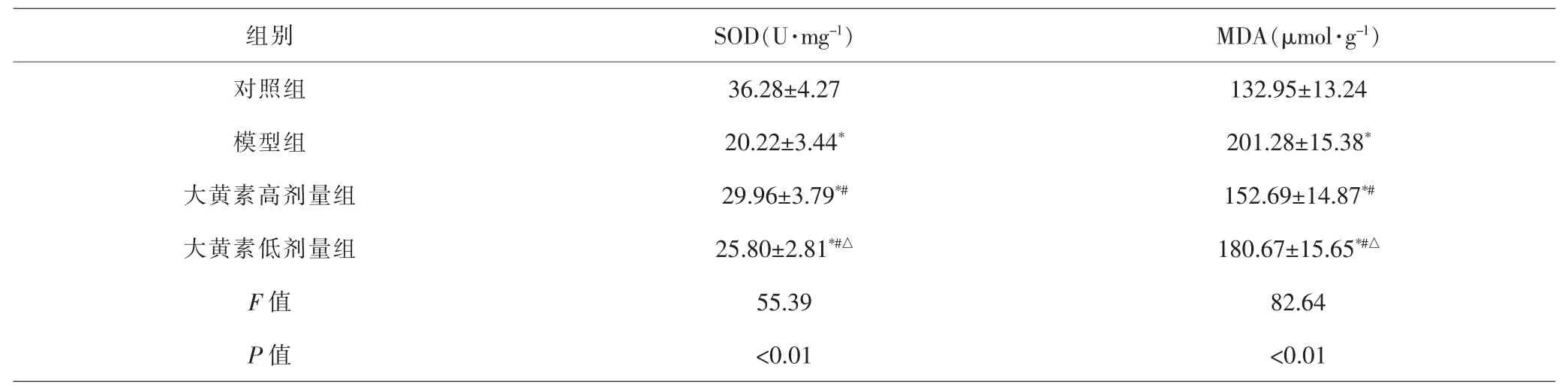
表4 各组大鼠肺组织SOD活力、MDA含量比较(±s,n=3)Tab.4 Comparison of SOD activity and MDA content in lung tissues in each group(±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与大黄素高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with emodin high-dose group,△P<0.05
组别 SOD(U·mg-1) MDA(μmol·g-1)对照组 36.28±4.27 132.95±13.24模型组 20.22±3.44* 201.28±15.38*大黄素高剂量组 29.96±3.79*# 152.69±14.87*#大黄素低剂量组 25.80±2.81*#△ 180.67±15.65*#△F值 55.39 82.64 P 值 <0.01 <0.01
2.5 各组大鼠肺组织Bcl-2、Bax mRNA及蛋白表达水平比较 各组间总体比较,肺组织Bcl-2、Bax mRNA和蛋白表达水平差异均有统计学意义(P<0.01)。进一步比较显示,与对照组比较,模型组、大黄素高、低剂量组大鼠肺组织Bcl-2 mRNA和蛋白表达水平均降低,Bax mRNA和蛋白表达水平均升高,差异有统计学意义(P<0.05);与模型组比较,大黄素高、低剂量组Bcl-2 mRNA和蛋白表达水平升高,Bax mRNA和蛋白表达水平降低,差异有统计学意义(P<0.05);与大黄素高剂量组比较,大黄素低剂量组Bcl-2 mRNA和蛋白表达水平降低,Bax mRNA和蛋白表达水平升高,差异有统计学意义(P<0.05)。见表5、图2。
表5 各组大鼠肺组织Bcl-2、Bax mRNA表达水平比较(±s,n=3)Tab.5 Comparison of Bcl-2 and Bax mRNA expression levels in lung tissues in each group (±s,n=3)
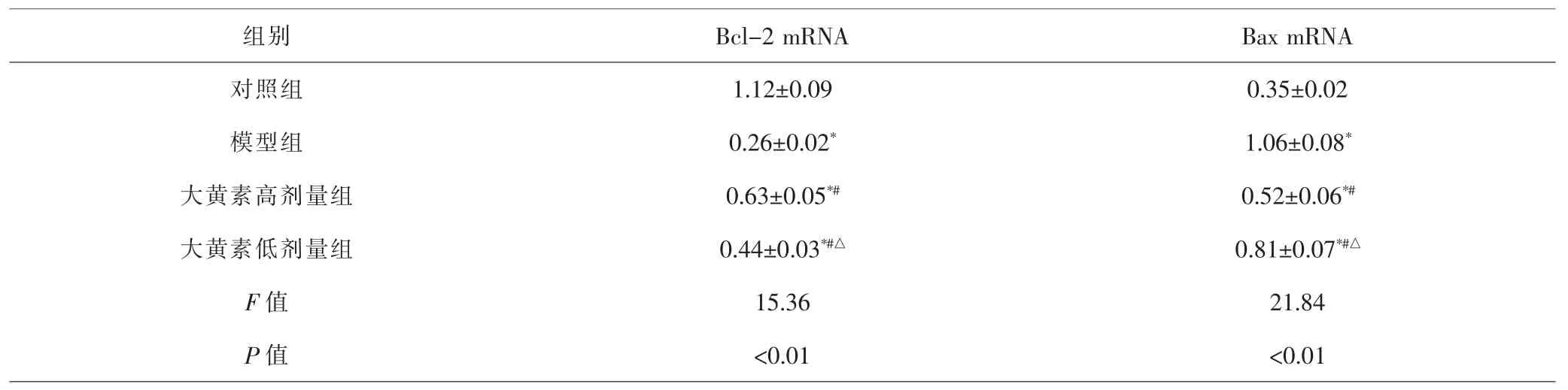
表5 各组大鼠肺组织Bcl-2、Bax mRNA表达水平比较(±s,n=3)Tab.5 Comparison of Bcl-2 and Bax mRNA expression levels in lung tissues in each group (±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与大黄素高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with emodin high-dose group,△P<0.05
组别 Bcl-2 mRNA Bax mRNA对照组 1.12±0.09 0.35±0.02模型组 0.26±0.02* 1.06±0.08*大黄素高剂量组 0.63±0.05*# 0.52±0.06*#大黄素低剂量组 0.44±0.03*#△ 0.81±0.07*#△F值 15.36 21.84 P 值 <0.01 <0.01

图2 各组大鼠肺组织Bcl-2、Bax蛋白表达水平比较Fig.2 Comparison of Bcl-2 and Bax protein expression levels in lung tissues in each group
2.6 各组大鼠肺组织p38 MAPK、ERK1/2、JNK蛋白磷酸化水平比较 各组间总体比较,肺组织蛋白pp38MAPK/p38MAPK、p-ERK1/2/ERK1/2、p-JNK/JNK比值差异有统计学意义(P<0.01)。进一步比较显示,与对照组比较,模型组、大黄素高、低剂量组大鼠肺组织蛋白p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2、p-JNK/JNK比值升高,差异均有统计学意义(P<0.05);与模型组比较,大黄素高、低剂量组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2、p-JNK/JNK比值降低,差异均有统计学意义(P<0.05);与大黄素高剂量组比较,大黄素低剂量组p-p38 MAPK/p38 MAPK、p-ERK1/2/ERK1/2、p-JNK/JNK比值升高,差异有统计学意义(P<0.05)。见图3。
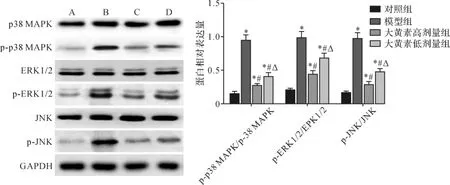
图3 各组大鼠肺组织p38 MAPK、ERK1/2、JNK蛋白磷酸化水平比较Fig.3 Comparison of p38 MAPK,ERK1/2 and JNK protein phosphorylation levels in lung tissues in each group
3 讨论
AP是多种诱因导致胰酶在胰腺腺泡内激活所致的胰腺及全身炎症反应,临床表现为突发左上腹剧痛、恶心呕吐、尿和血清淀粉酶增高,其发病率逐年升高,部分患者病情较重,可发展为SAP,病死率可达15%[10]。SAP病情凶险,变化较快,引发的炎症级联反应可波及多个组织器官,其中肺脏是SAP发病过程中最易受到影响的重要脏器,SAP合并肺损伤是SAP患者死亡的主要原因[11]。研究表明,MAPK是典型的促炎信号通路,与机体的炎症反应和氧化应激损伤密切相关[12]。Wan等[13]研究证明,抑制MAPK信号通路可减轻胰腺组织损伤,改善肠道菌群失调,抑制炎症因子释放。大黄素是中药大黄的主要有效成分,研究显示大黄素治疗炎性疾病具有很好的效果,可降低AP大鼠血清TNF-α、IL-6、IL-1β的水平,增强腹膜巨噬细胞的吞噬作用,减轻胰腺损害[14]。尽管已知大黄素对AP具有治疗作用,但其对SAP合并肺损伤是否具有改善作用尚不清楚,因此本研究建立了SAP大鼠肺损伤模型,以MAPK信号通路为切入点,研究大黄素对SAP大鼠肺损伤的影响及其作用机制。
肺组织是SAP发病过程中最易受累的器官,SAP患者肺损伤主要表现为PaO2和PaO2/FiO2降低,血清脂肪酶、淀粉酶和炎症因子TNF-α、IL-6等含量升高,肺组织结构模糊,并伴有水肿和炎症浸润等现象[15-16]。本研究结果显示,与模型组比较,大黄素可显著降低大鼠肺组织W/D和PaCO2,升高PaO2和OI,作用呈剂量依赖性。HE染色显示,模型组大鼠肺泡壁明显增厚,肺间质充血、水肿,并有大量炎症细胞浸润,大黄素可显著改善大鼠肺组织肺损伤,减轻肺泡壁增厚和肺组织充血现象,减少炎症细胞浸润。ELISA结果显示,模型组血清脂肪酶、淀粉酶、TNF-α、IL-6含量均高于对照组,而大黄素可显著降低血清脂肪酶、淀粉酶、TNF-α、IL-6含量,其中大黄素低剂量组作用弱于高剂量组,差异有统计学意义。
氧化应激是肺损伤的基本病理过程,伴随大量的炎症因子释放和活性氧产生[17]。Tian等[18]研究显示,大黄素对博来霉素诱导的大鼠肺损伤具有保护作用,能够增加SOD活力,降低MDA含量,抵抗氧化应激。与上述研究结果一致,本研究也发现大黄素可提高SAP大鼠肺组织SOD活力,减少MDA含量,表明大黄素可显著抑制氧化应激反应,对SAP大鼠肺损伤具有保护作用。
Takeyama[19]认为,细胞凋亡在SAP相关发病和死亡中起重要作用,控制细胞凋亡可能是改善SAP临床疗效的有效策略。本研究发现大黄素可显著提高大鼠肺组织Bcl-2 mRNA和蛋白表达水平,降低Bax mRNA和蛋白表达水平,其中大黄素低剂量组作用弱于高剂量组,表明大黄素可调控并显著减轻SAP导致的肺组织细胞凋亡,而且作用呈现剂量依赖性。
目前,虽然SAP合并肺损伤的发病机制尚未完全阐明,但已有多项研究证明,MAPK信号通路在各种原因导致的肺损伤中发挥重要调控作用[20-21]。唐兴娟等[22]研究显示,丙泊酚通过抑制MAPK/ERK信号通路对SAP大鼠模型肺损伤具有保护作用,并能够降低炎症因子水平,减轻大鼠肺组织病变。本研究结果显示,与对照组比较,模型组肺组织p38 MAPK、ERK1/2、JNK蛋白磷酸化水平增加,而大黄素可显著降低p38 MAPK、ERK1/2、JNK蛋白磷酸化水平,其中大黄素低剂量组作用弱于高剂量组,表明大黄素可能通过抑制MAPK信号通路关键蛋白的活化而起到对SAP大鼠肺损伤的保护作用,而且作用呈现剂量依赖性。
综上所述,大黄素对SAP大鼠肺损伤具有保护作用,能够改善大鼠肺组织病理变化,抑制炎症反应和氧化应激损伤,其作用机制与抑制MAPK信号通路的活化有关。然而,抑制MAPK信号通路仅是大黄素发挥保护作用的机制之一,后续仍需大量的体内和体外实验对其作用机制加以深入探讨。

