DC-CIK联合靶向治疗肾透明细胞癌的临床意义*
史芳瑜 徐全晓 贺利民 杨 卫
1 河南省南阳市第一人民医院 473000; 2 河南省肿瘤分子生物学医学重点实验室
肾透明细胞癌(RCC)是泌尿系统中较为常见的恶性肿瘤,占肾脏原发性肿瘤的85%~90%,据中国临床肿瘤学会(CSCO)于2017年统计结果显示,我国肾癌发病率近年来呈快速递增趋势,总体发病率为3.35/10万人,其中男女比例为2∶1,75~80岁人群发病者达到高峰,为14.7/10万人,严重威胁人类的健康。RCC具有多重耐药基因,国内外大量研究表明:RCC免疫原性极强,对传统放化疗均不敏感;CSCO报告显示,RCC的术后细胞因子治疗基本不能获益,其推荐的一线治疗策略为舒尼替尼、培唑帕尼、索拉菲尼、阿昔替尼等靶向治疗药物,以代替常规的化疗方案[1],该方案虽比常规化疗更容易发挥满意效果,但其药物的副作用及耐药问题仍亟待解决。
由体外培养体内回输的树突状细胞(DCs)和细胞因子诱导的杀伤细胞(CIK)介导的细胞免疫治疗是近年来异军突起的治疗手段,其中DC负责识别抗原,激活获得性免疫系统,CIK通过发挥自身细胞毒性和分泌细胞因子杀伤肿瘤细胞,达到改善机体的免疫抑制状态,提高患者的抗肿瘤免疫反应,发挥特异性和非特异性免疫的双重抗肿瘤作用[2]。鉴于靶向药物治疗RCC存在诸多问题,本研究通过对比分析DC-CIK联合靶向治疗和仅靶向治疗对RCC患者淋巴细胞亚群影响的差异,追踪观察患者的预后及生存时间并分析其临床意义,探讨两者的协同治疗作用,为RCC的治疗提供新的方案参考。
1 资料和方法
1.1 临床资料 本研究选取2011年1月—2015年7月期间于南阳市第一人民医院肿瘤科收治的48例患者,均经过病理学确认诊断为肾透明细胞癌,并参照美国癌症联合委员会(AJCC)分期标准,筛选T3~T4分期的患者;患者年龄40~77(52.1±8.7)岁,其中男30例,女18例;单侧肾癌47例,双侧肾癌1例。依据患者自愿所选治疗方法的不同分为舒尼替尼(Sunitinib,ST)治疗组23例和DC-CIK联合舒尼替尼(DC-CIK&ST)治疗组25例。两组患者的一般资料经统计学分析无显著性差异,见表1。治疗前由患者本人或法定代理人签署知情同意书。
表1 两组患者的一般资料
1.2 排除标准 符合以下标准任一条则排除选择:(1)生物制品过敏者;(2)非原发性肾癌患者;(3)心、肝功能严重不全者;(4)合并其他重大病症者;(5)孕妇及哺乳期妇女;(6)患有免疫性疾病4周内有药物治疗者。
1.3 仪器试剂 FACS Calibur型流式细胞分析仪(美国BD公司),细胞培养箱(美国Thermo公司),倒置显微镜(日本Olympus公司),淋巴细胞分离液(天津灏洋生物制品科技公司),人血清白蛋白(奥地利Baxter AG公司),无血清培养基GT-T551(日本Takara公司),单克隆抗体、rIL-4、rGM-CSF(以色列PROSPEC公司),PHA、 INF-γ、IL-2(上海凯茂生物医药有限公司)。
1.4 治疗方法
1.4.1 靶向治疗方案:两组患者的靶向治疗均给予舒尼替尼,1次/d,50mg/次,口服,治疗4周停2周,6周为1个疗程;每个疗程结束后进行随访,主要检查肝肾功能、血常规、甲状腺功能等,借此指标评估靶向治疗的安全性;靶向治疗有效且不良反应可耐受者停药2周后继续下1个疗程,出现不可耐受的不良反应则降低舒尼替尼剂量直至给予停药医嘱,并采取相应治疗,直至不良反应显著减轻或可耐受后,再次调整用药剂量,直至恢复正常用药量;治疗过程中若出现中度及以上肝功能损伤则给予停药4周复查肝功的医嘱。每2个疗程进行影像学、外周血淋巴细胞亚群检查,借此指标评价靶向治疗的疗效,其中靶向治疗开始的第1天至出现肿瘤进展的时间标记为无进展生存期(PFS),靶向治疗开始的第1天至患者死亡的时间标记为总生存期(OS)。
1.4.2 DC-CIK治疗方案:对于DC-CIK&ST组患者给予靶向治疗的同时,进行DC-CIK的辅助治疗,靶向治疗前1d采取患者外周血单核细胞(PBMC),并记为第0天,于第5天负载抗原,采集培养7d后施以DC细胞悬液(总细胞数为约10×107个,不少于5×107个)的淋巴结区域(双侧锁骨上、双侧腋下、双侧腹股沟区)皮下注射,以后1次/3d,共5次;自第0天开始的第10天,施以CIK细胞悬液(总细胞数为约10×109个,不少于5×109个)的静脉回输,1次/2d,共4次。依照此方案每5次DC治疗加4次CIK治疗为1个疗程,每2个疗程间隔2个月,每位患者至少施以1个疗程;DC-CIK联合靶向治疗期间监测白细胞数目<3×109/L或出现肝功能损伤者给予停药4周复查肝功能的医嘱。
1.4.3 淋巴细胞亚群检测:两组患者均于治疗前及第2个疗程后1个月采取外周血2ml,混入肝素抗凝;检测前,取100μl,分别加入鼠抗人具有荧光标记的单克隆抗体20μl,闭光条件下孵育30min后,缓慢加入磷酸盐缓冲液3ml并充分洗涤,洗涤后于1 500r/min离心5min,迅速弃去离心上清液,再加入磷酸盐缓冲液1ml并充分混匀,按照美国BD公司试剂说明书操作,上机检测CD3+T、CD19+B、CD3-CD56+NK、CD3+CD56+NK-T、CD4+、CD8+、CD8+CD28+、CD8+CD28-、CD4+CD25+Treg所占百分比,记录并分析数据。
1.5 临床疗效评估 随访时间自2011年3月—2017年7月,两组患者均在完成第1个疗程后对其病情现状进行临床评估,患者可在出现异常体征和症状时随时复查并记录,治疗后3个月再次评估病情状态,之后每3~6个月复查1次,直至失访;临床疗效按实体瘤疗效评价标准(RECIST)分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和病情进展(PD),不良反应按WHO(1998)标准进行评价,分为0~Ⅳ度。

2 结果
2.1 两组患者临床疗效比较 ST组患者中,PR+SD共15例(65.2%),PD 8例(34.8%);DC-CIK&ST组患者中,PR+SD共20例(80.0%),PD 5例(20.0%),两组均无CR病例,两组的临床疗效评估不存在显著性差异(P=0.91)。
2.2 两组患者治疗前后淋巴细胞亚群比较 据表1结果可知,ST组患者中,仅CD4+CD25+Treg细胞在治疗前后出现显著性差异,治疗后显著降低,其他均未出现显著性改变,表明ST组治疗方案对患者淋巴细胞亚群的影响主要体现在对CD4+CD25+Treg细胞比率的抑制作用;DC-CIK&ST组在治疗前后对淋巴细胞亚群的影响是多方面的,CD3+T细胞、CD4+CD25+Treg细胞均出现了显著性差异,其中CD3+T细胞、CD3+CD56+NK-T细胞、CD8+CD28+细胞显著性增加,CD4+CD25+Treg细胞显著性降低;另外,两组患者治疗后淋巴细胞亚群相比也出现了显著性差异,其中DC-CIK&ST组患者的CD3+CD56+NK-T细胞较ST组患者显著增加,而CD4+CD25+Treg细胞则出现显著降低。
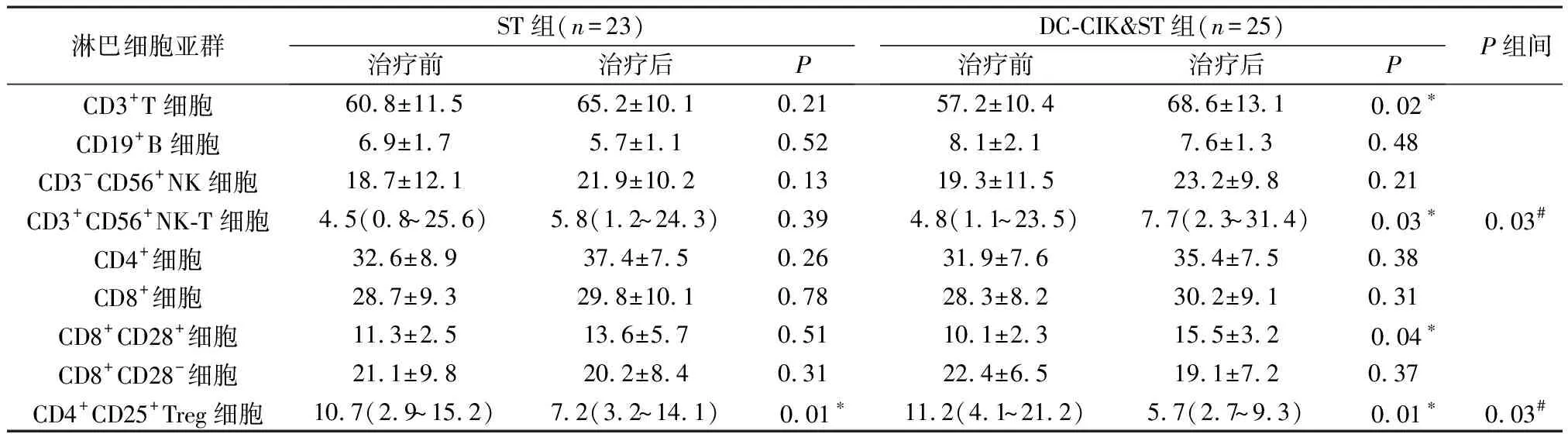
表1 两组患者治疗前后淋巴细胞亚群分析
2.3 两组患者的生存期比较及其与淋巴细胞亚群的关系 ST组患者随访时间中位为34.1个月(分布为2.5~68.2个月),截止自末次随访,本组23例患者中2例未进展,21例出现进展,该组患者的中位PFS为5.3个月(95%CI 3.2~7.3个月);另该组患者中4例患者生存,其余19例患者死亡,患者的中位OS为18.3个月(95%CI 7.5~34.1个月)。DC-CIK&ST组患者的随访时间中位为35.4个月(分布为3.2~71.4个月),截止自末次随访,本组25例患者中有2例患者未进展,其余23例出现病情进展,该组患者的中位PFS为7.8个月(95%CI 4.2~11.5个月,对比ST组患者呈显著性差异,P<0.05);另该组患者中7例患者生存,其余18例患者死亡,患者的中位OS为22.1个月(95%CI 10.5~33.7个月,对比ST组患者呈显著性差异,P<0.05)。将两组患者的生存期数据进行Kaplan-Meier分析,结果如图1所示。
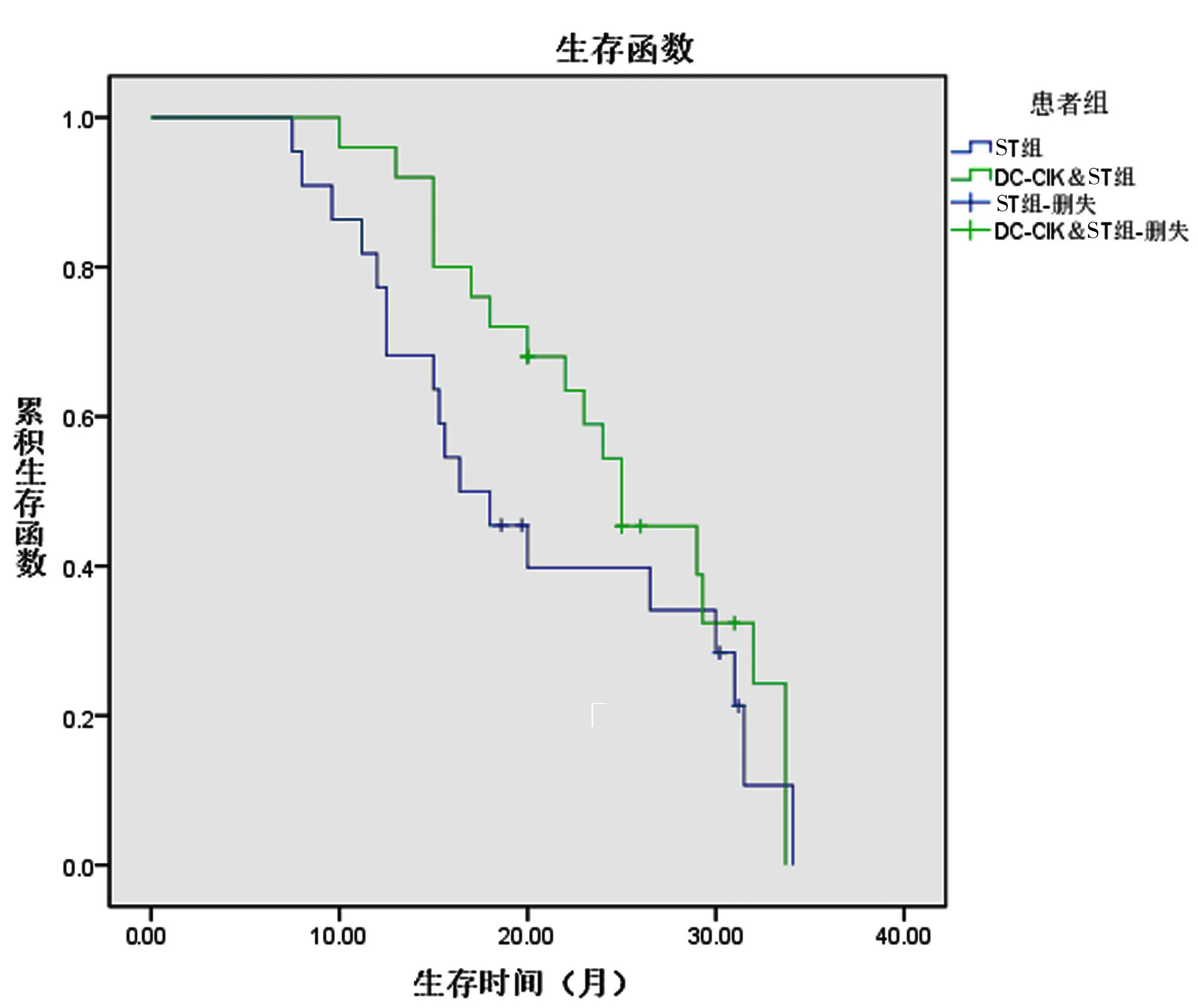
图1 两组患者的生存期比较
两组患者在接受不同治疗过程中,CD3+CD56+NK-T细胞与CD4+CD25+Treg细胞变化具有显著性差异,为探讨CD3+CD56+NK-T细胞与CD4+CD25+Treg细胞在治疗中所发生的变化与患者生存期的关系,以所有患者该两项参数的治疗前后变化值中位数为界,将所有患者分为两组,分别与患者各自的生存期数据进行Kaplan-Meier分析,结果如图2、图3所示。
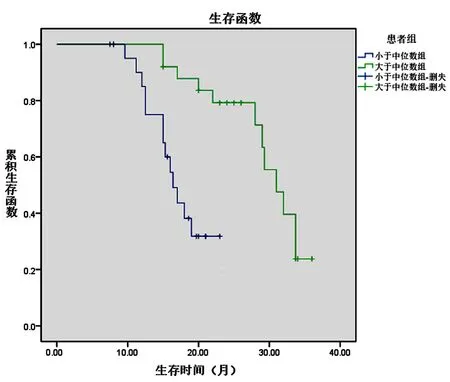
图2 CD3+CD56+NK-T细胞的变化对患者生存期影响
据图2、图3所示结果可知:在接受治疗过程中,CD3+CD56+NK-T细胞上升明显的患者,较CD3+CD56+NK-T细胞上升不明显的患者生存期显著延长,其中位生存期分别为25.7个月和11.2个月(P<0.01);而CD4+CD25+Treg细胞下降明显的患者(改变值大于中位数组),较CD4+CD25+Treg细胞下降不明显的患者(改变值小于中位数组)生存期显著延长,其中位生存期分别为26.3个月和12.8个月(P<0.01)。进一步将患者年龄、PLT、BMI、KPS评分、LDH与治疗过程中两种细胞比率的改变进行多因素COX回归分析,发现CD3+CD56+
NK-T细胞的改变仍然显著影响患者的生存时间(95%CI 1.571~5.316,P=0.009),CD4+CD25+Treg细胞的改变也同样显著影响患者的生存时间(95%CI 5.147~9.264,P=0.002)。
3 讨论
靶向药物舒尼替尼是目前药物治疗肾透明细胞癌的一线用药之一,在全世界范围内都有较高的评价,作为一种多靶向酪氨酸激酶抑制剂,它主要作用于干细胞因子受体、血管内皮细胞生长因子受体等多项受体[3-4],国内外多项临床数据表明该药具较强的抑制肿瘤增殖和抗肿瘤血管生成的作用[5-6]。与此同时,也有调查显示约有15%的肾癌患者对舒尼替尼等药物存在先天性耐药,另有一些患者在接受舒尼替尼或其他靶向药物治疗后也逐渐出现耐药和一定的病程进展[7],因而单纯靶向治疗药物也具有一定局限性。
DC-CIK免疫细胞治疗中,DC细胞以MHC限制形式呈递抗原给CIK细胞,使CTL细胞得以大量增殖,同时可激活CIK细胞的MHC限制性杀伤能力;而CIK细胞可促进DC细胞成熟并大量分泌IL-12、IL-18等因子,进一步诱导T淋巴细胞增殖成熟并主导Th1型免疫应答;二者联合培养及回输在患者体内具有更强的杀伤效应和增殖能力[8-9],而DC-CIK与靶向药物等联合应用时,对人体抗肿瘤作用会进一步提高,发挥延缓或阻止肿瘤转移、复发的作用,降低甚至一定程度避免因肿瘤免疫逃逸而诱发的靶向药物的耐药。
本研究回顾性总结了2011年1月—2015年7月期间于南阳市第一人民医院肿瘤科收治的48例肾透明细胞癌病例,比较了单纯靶向疗法和DC-CIK联合靶向疗法治疗肾透明细胞癌的差异,结果表明,联合疗法可显著提升患者生存期,显著改善患者的预后,联合疗法对患者淋巴细胞亚群的改变与其对患者生存期的影响存在相关性。
综上所述,DC-CIK联合靶向治疗的方法于临床治疗肾透明细胞癌对患者预后有较大的利好,建议临床推广扩大研究规模,深入探讨该方法对患者的作用机制,保障该方法健康有序的发展。

