RH-PBSCT治疗后细胞免疫功能表达及与急性移植物抗宿主病发生关系研究
徐建丽, 袁海龙, 王洪波, 陈 刚, 杨蕊雪, 古力巴旦木·艾则孜,玛丽娅·木哈什, 曲建华, 庞楠楠, 江 明
1.新疆医科大学第一附属医院 血液病中心,新疆 乌鲁木齐 830054;2.新疆维吾尔自治区血液病研究所,新疆 乌鲁木齐 830054
异基因造血干细胞移植选择单倍体相合的供者进行单倍体相合造血干细胞移植,以提高白血病治愈率。但治疗后移植物抗宿主病(graft versus host disease,aGVHD)发生率显著增加,多通过兔抗人胸腺免疫球蛋白(anti-thymocyte,ATG)克服人类白细胞抗原(human leucocyte antigen,HLA)不合,同时消耗体内T细胞来抑制aGVHD的进展[1]。重组人粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)动员后,外周血干细胞移植中aGVHD发生率降低,该机制主要为G-CSF可从骨髓动员更多的髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)到达外周而达到免疫耐受[2-3]。本研究设计并逐步完善了亲缘间HLA单倍体相合非体外去T细胞高剂量外周血造血干细胞移植(related HLA-haploidentical non T cell-depleted in vitro high dose peripheral blood hematopoietic stem cell transplantation,RH-PBSCT)模式,即输注经G-CSF动员高剂量的非体外去T细胞外周血单个核细胞,分析治疗后细胞免疫功能的变化及急性移植物抗宿主病(acute graft versus host disease,aGVHD)的发生率,以期为异基因造血干细胞移植提供更多的可能思路。现报道如下。
1 对象与方法
1.1 研究对象 选取自2012年1月至2018年12月在新疆医科大学第一附属医院进行RH-PBSCT治疗的98例白血病患者为研究对象。纳入标准:年龄<50岁;HLA配型无全相合供者(中华骨髓库无关供者和脐带血库寻找相匹配的脐带血均无或病情不能等待者),选择亲缘间的单倍体供者;移植前无活动性感染者;移植前无明显脏器损伤功能障碍者;预处理前供者体内免疫相关的各项指标(Th1及Th2型细胞因子,CD4+CD25+Treg细胞)均正常。患者年龄4~50岁,其中,年龄<40岁63例,年龄≥40岁35例;男性40例,女性58例;急性髓系白血病50例、急性淋巴细胞白血病45例,骨髓增生异常综合征3例;标危45例,高危53例。可分析MDSCs标本亲缘单倍体相合健康供者30例。本研究经医院伦理委员会审核批准。患者均知情同意。
1.2 研究方法 供者于输注干细胞前5 d开始应用G-CSF 7~10 μg/kg/d,G-CSF使用后5、6 d开始使用血细胞分离机分离外周血干细胞,故于G-CSF动员前及动员后5、6 d采集供者外周血,并于动员后5、6 d收集外周血造血干细胞。若患者移植后未发生aGVHD,在移植后30、60、90 d时检测MDSCs细胞的相对数量;若患者在移植后发生aGVHD,在发生时立即检测,治疗过程中每周动态监测至aGVHD完全控制,aGVHD完全控制或明显缓解后再检测1次。aGVHD的诊断和分级参考西雅图诊断标准[4]。
1.3 观察指标 流式细胞术检测G-CSF动员前后,移植后患者30、60、90 d的MDSCs细胞的相对数量变化。酶联免疫吸附试验法检测移植后患者30、60、90 d的Th1及Th2型细胞因子[转化生长因子β(transforming growth factor β, TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)],以及CD4+CD25+Treg细胞的变化情况。

2 结果
2.1 健康供者 G-CSF动员前、后MDSCs含量比较供者动员后MDSCs含量为(3.14%±1.01%),高于动员前的(1.66%±0.78%),差异有统计学意义(t=2.335,P<0.05)。见图1。
2.2 aGVHD发生高危因素分析
2.2.1 aGVHD发生与未发生组MDSCs含量比较 G-CSF动员后发生aGVHD55例(56.1%),中位发生时间为42 d(7~88 d)。根据aGVHD的发生情况将患者分为aGVHD发生组(n=55)与aGVHD未发生组(n=43)。移植后30、60、90 d,aGVHD发生组MDSCs含量均低于aGVHD未发生组,组间比较,差异有统计学意义(P<0.05)。见表1。
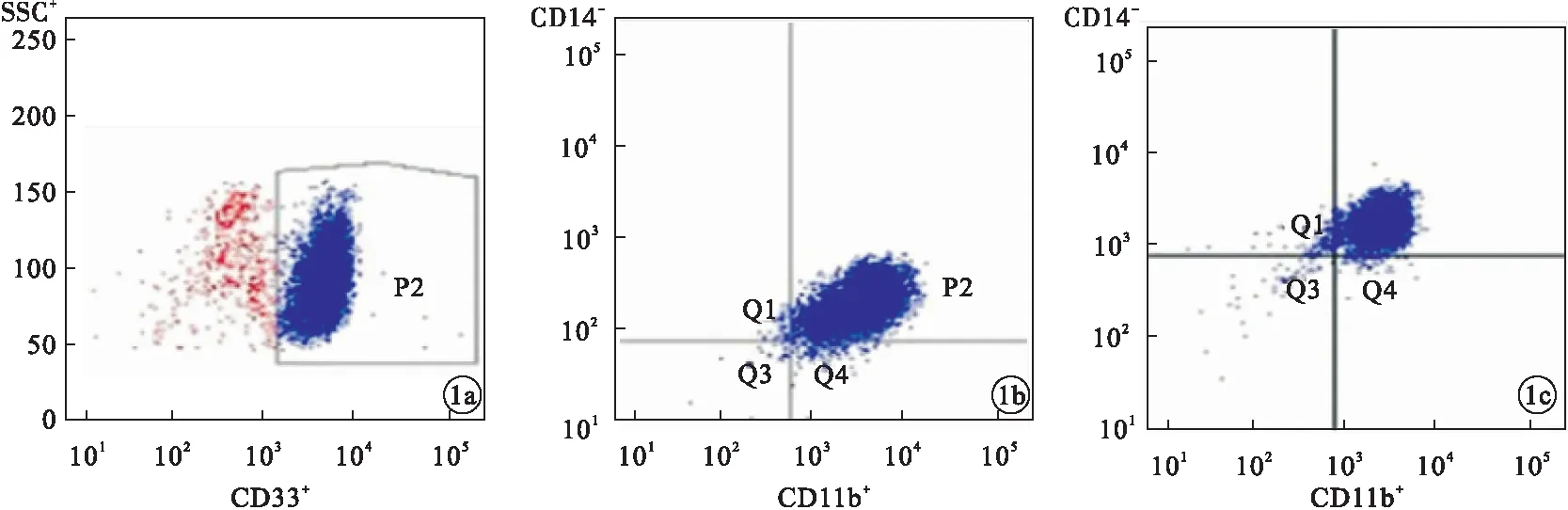
图1 MDSCs表达的流式图
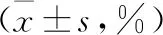
表1 aGVHD发生与未发生组MDSCs含量比较
2.2.2 aGVHD发生组病情控制前后MDSCs含量比较 移植后30、60、90 d,aGVHD发生组病情控制后的MDSCs含量均高于控制前,差异有统计学意义(P<0.05)。见表2。
2.2.3 aGVHD发生与未发生组Th1及Th2型细胞因子、CD4+CD25+Treg细胞含量比较 移植后30、60、90 d,aGVHD发生组IL-10及CD4+CD25+Treg细胞含量均低于aGVHD未发生组,差异有统计学意义(P<0.05)。两组TGF-β、TNF-α、IL-6比较,差异均无统计学意义(P>0.05)。见表3。
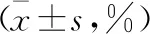
表2 aGVHD发生组病情控制前后MDSCs含量比较
2.2.4 aGVHD发生的多因素Logistic回归分析 Logistic回归分析结果显示,MDSCs、IL-10、CD4+CD25+Treg细胞含量均为aGVHD发生的独立影响因素(P<0.05)。见表4。
3 讨论
既往有研究报道,MDSCs表达与B细胞淋巴瘤[5]和血液病患者[6]的不良预后相关;但也有研究报道,MDSCs在感染性疾病[7]、自身免疫性疾病[8]中具有调节免疫系统的作用。上述研究均表明,MDSCs可显著抑制T细胞增殖。近年来,MDSCs诱导免疫耐受的机制在异基因移植中诱导移植免疫耐受、提高临床治疗效果方面提供了新思路。
本研究中,30例健康供者G-CSF动员后第5天外周血及外周血干细胞采集物中MDSCs含量高于动员前;同时,MDSCs含量在aGVHD患者中呈低表达,提示MDSCs的表达在aGVHD发生中具有重要价值;而G-CSF的刺激可提高MDSCs表达,可能对疾病的防治有一定价值。MDSCs降低aGVHD发生率的机制与抑制T细胞免疫功能有关,而该通路可通过多个途径实现[9]。T前体细胞在抗原的刺激下,可选择性分化为Th1、Th2、Th17等细胞,早期研究证实了Th1类细胞因子γ干扰素、TNF-α等促进aGVHD的发生,而Th2类细胞因子能抑制γ干扰素的分泌而减轻aGVHD[10]。Thl/Th2细胞比例与单倍体组高aGVHD发病有关,可抑制免疫反应,其主要通过分泌IL-10和TGF-β来实现,IL-10能够下调效应T淋巴细胞的增殖和分化,是对aGVHD的负性调节[11]。若对宿主组织器官予以保护,可减轻宿主组织器官炎性细胞因子的过度分泌,使移植后细胞免疫类细胞因子的产生趋于平衡,从而改善aGVHD。本研究结果还显示,移植后MDSCs含量变化与aGVHD的发生与缓解同步发生,进一步证实MDSCs直接参与了aGVHD的发生发展。
Luo等[12]采用骨髓和/或外周血移植,aGVHD累积发生率为57.4%。本研究采用RH-PBSCT模式,输注经G-CSF动员高剂量的非体外去T细胞外周血单个核细胞,结果发现,aGVHD累积发生率为56.1%,低于Luo等[12]报道结果,提示单倍体组预处理方案中加用ATG,具有较持久的T细胞清除和加快移植物的嵌合作用。本研究移植模式主要分为4个方面:一是G-CSF动员供者非体外去T细胞高剂量单个核细胞回输;二是清髓性预处理方案,2~3个位点不合者采用TBI/CY或ABU/CY+ATG,1个位点不合者不加ATG;三是aGVHD预防方案,2~3个位点不合者采用CsA/Tac+短程MTX+MMF+抗CD25单克隆抗体+GLU,1个位点不合者则不加抗CD25单克隆抗体;四是预防感染措施加强,包括细菌、真菌和病毒等感染防控力度均加强。G-CSF可通过下调CD28/B7分子表达和增加DC2 APC表达,阻断正性共刺激分子后,促进Th1细胞能更多地分化为Th2,增加的Th2细胞及其分泌的因子与诱导免疫耐受和G-CSF动员出较多的MDSCs有关。本研究结果表明,MDSCs、IL-10、CD4+CD25+Treg细胞含量为aGVHD发生的独立影响因素(P<0.05)。G-CSF动员干细胞可促使Th1向Th2转化,从而减少aGVHD的发生,并使相关免疫细胞因子呈低反应性。有研究报道,单倍体组部分患者输注了高剂量CD34+细胞,其中部分细胞能特异地杀灭识别其表面抗原的受体前体细胞毒T细胞,从而诱导免疫耐受,促进植入,减少aGVHD的发生[13]。
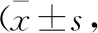
表3 aGVHD发生与未发生组Th1及Th2型细胞因子、CD4+CD25+Treg细胞含量比较浓度/pg·ml-1)
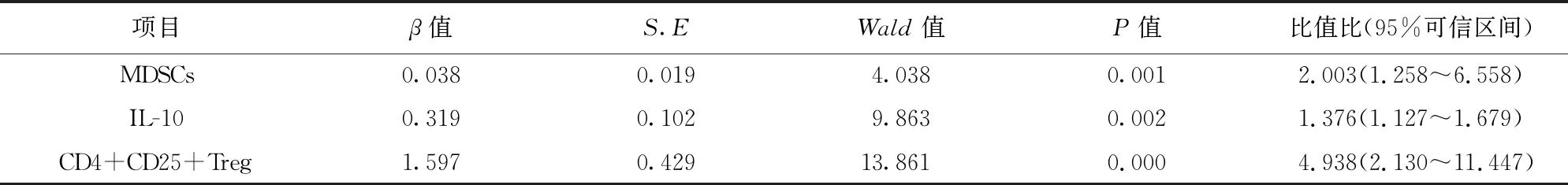
表4 aGVHD发生的多因素Logistic回归分析
综上所述,RH-PBSCT后血清免疫指标MDSCs IL-10、CD4+CD25+Treg细胞含量的降低对早期诊断aGVHD有一定的辅助价值。

