中华管鞭虾不同部位虾青素的提取及特征分析
贾喆,刘欣妍,张肖瑕,许艳,宋茹
浙江海洋大学食品与药学学院(舟山 316022)
虾青素(astaxanthin)化学名称为3,3’-二羟基-4,4’-二酮基-β,β’-胡萝卜素,是一种天然酮式类胡萝卜素。虾青素不溶于水,但能溶于大多数有机溶剂,其抗氧化性比β-胡萝卜素及叶黄素强10倍,比天然维生素E强100倍[1-2]。研究还发现虾青素有抗肿瘤、调节免疫、抗炎等作用,因此在食品、医药等领域有着广泛的应用前景[3-4]。天然虾青素在虾、蟹、藻等海洋动植物体内含量丰富,其中雨生红球藻中虾青素的含量可达到5.14%[5],海虾壳中虾青素的含量约为45.5 μg/g,相对含量约为1.29%[6]。
中华管鞭虾(Solenocera crassicornis)俗名红虾,是一年生底栖甲壳动物,外壳较薄并且光滑,呈粉红色,广泛分布于我国南海、黄海及印度尼西亚、日本、印度等海域[7]。中华管鞭虾味甜鲜美、营养丰富,是我国重要的海捕虾之一。水产加工中虾下脚料利用率较低,目前基本的处理方法是加工成附加值不高的水产饲料。而虾加工的副产物,如虾壳和虾头,含有大量虾青素,从中回收虾青素并加以利用,不仅可以给企业提高经济效益,也提高了虾下脚料的综合利用率。研究以中华管鞭虾为原料,采用水浴振荡和超声辅助提取2种方法提取虾青素,分析比较中华管鞭虾不同部位虾青素的总量,研究提取次数对虾青素提取效果影响,并分析不同部位游离型和酯型虾青素相对含量,旨在为中华管鞭虾的虾青素综合提取利用及生物活性研究奠定理论基础。
1 材料与方法
1.1 主要试验材料
中华管鞭虾,购于舟山市定海区华润万家超市;无水乙醇(分析纯),购于上海国药集团;色谱纯二氯甲烷、甲醇、乙腈,购于上海阿拉丁生化科技股份有限公司;虾青素标准品(纯度>99%)。
1.2 主要仪器与设备
UV-5900型紫外可见分光光度计,上海源喜仪器有限公司;SB-120DTN超声清洗机,宁波鑫志生物科技有限公司;SSW-600-2S型电热恒温水槽,上海博讯实业有限公司医疗设备厂;Agilent 1260 Infinity高效液相色谱仪,德国安捷伦科技有限公司。
1.3 试验方法
1.3.1 虾青素的提取
冷冻的中华管鞭虾在室温下自然解冻,手工分离虾膏、虾壳和虾肉,将虾膏并和,虾壳、虾肉各自打碎,然后分别按照1∶5(g/mL)比例在虾膏、虾壳和虾肉中加入无水乙醇,分别采用水浴振荡和超声辅助提取法提取1 h(水浴温度和超声水浴温度均为37 ℃),6 000g离心2 min,收集上清液,定容到10 mL刻度试管中,分别收集离心后沉淀,按照上述相同方法进行2次和3次提取。
1.3.2 不同部位虾青素的特征波长分析
取水浴振荡和超声辅助提取的虾膏、虾壳和虾肉的虾青素提取物(1提)各1 mL,0.22 μm滤膜过滤,在190~790 nm进行紫外可见光谱扫描。
1.3.3 总虾青素含量的测定
避光条件下用无水乙醇制备100 μg/mL的虾青素标准液,分别稀释成1.0,2.0,4.0,6.0,8.0,10.0,16.0和32.0 μg/mL虾青素应用液,过0.22 μm滤膜,以无水乙醇为调零管,测定477 nm吸光度,以虾青素浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制虾青素标准曲线(见图1)。
测定虾膏、虾壳和虾肉提取液在477 nm下吸光度,根据图1标准曲线计算提取液的虾青素浓度(μg/mL),根据公式(1)计算虾青素含量。

式中:c为提取液中虾青素质量浓度,μg/mL;V为提取液体积,mL;m为样品质量,g。
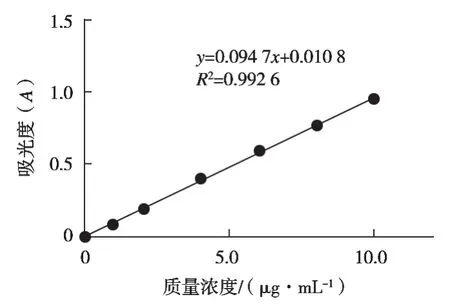
图1 虾青素标准曲线
1.3.4 游离型和酯型虾青素分析
参考Yuan等[8]方法,具体如下:采用C18色谱柱,柱温25 ℃,流动相A为V(二氯甲烷)∶V(甲醇)∶V(乙腈)∶V(水)=5∶85∶5.5∶4.5,流动相B为V(二氯甲烷)∶V(甲醇)∶V(乙腈)∶V(水)=22∶28∶45.5∶4.5。进样量10 μL,0~10 min用100% 流动相A洗脱,10~20 min用0%~100%流动相B线性洗脱,20~35 min用100%流动相B洗脱,35~45 min用100%~0%流动相B线性洗脱,流速1.0 mL/min,检测波长477 nm。
1.4 数据统计分析
试验结果用“平均值±标准差”(n=3)表示,用Origin 2018软件绘制图形,SPSS 19.0软件进行组间显著性差异分析(p<0.05)。
2 结果与讨论
2.1 中华管鞭虾不同部位虾青素提取液的紫外可见光谱比较
虾膏、虾壳和虾肉经37 ℃水浴振荡和37 ℃超声辅助法提取后的紫外可见扫描图谱如图2所示。
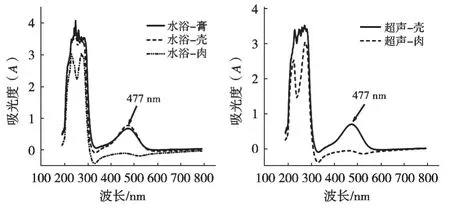
图2 中华管鞭虾不同部位虾青素提取物的紫外可见扫描图谱比较
图2结果显示:中华管鞭虾的虾膏和虾壳提取液在200~300 nm和450~550 nm 2个区域有吸收峰,而虾肉提取液仅在200~300 nm有吸收峰。试验采用湿基物料提取(虾膏、虾壳和虾肉的含水量达到70%以上),所以不可避免有大量水溶性蛋白质、肽或氨基酸被提取出来,其中芳香族氨基酸苯丙氨酸、色氨酸、酪氨酸在280 nm附近有吸收。因此,图2中提取物在紫外区的吸收应与芳香族氨基酸或富含该类氨基酸的肽和蛋白质溶出有关。超声处理有细胞破壁作用[9],虾膏本身已为软化状态,所以试验主要考察了虾壳和虾肉经超声辅助提取后虾青素提取效果。图2结果显示水浴振荡提取的虾膏和虾壳提取液在477 nm下有特征吸收,同理超声辅助提取的虾壳提取液也在477 nm有特征吸收,与许培雅等[10]报道的虾青素最大吸收波长477 nm一致。
2.2 提取次数对中华管鞭虾不同部位虾青素总量影响
考察了水浴振荡和超声辅助提取次数对不同部位虾青素的提取效果影响,结果见图3。
无论是水浴振荡还是超声辅助提取,中华管鞭虾的虾肉中均未检出虾青素,可能与提取液中虾青素含量低于检出限,或者本身含量就低的虾青素发生降解有关。经过水浴振荡提取3次,虾膏和虾壳提取液中虾青素质量浓度分别降至0.76±0.07 μg/mL和1.18± 0.11 μg/mL,显著低于提取2次时的虾青素浓度(p< 0.05)。在水浴振荡提取2次和3次时,虾膏和虾壳的虾青素累积含量无显著性差异(p>0.05),表明水浴振荡提取3次后虾膏和虾壳中的虾青素已经基本提取完全。同样,超声辅助提取次数对提取液中虾青素浓度有显著影响(p<0.05),但是虾青素累积含量在超声辅助提取2次和提取3次时无显著性差异(p>0.05),也说明超声辅助提取3次后虾壳中虾青素也基本提取完全。
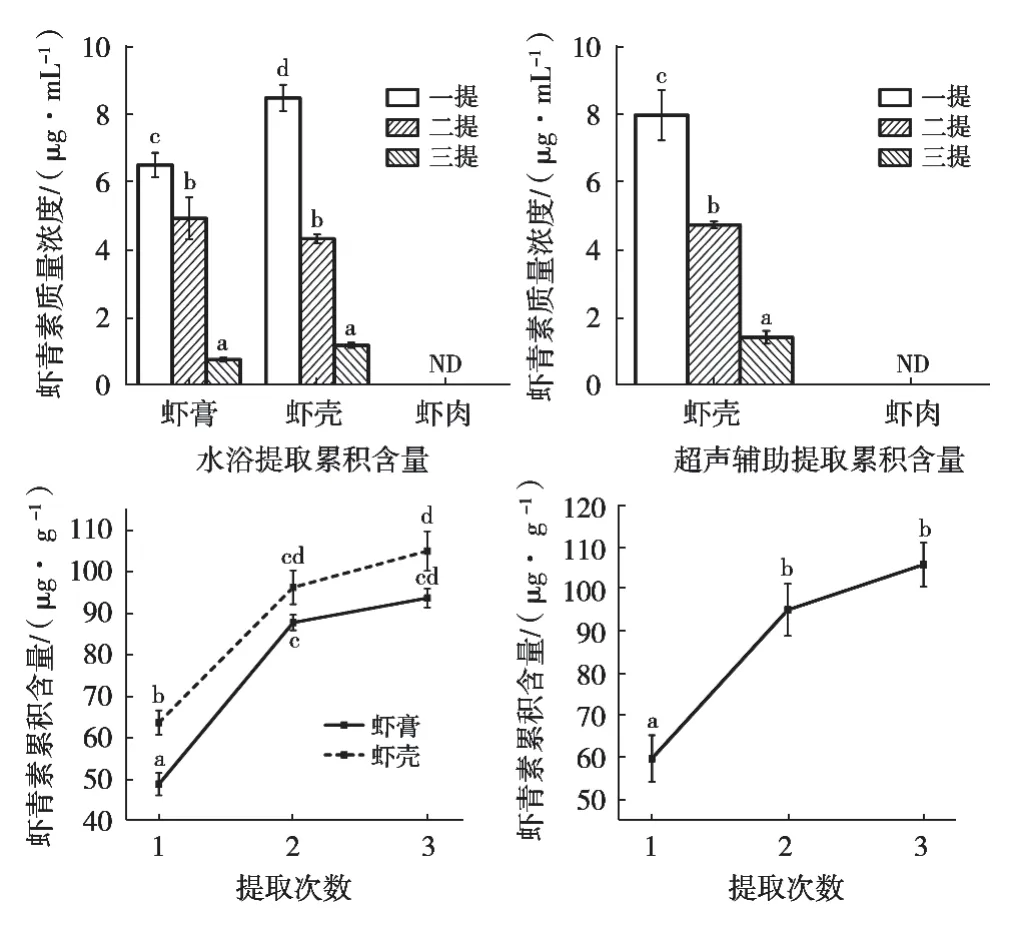
图3 水浴振荡及超声辅助提取次数对中华管鞭虾不同部位虾青素提取效果
进一步比较了水浴振荡和超声辅助提取法对虾壳虾青素提取率影响,结果见图4。
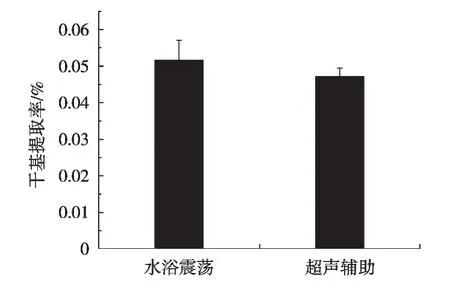
图4 水浴振荡和超声辅助法提取虾壳虾青素提取率比较
水浴振荡和超声辅助提取的虾壳虾青素的提取率(干基计)在0.05%左右,虽然2种提取方法的虾青素提取率在统计学上无显著性差异(p>0.05),但是也能看出超声辅助法的虾青素提取率低于水浴振荡法。虾青素属于萜烯类化合物,含有多个共轭双键,对光、温度、氧等因素较为敏感[11]。张丽瑶等[12]曾报道虾青素经过超声处理会发生大幅度降解,引起不同异构体之间的转化,且降解和转化与超声功率、处理时间呈正相关性。研究中超声辅助提取的虾青素是否发生异构体转化还有待于后续进一步研究。
2.3 中华管鞭虾不同部位游离型和酯型虾青素的相对含量比较
天然虾青素主要以游离型和酯型2种形式存在,自然界中游离虾青素含量较少,酯型虾青素根据虾青素分子中的羟基与脂肪酸反应又可以分为虾青素单酯和虾青素双酯。游离型和酯型虾青素在477 nm附近均有特征吸收。但是,不同原料游离型和酯型虾青素的相对含量和比例不同[13]。水浴振荡法提取的中华管鞭虾的虾膏、虾壳游离型和酯型虾青素分析结果见图5。
虾青素酯化后疏水性增强,而双酯又强于单酯,因此HPLC采用C18柱分析检测虾青素时,依次洗脱下来游离型虾青素、虾青素单酯、虾青素双酯[14]。图5中虾青素标准品(游离型)在6.9 min处有特征吸收峰,根据洗脱时间定性可知中华管鞭虾的虾膏、虾壳提取液均含有游离型虾青素。虾肉中的游离型虾青素低于最低检测限(结果未列出)。结合文献[8]研究结果,推测图5中洗脱时间10 min左右出现的分离峰(箭头所示)应该是游离虾青素的顺反式异构体,而22~45 min的分离峰应该是酯型虾青素。
通过对图5虾膏和虾壳的虾青素分离峰进行积分,比较了游离型和酯型虾青素在中华管鞭虾的虾膏和虾壳中相对含量,其中游离型与酯型虾青素在虾膏中相对含量分别为27.70%±0.38%和72.30%± 0.35%,在虾壳中相对含量分别为30.00%±0.75%和70.00%±0.75%,虾膏和虾壳游离型与酯型虾青素比分别为2.8∶7.2和3∶7。由此可见,中华管鞭虾的虾青素以酯型虾青素为主,且虾膏中的相对含量稍高于虾壳,但是虾膏和虾壳中酯型虾青素具体组成是否有差别还有待于进一步研究。
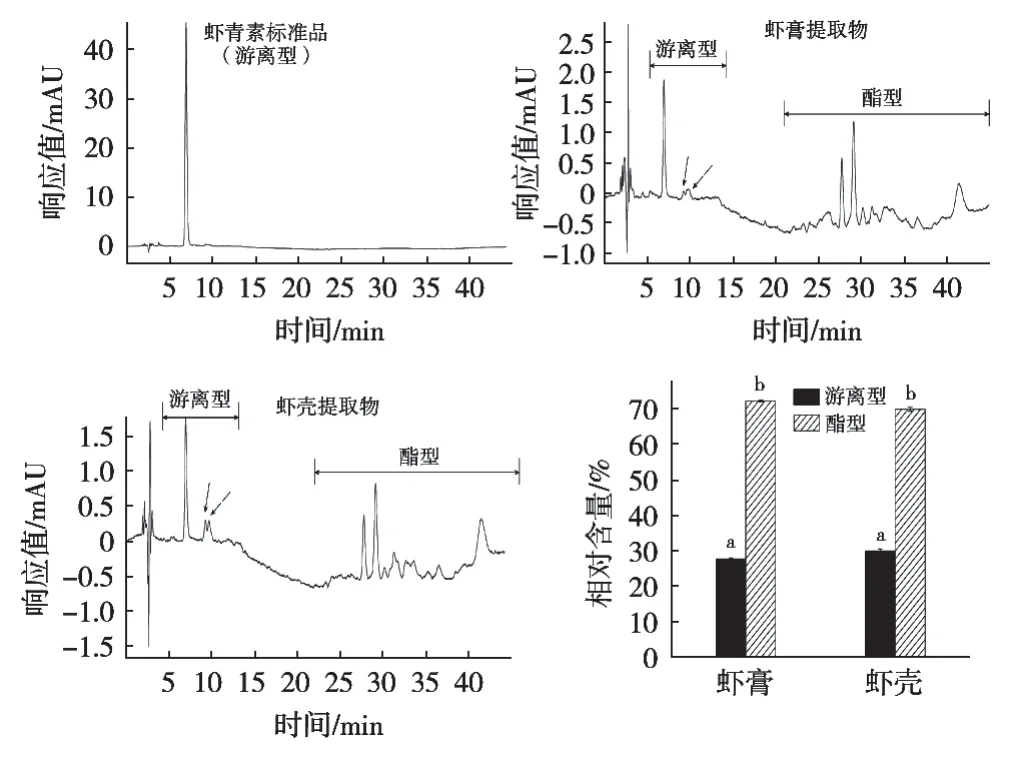
图5 中华管鞭虾不同部位游离型和酯型虾青素高效液相分离图
3 结论
不同部位提取的中华管鞭虾的虾青素在477 nm有特征吸收,虾青素主要集中在虾膏和虾壳中,水浴振荡法提取的虾青素总量略高于超声辅助提取法。虾膏、虾壳中虾青素均以游离型与酯型状态存在,且以酯型为主,虾膏和虾壳的游离型、酯型虾青素比值分别为2.8∶7.2和3∶7。

