阿帕替尼联合DC-CIK 细胞治疗原发性肝癌的临床疗效及患者细胞免疫功能的变化
时牛,宋洁,崔天庆,云宇婷,石秀换,郭瑞芳
1 内蒙古自治区人民医院消化内科,呼和浩特010010;2 内蒙古医科大学附属医院肿瘤内科;3 内蒙古自治区人民医院临床营养中心
原发性肝癌常起病隐匿,患者大多就诊时已是中晚期,此时已不适合手术治疗或者手术疗效难以达到预期[1-3]。阿帕替尼为一种抑制血管生成的小分子口服靶向药物,临床报道其治疗胃癌、肺癌等患者疗效显著[4-9]。杀伤性细胞群体(DC-CIK)治疗属于一种生物细胞治疗方式,可通过在人体外培养诱导的树突状细胞(DC)与体内诱导杀伤细胞(CIK)的协同作用产生DC-CIK,从而发挥特异性杀伤肿瘤细胞的治疗作用,具有疗效好且安全的优势[10-11]。有研究发现,阿帕替尼联合多种治疗手段包括生物免疫治疗可提高肝癌患者的远期生存率[12]。故本研究选取60 例原发性肝癌阿采用帕替尼联合DC-CIK 细胞治疗,观察其临床疗效以及患者免疫功能的变化。
1 资料与方法
1.1 临床资料 选取2015 年1 月—2018 年1 月内蒙古自治区人民医院确诊收治的原发性肝癌患者120 例,男59 例、女61 例,年龄34~70 年龄(43.4 ±23.2)岁,均符合2017 年版《原发性肝癌诊疗规范》[13]中原发性肝癌的诊断标准。纳入标准:①中晚期原发性肝癌;②首次用药前2 周内未使用过免疫抑制剂类和激素类药物;③预计生存期≥3 个月;④无手术治疗指征或者拒绝接受手术治疗者。排除标准:①有远处转移病灶;②心、肺、脑等具有严重的功能障碍者;③经临床评估后认为不适合参与本研究患者。120 例随机分为对照组和观察组各60 例,两组性别、年龄、症状体征、病理分期分级等比较差异均无统计学意义(P均>0.05)。本研究经医院伦理委员会批准同意实施,患者均签署知情同意书。
1.2 治疗方法
1.2.1 DC-CIK 细胞培养 采集患者外周静脉血50 mL,经密度梯度离心法分离取得外周血单个核细胞层;经淋巴细胞分离液取得淋巴细胞,在37 ℃、5%CO2的培养箱中细胞贴壁生长120 min。分离细胞,将悬浮液吸入进75 cm2培养瓶1640 培养液中进行CIK细胞培养,贴壁细胞加入DC细胞培养液进行DC 细胞培养。其中CIK 培养瓶中加入干扰素-γ,之后加混合细胞因子(50 ng/mL MAbCD3、100 U/mL IL-1a、1 000 U/mL IFN-γ)诱导,扩瓶培养后收集。DC 培养瓶中加入含半量细胞因子(1 000 U/mL IL-4和50 U/mL GM-CSF)的培养基诱导DC 细胞,扩瓶培养后收集。在第7 天将收集的DC 细胞和CIK 细胞按照1∶10 比例加入新的培养瓶中,混合培养6~7 d,得到DC-CIK 细胞。取少量DC-CIK 细胞进行细胞鉴定,无菌检测合格后可进行回输。
1.2.2 治疗方案 对照组应用甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司)500 mg,每天1次,餐后0.5 h温水送服,28 d为1个疗程,共3个疗程。观察组应用甲磺酸阿帕替尼片与对照组相同,同时联合接受DC-CIK 生物细胞治疗。每周回输细胞2~3次,每次回输CD 细胞(1~10)×109个、CIK 细胞(1~100)×1010个,28 d为1个疗程,连续治疗3个疗程。
1.3 疗效判定及免疫功能检测 参照Recist1.1 实体瘤疗效评价标准,3 个疗程治疗结束后评估两组疗效。完全缓解(CR)为所有靶病灶肿块均完全消失,且无新的靶病灶;部分缓解(PR)为所有肿块的总面积之和较基线相比下降30%以上;稳定(SD)为介于PR 和疾病进展(PD)之间;PD 为所有肿块的总面积之和较最小总面积时增多20%以上,或有新的靶病灶;无法评估(NE)是指因影像不清晰等原因而无法进行疗效评定。总缓解率(ORR)为(CR+PR)/总例数×100%,疾病控制率(DCR)为(CR+PR+SD)/总例数×100%。采集两组治疗前、治疗3 个疗程静脉血,采用血液生化仪检测肝脏功能指标如天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)以及甲胎蛋白(AFP),采用流式细胞仪检测外周血中CD3+、CD4+、CD8+细胞构成以及CD4+/CD8+。
1.4 统计学方法 应用SPSS 25.0软件进行数据处理和分析。符合正态分布的计量资料以±s表示,组间比较采用t检验;计数资料以例数或百分比表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效 经3 个疗程治疗,两组均无死亡患者。对照组CR 、PR、SD、PD 分别为6、8、23、23 例,ORR 为23.3%,DCR 为61.7%;观察组CR 、PR、SD、PD 分 别 为11、18、20、11 例,ORR 为48.3%,DCR 为81.7%。两组ORR、DCR 比较差异均有统计学意义(P均<0.05)。
2.2 两组治疗前后肝功能及AFP 水平变化 两组治疗3个疗程与本组治疗前比较,血液ALT、AST、AFP水平降低、ALB水平升高(P均<0.05)。治疗3个疗程两组比较,观察组血液ALT、AST、AFP水平低于对照组,ALB水平高于对照组(P均<0.05)。见表1。
表1 两组治疗前后肝功能及AFP水平比较(±s)
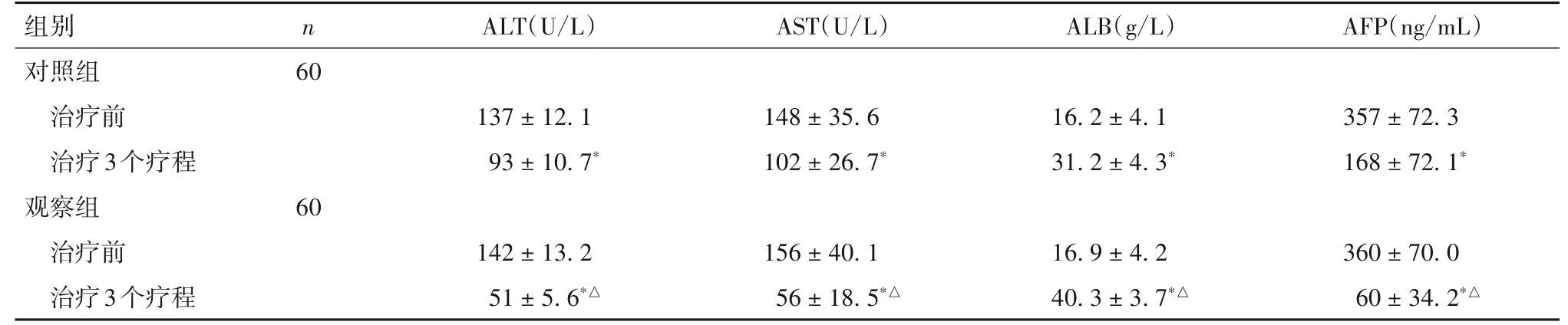
表1 两组治疗前后肝功能及AFP水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗3个疗程时比较,△P<0.05。
组别对照组治疗前治疗3个疗程观察组治疗前治疗3个疗程n ALT(U/L)AST(U/L)ALB(g/L)AFP(ng/mL)60 137±12.1 93±10.7*148±35.6 102±26.7*16.2±4.1 31.2±4.3*357±72.3 168±72.1*60 360±70.0 60±34.2*△142±13.2 51±5.6*△156±40.1 56±18.5*△16.9±4.2 40.3±3.7*△
2.3 两组治疗前后免疫功能变化 对照组治疗3个疗程与治疗前比较,外周血CD3+、CD4+、CD8+、CD4+/ CD8+各项指标差异无统计学意义(P均>0.05)。观察组治疗3 个疗程与治疗前比较,外周血CD3+、CD4+、CD8+、CD4+/CD8+各项指标差异有统计学意义(P均<0.05)。治疗3 个疗程两组比较,外周血CD3+、CD4+、CD8+、CD4+/CD8+各项指标差异有统计学意义(P均<0.05)。见表2。
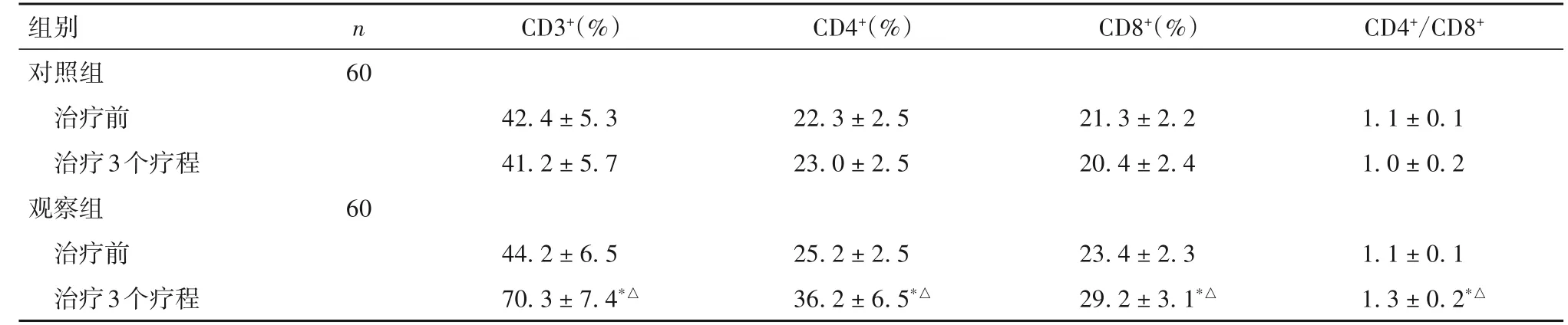
表2 两组治疗前后免疫功能指标比较(x±s)
3 讨论
原发性肝癌患者就诊时大多为中晚期,此时患者机体调节功能已发生紊乱,免疫应答启动严重受损,免疫功能明显受到抑制[14-15]。因此保守治疗选择多药联合应用或者多种方式协同治疗以提高临床疗效、增强免疫功能、减少不良反应有重要意义。
研究显示,阿帕替尼联合DC-CIK细胞疗法可从抑制血管生成和增强免疫功能两个方面协同增加抗肿瘤作用。肿瘤生长需要血管营养的供给。阿帕替尼可竞争性地抑制血管生成信号通路的重要靶点血管内皮生长因子-2 上的ATP 位点,阻断信号向下游进一步传递,减少肿瘤细胞生长过程中氧气和营养物资供给,有效抑制肝癌组织中血管恶性生长,从而实现抗肿瘤治疗的目的。DC 是体内具有识别抗原并杀伤肿瘤细胞,具有诱导生成细胞毒性T 细胞和Th 细胞的功能,属于免疫系统的启动者以及参与者。研究表明,DC 细胞通过诱导产生T 淋巴细胞,趋化T 细胞向肿瘤细胞迁移,并使T 细胞在肿瘤部位生存,进一步分泌白介素等因子,遏制血管的生长及肿瘤的增殖等,从而起到抗肿瘤作用[16]。CIK 细胞可通过分泌细胞因子以及自体毒性作用杀伤肿瘤细胞,且CIK 细胞经刺激后可使高表达CD3+、CD4+等具有免疫功能的T 淋巴细胞增加[17]。研究表明,DC-CIK 细胞有助于CIK 增殖,增强其活性,同时也可增强DC的功能。DC-CIK 细胞可充分调动免疫机制有效杀灭肿瘤细胞,抑制肿瘤生长,同时不损坏正常细胞,尤其对清除残留病灶有明显优势[18]。本研究显示,经3 个疗程治疗后,观察组ORR 和DCR 均明显高于对照组,肝功能改善程度好于对照组,且治疗后观察组外周血免疫功能各项指标均明显改善。说明阿帕替尼联合DC-CIK 细胞疗法治疗原发性肝癌患者效果优于单药阿帕替尼,其中发挥主要治疗作用的可能是DC-CIK细胞生物疗法。
综上所述,阿帕替尼联合DC-CIK细胞生物疗法可通过改善原发性肝癌患者的免疫功能起到抗肿瘤作用,且临床疗效显著。但是,本研究总体病例数少,且随访观察时间短,此研究结果的真实性尚需要临床进一步研究。

