大连市2020年度医疗器械不良事件监测数据年度统计分析
崔昊 沈贺宇 李宪刚
(1.大连市市场监管事务服务中心,辽宁大连 116021;2.大连市妇幼保健院,辽宁大连 116083;3.大连市检验检测认证技术服务中心,辽宁大连 116021)
0.引言
医疗器械不良事件监测工作自从2002年开始在全国试点以来,至今已经步入第19个年头。大连市医疗器械不良事件安全性监测工作进入第15个年头,大连市医疗器械不良事件安全性监测水平及敏感度不断提高,尤其在国家医疗器械不良事件监测信息系统使用后,工作效能大幅提升。2020年,大连市市场监管事务服务中心共收到1508份医疗器械不良事件监测报告,审核未通过报告30份,有效报告包括审核通过、待审核报告共计1478份,对1478份可疑医疗器械不良事件报告情况进行数据统计分析,为大连市医疗器械监管工作提供有力的技术支撑,为科学监管提供依据。
1.资料与方法
1.1 资料来源
“国家医疗器械不良事件监测信息系统”中按系统接收时间为2020年1月1日至2020年12月31日,按审核状态为“待审核、审核通过”进行统计,通过国家医疗器械不良事件监测信息系统审核后上报有效报告为1478份。
1.2 统计分析方法
采取描述性及对比研究方法,根据国家药品监督管理局制定的《医疗器械分类目录》,对报告中所涉及的医疗器械进行分类后,利用Excel软件透视表功能对可疑医疗器械不良事件数量、品种等进行统计分析。
2.统计结果
2.1 年度医疗器械不良事件报告总体情况
(1)年度报告总体情况。2020年,大连市市场监管事务服务中心共上报有效可疑医疗器械不良事件报告表1478份,比上一年增加7.88%,如图1所示。
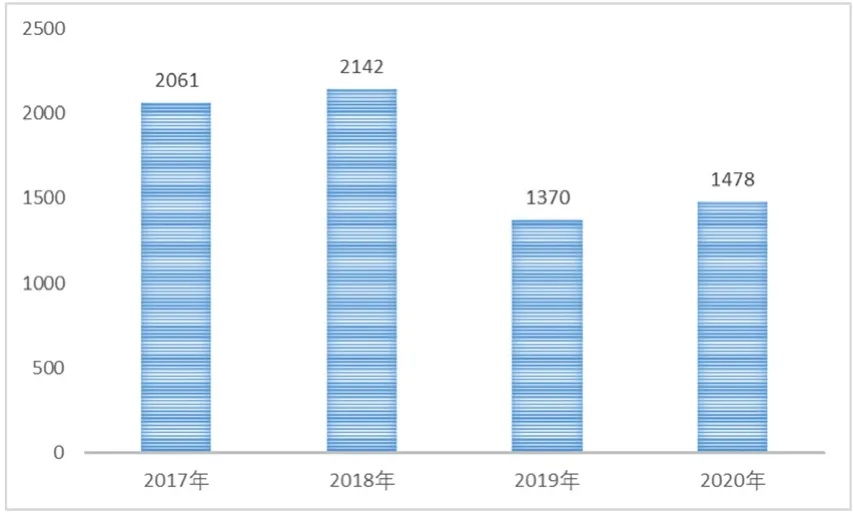
图1 2017—2020年MDAE报告数量对比柱状图
(2)每百万人口平均报告数量。2020年,大连市每百万人口平均可疑医疗器械不良事件报告数为248份,比上年增加7.83%,如图2所示。
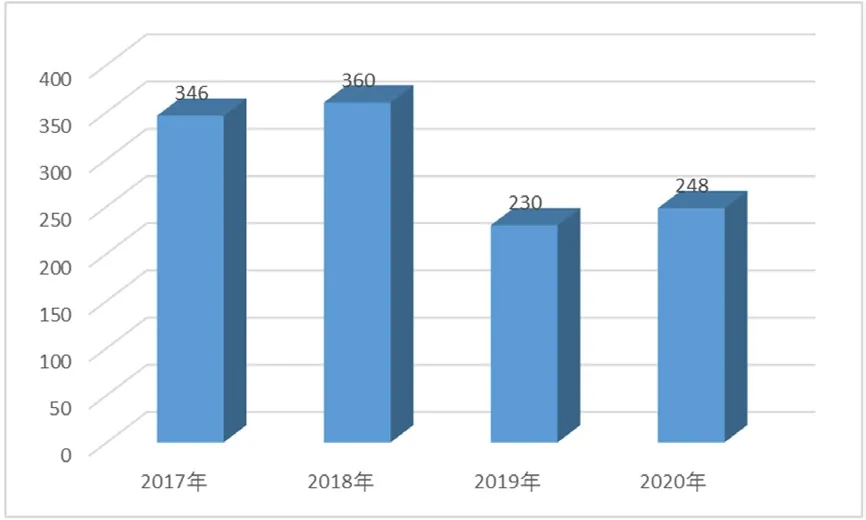
图2 2017—2020年大连市每百万人口平均可疑医疗器械不良事件报告数比较
(3)大连市注册基层用户数量。截至2020年12月31日,在国家医疗器械不良事件监测信息系统中注册的基层用户(包括注册人、经营企业和使用单位)共1983家,其中注册人178家,经营企业782家,使用单位984家,如图3所示。
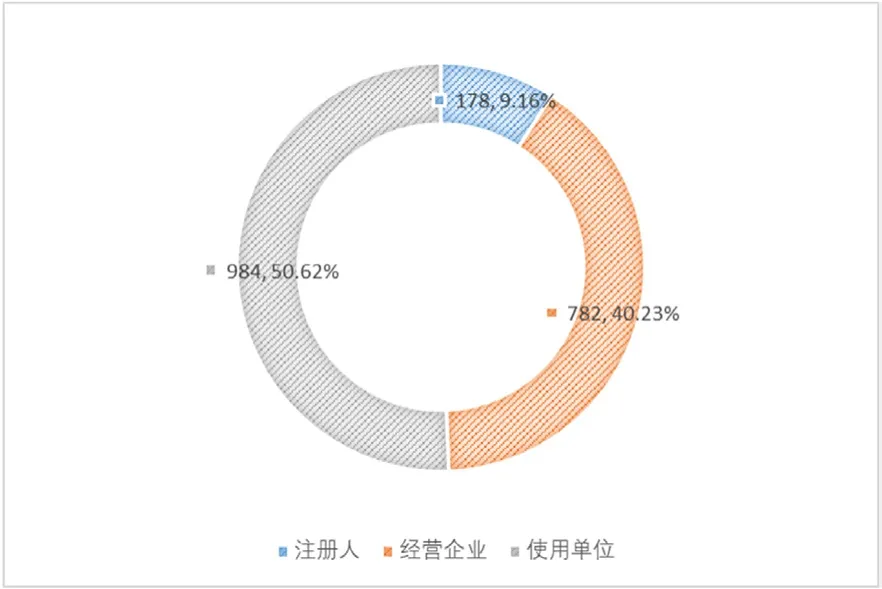
图3 2020年国家医疗器械不良事件监测信息系统注册基层用户情况
2.2 大连市医疗器械不良事件报告统计分析
(1)按报告来源统计分析。2020年,区市县监测站共上报可疑医疗器械不良事件报告1029份,占报告总数的69.62%;市管医疗机构共上报可疑医疗器械不良事件报告449份,占报告总数的30.38%。1478份报告中,经营企业上报可疑医疗器械不良事件报告323份,占报告总数的21.85%;使用单位上报可疑医疗器械不良事件报告1155份,占报告总数的78.15%,见表1,图4所示。

表1 报告来源分布情况
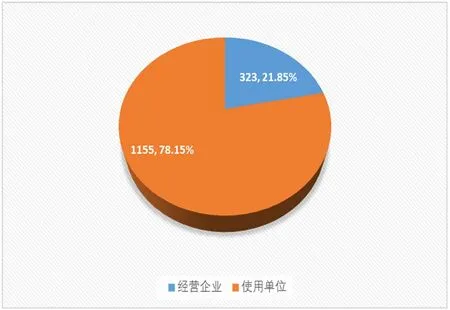
图4 2020年可疑医疗器械不良事件报告单位分布情况
(2)可疑医疗器械不良事件报告时间分布情况。在审核通过的1478份报告中,按照季度统计,报告数量从第二个季度开始显著增长,二、三季度报告数量相当,但第四季度报告数量增长幅度较大,显现出明显的不均衡性,如图5所示。
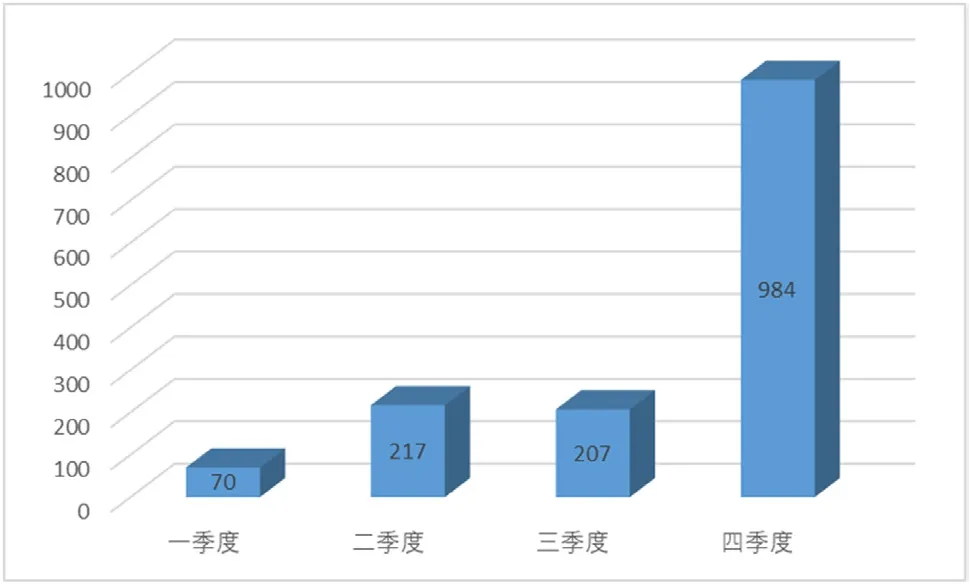
图5 2020年医疗器械不良事件季度报告情况
(3)按事件伤害程度统计分析。2020年,大连市通过国家医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,事件伤害程度为死亡的报告1份,占报告总数的0.07%;事件伤害程度为严重伤害的报告199份,占报告总数的13.46%;事件伤害程度为其他的报告1278份,占报告总数的86.47%,如图6所示。

图6 2020年可疑医疗器械不良事件报告涉及事件伤害程度情况
2020年,对于事件伤害程度为死亡的可疑医疗器械不良事件报告,大连市市场监管事务服务中心及时到现场进行事件调查处置,并形成调查报告上报相关单位。后续监测中,尚未发现该事件涉及的医疗器械风险异常增高情况。
2.3 医疗器械情况
(1)医疗器械管理类别统计情况。2020年,大连市收到的1478份报告中,涉及Ⅲ类医疗器械的报告799例,占报告总数的54.06%;Ⅱ类医疗器械报告535例,占报告总数的36.20%;Ⅰ类医疗器械报告40例,占报告总数的2.71%;管理类别不详的报告104例,占报告总数的7.04%,见表2。
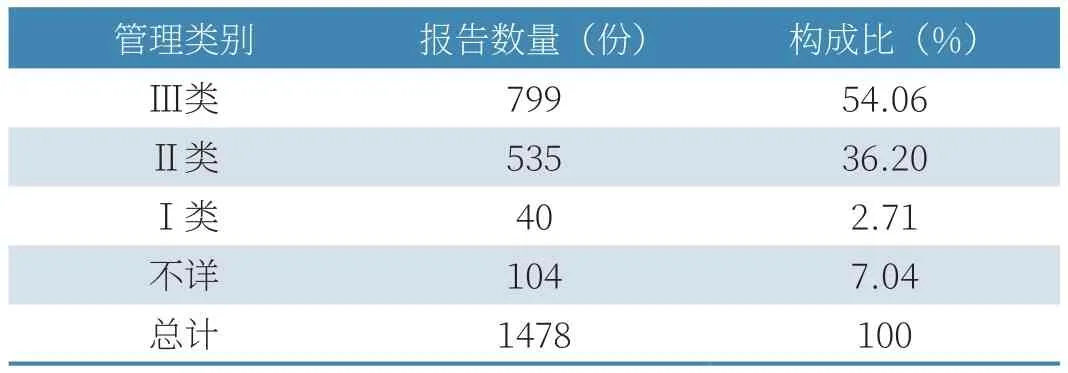
表2 2020年涉及医疗器械管理类别情况统计表
(2)按医疗器械分类目录统计。2020年,大连市收到的1478份报告中,报告数量排在前三位的医疗器械分类分别是14注输、护理和防护器械(417例)、16眼科器械(309例)、07 医用诊察和监护器械(180例)。各医疗器械类别报告数量详见表3。
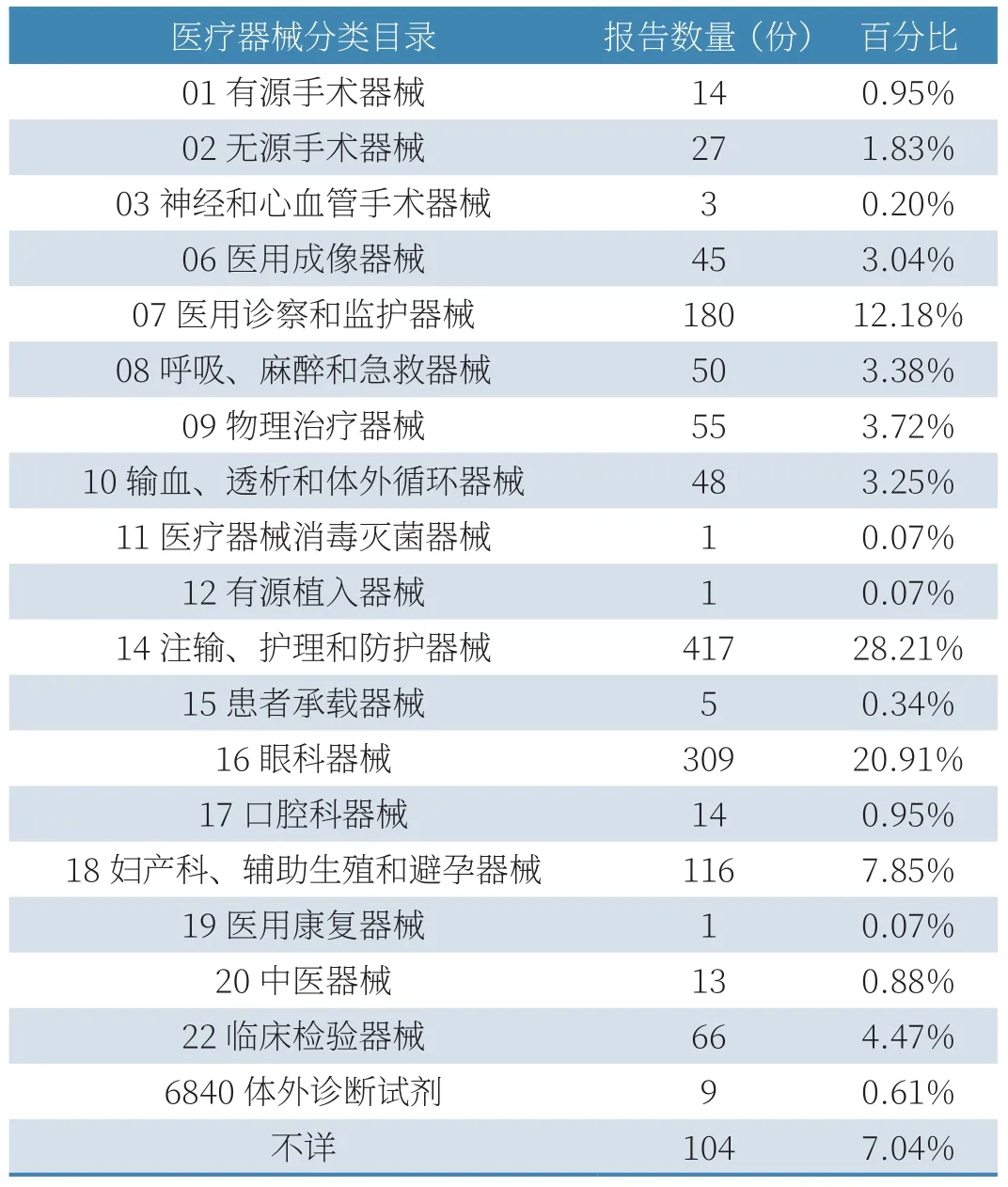
表3 2020年可疑医疗器械不良事件报告涉及医疗器械分类目录情况
(3)按医疗器械结构特征统计分析。2020年,大连市收到的1478份报告中,涉及无源医疗器械的报告982份,占报告总数的66.44%;涉及有源医疗器械的报告382份,占报告总数的25.85%;涉及体外诊断试剂的报告10份,占报告总数的0.68%;未填写医疗器械产品类别的报告104份,占报告总数的7.04%,如图7所示。
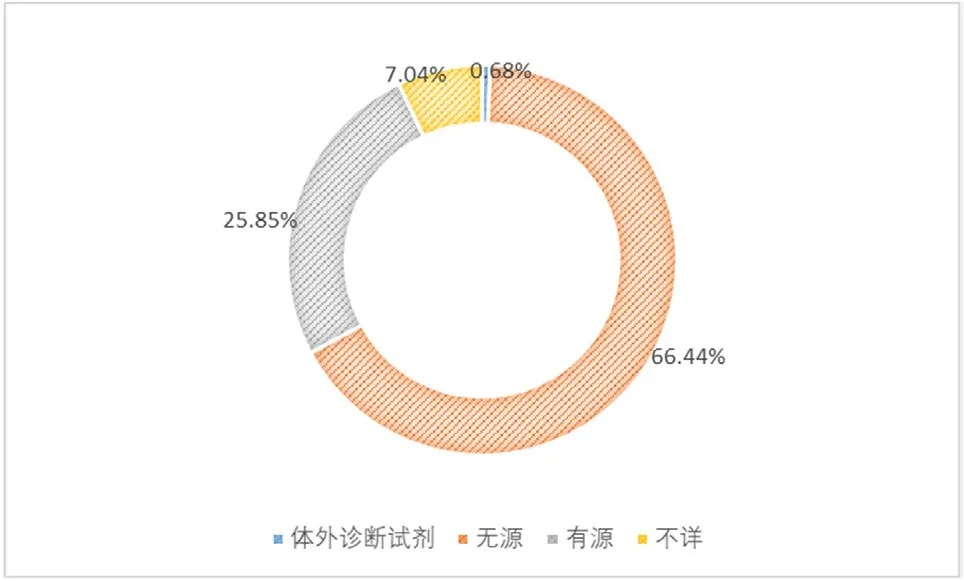
图7 2020年可疑医疗器械不良事件涉及医疗器械结构特征情况
3.讨论
3.1 聚焦风险信号抓取,不断拓展医疗器械不良事件信息收集范围
国家医疗器械不良事件监测信息系统新集成了“预警信号管理”模块,其中可以对“信号产生时间、产品信息、信号状态、等级、规则类型”等项目进行单一或联合检索,根据系统提示的风险信号预警进行分析,从而进行事件的处置。通过“预警信号管理”模块对预警条件规则的设置,可以对报告的种类、数量进行有针对性的分析预警。同时,在系统内可以浏览到全国上报的医疗器械不良事件涉及辖区内上市许可持有人与备案人的报告,可以拓展医疗器械不良事件信息收集范围。
3.2 以业务培训为抓手,持续提升医疗器械不良事件报告质量
《医疗器械不良事件监测和再评价管理办法》作为国家市场监督管理总局第1号令,于2019年1月1日开始实施。新《办法》将不良事件监测制度的法律层级从规范性的文件提升为部门规章,新《办法》中对医疗器械不良事件的概念有了重新的定义,将由于医疗器械质量导致的医疗器械不良事件也纳入到报告范围之内。针对基层应该开展有针对性的培训,应以新《办法》为准则,要求基层注重报告信息的完整性、准确性,持续提升医疗器械不良事件报告质量。
3.3 重点关注涉疫医疗器械不良事件收集,助力科学监管
疫情以来,医用口罩、隔离衣、防护服、医用手套、呼吸机等医疗器械被大量使用,为了及时发现涉疫医疗器械产品不良事件,开展涉疫医疗器械不良事件重点监测,补充被动监测模式的不足,重点关注相关产品的不良事件,为监管部门提供有针对性、科学性的依据。
3.4 加强横向交流,拓展科研合作
医疗器械的安全性和有效性直接关乎到患者的生命健康,监测机构作为技术部门,在临床认知上存在一定的局限性,而医疗机构作为报告的主渠道,可以弥补技术部门在临床上的认知盲区,加强技术机构与临床部门的横向交流,通过科研合作,将有助于医疗器械不良事件安全性监测工作的进一步提升。
4.结语
大连市于2006年设立药品不良反应监测机构,全市药械安全性监测工作在全省一直保持前列。2018年,原大连市药品不良反应监测中心经过机构改革之后合并到大连市市场监管事务服务中心,监测人员保持稳定,新部门将秉持“公众用药安全为第一责任”,在新修订的《医疗器械监督管理条例》和《医疗器械不良事件监测和再评价管理办法》施行的大背景下,加强法规学习,提升监测能力,注重风险信号发掘,切实保障人民群众用药安全。

