产右旋糖酐酶菌株的筛选、鉴定及酶学性质研究
王芳芳,田小鹏,刘雪芹,祖航天,王 藏,胡 杰,吕明生,王淑军*
(1.江苏海洋大学 海洋资源与环境重点实验室/海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222000)
右旋糖酐酶可以专一水解α-1,6糖苷键,应用于轻工业、医药等领域。在甘蔗制糖中添加右旋糖酐酶可以降低糖汁黏度,提高蔗糖质量,降低生产成本[1-2]。该酶具有清除口腔微生物产生的牙菌斑,预防龋齿的作用[3-4]。
近年来,酶法降解制备益生元-低聚寡糖具有广阔的前景。与化学和物理法相比,酶法具有反应条件温和、产物均一性好、聚合度适中、得率高、无污染、保护产物活性基团等优点[5]。功能性低聚异麦芽寡糖应用于医药、食品和养殖等方面[6]。内切右旋糖酐酶水解右旋糖酐产物主要为异麦芽寡糖。LIU X等[7]报道的右旋糖酐酶水解产物中聚合度2~7的低聚异麦芽糖的组分为91.8%,通过体外抗氧化实验表明,可以清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、超氧阴离子和羟基自由基;LIU H F等[8]报道重组菌株GH49右旋糖酐酶水解产物中低聚异麦芽糖的聚合度为3~6,具有促进鼠李糖乳杆菌、长双歧杆菌等肠道益生菌生长和抑制大肠杆菌、金黄色葡萄球菌等食源性致病菌生长的作用。
海洋生态环境具有高盐、碱性、低温等特性,海洋微生物可以产生具有新颖特性的酶。本研究从海泥中筛选产右旋糖酐酶的菌株,对其进行形态学观察、生理生化试验及分子生物学鉴定,探讨菌株生长特性和产酶条件,并采用体外实验对酶解产物的组成及抗氧化活性进行研究,目的筛选出一株产右旋糖酐酶的海洋细菌,利用其水解产物制备益生元相关产品,为制备异麦芽寡糖提供新的酶源[9]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
海泥样品:采集于连云港高公岛海域。
1.1.2 化学试剂
蓝色葡聚糖(Dextran blue 2000):美国GE Healthcare公司;微生物裂解液(Lysis Buffer for Microorganism to Direct PCR):大连Takara公司;裂解酶(TaqPCR Master Mix):BBI生命科学有限公司;通用引物(27F、1492R):北京Solarbio科技有限公司;右旋糖酐500邻苯三酚(焦性没食子酸)(分析纯):阿拉丁试剂(上海)有限公司;酵母粉(生化试剂):英国Oxoid公司;鱼粉蛋白胨、右旋糖酐20、维生素C(vitamin C,VC)、葡萄糖、麦芽糖(均为分析纯或生化试剂):国药化学试剂有限公司;琼脂(生化试剂):德国BioFroxx公司;麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖(纯度>98%):日本glycarbo公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、30%过氧化氢(分析纯):南京化学试剂有限公司。
1.1.3 培养基
筛选培养基:酵母粉0.1%,鱼粉蛋白胨0.5%,右旋糖酐20 1%,蓝色葡聚糖0.2%,琼脂2%,陈海水配制,pH 8.0。121 ℃高压蒸汽灭菌20 min。
产酶培养基:酵母粉0.1%,鱼粉蛋白胨0.5%,右旋糖酐20 1%,陈海水配制,pH 8.0。121 ℃高压蒸汽灭菌20 min。
右旋糖酐酶酶活力测定平板:0.1%蓝色葡聚糖,1.5%琼脂,0.1 mol/L乙酸-乙酸钠溶液(pH 5.5)配制。平板凝固后,直接使用。
1.2 仪器与设备
SPX-250B-Z生化培养箱:上海博远迅实业有限公司医疗设备厂;Innova 44R恒温摇床、Multiskan Go酶标仪、Multifuge X3R高速冷冻离心机:美国Thermo公司;Freezone 6 Plus冷冻干燥机:美国Labconco公司;T100TMThermal Cycler聚合酶联式反应(polymerase chain reaction,PCR)仪:美国BIO RAD公司;1200 Infinity series 高效液相色谱(high per formance liquid chromatography,HPLC)仪:美国Agilent公司。
1.3 方法
1.3.1 产右旋糖酐酶菌株的筛选与鉴定
海泥样品梯度稀释10-1至10-6,取50 μL涂布于筛选培养基,30 ℃静置培养48 h。挑选有透明圈的单菌落纯化并保藏。对菌株进行形态学观察、生理生化指标测定及分子生物学(16S rDNA)鉴定。分子生物学鉴定:提取菌株的脱氧核糖核酸(deoxyribonucleic acid,DNA),选用原核微生物通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R(5'-GGTTACCTTACGACTT-3')进行PCR扩增。PCR扩增体系为50 μL,扩增条件:94 ℃变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃终延伸5 min,4 ℃保藏。PCR产物经1%琼脂糖凝胶电泳检测后,送上海华大基因测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行相似性比较,用MEGA7.0软件进行同源性分析并通过邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.2 菌株生长特性研究
种子液的制备:菌株接种到种子液培养基,装液量20%,180 r/min、30℃培养12 h,得到种子液。接种量为2%,180 r/min培养24 h,得到菌悬液,测定其吸光度值(OD600nm值)。
分别以碳源(麦芽糖、乳糖、可溶性淀粉、米糠、葡萄糖)添加量为0.5%、氮源(大豆蛋白胨、牛肉浸膏、鱼粉蛋白胨、示蛋白胨和胰蛋白胨为有机氮源,硫酸铵和尿素为无机氮源)添加量为1%、初始pH为5.0~10.0、温度为20~40 ℃、NaCl含量为0~11%,研究以上因素对菌株生长的影响。
1.3.3 菌株产酶条件优化
装液量为20%,接种量2%,180 r/min、25 ℃培养48 h。培养液12 000 r/min离心5 min。上清为粗酶液,检测其右旋糖酐酶的活力。研究不同碳源(麸皮、大麦粉、可溶性淀粉、米糠和马铃薯淀粉)(添加量为0.1%)、不同氮源(酵母粉、豆粨、大豆蛋白胨、鱼粉蛋白胨和胰蛋白胨)(添加量为0.5%)、不同温度培养条件(25~45 ℃)和不同初始pH(5.0~9.0)对菌株发酵产酶的影响。
1.3.4 右旋糖酐酶酶活力的测定方法
采用牛津杯法[10]测定。具体如下:将牛津杯放置在测定平板上,加入100 μL粗酶液,放置恒温培养箱保温12 h,检测透明圈直径,计算相对酶活,其计算公式如下:

1.3.5 酶学性质
右旋糖酐酶的最适温度和热稳定性:将右旋糖酐酶液置于不同温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)反应12 h,测定酶活力。将酶液分别放置在20 ℃、30 ℃、40 ℃和45 ℃分别保温1 h、3 h、5 h和12 h后,计算相对酶活。
右旋糖酐酶的最适pH和pH稳定性:将右旋糖酐酶液分别放置在不同pH(乙酸-乙酸钠缓冲液5.0~6.0;磷酸盐缓冲液6.0~8.0;Tris-HCl缓冲液8.0~9.0)缓冲液配制的平板上,反应温度20 ℃,12 h后测定酶活力。将酶液分别在20 ℃,pH5.0~9.0条件下保温1 h后测定酶活,计算相对酶活。
1.3.6 高效液相色谱法检测酶解产物
酶液与3%右旋糖酐500溶液(pH 6.0,50 mmol/L磷酸盐缓冲液配制)混合,在20 ℃条件下分别反应1 h和3 h。水浴灭酶后,12 000 r/min离心5 min。上清液经3 kDa的超滤管过滤,过0.22 μm的滤膜后用于HPLC检测。
色谱条件:采用示差折光检测器Waters600和Waters Sugar-Park1分析柱(6.5×300 mm)对水解产物鉴定和分析。流动相为超纯水,流速为0.4mL/min,柱温70 ℃,进样量20 μL。标品为葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖。
1.3.7 酶解产物抗氧化活性研究
酶解产物经3 kDa超滤后用于检测。采用半抑制浓度(50%inhibiting concentration,IC50)值反映酶解产物的抗氧化活性,IC50值越小,其抗氧化活性越强。
(1)DPPH自由基(DPPH·)清除率的测定
样品组:在避光的EP管中依次加入150 μL的0.1 mmol/L DPPH溶液和不同浓度的酶解产物150 μL混匀,室温条件下反应30 min,12 000 r/min离心3 min,取200 μL的上清液检测OD517nm值。空白组:用无水乙醇代替样品组中的DPPH溶液。底物组:用150 μL的0.1 mmol/L DPPH溶液和150 μL的超纯水混匀。DPPH自由基清除率计算公式如下:
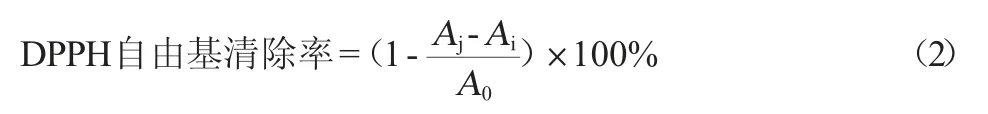
式中:Aj为样品吸光度值;Ai为空白吸光度值;A0为底物吸光度值。
(2)超氧阴离子自由基(O2-·)清除率的测定
样品组:在避光的EP管中依次加入500 μL Tris-HCl(pH 8.2,50 mmol/L)溶液和不同浓度的酶解产物溶液100 μL混匀,25 ℃温育10 min,立即加入15 μL的邻苯三酚溶液(6 mmol/L)反应30 min后,12 000 r/min离心3 min,取上清液。吸取200 μL的上清液检测OD320nm值。空白组:用稀盐酸(6 mmol/L)代替样品组中的邻苯三酚;底物组:用15 μL的邻苯三酚溶液和500 μL Tris-HCl以及100 μL超纯水混匀。超氧阴离子自由基清除率计算公式如下:
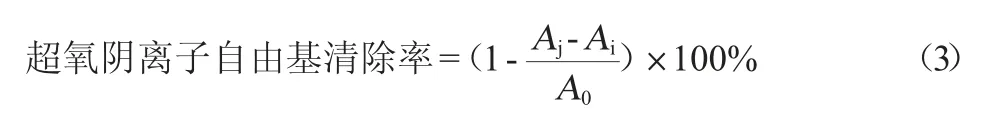
式中:Aj为样品的吸光度值;Ai为空白的吸光度值;A0为底物吸光度值。
(3)羟基自由基(·OH)清除率的测定
样品组:在避光的EP管中添加100 μL不同浓度酶解产物和100 μL 9.9 mmol/L亚硫酸铁溶液以及100 μL 9.9 mmol/L水杨酸-乙醇、100 μL 8.8 mmol/L双氧水和1.1 mL去离子水混匀,37 ℃反应15 min后,12 000 r/min离心3 min,吸取200 μL上清液检测OD510nm值。空白组:用100 μL的去离子水替换双氧水。底物组:用100 μL去离子水替代100 μL的样品溶液。羟基自由基清除率计算公式如下:
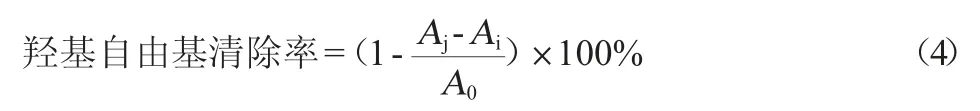
式中:Aj为样品的吸光度值;Ai为空白的吸光度值;A0为底物的吸光度值。
1.3.8 数据处理与统计分析
实验设3组平行;采用Origin 8.0软件进行绘图制作;结果均使用SPSS 26.0软件计算并进行显著性分析。
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株形态学观察
通过几轮透明圈法筛选,共获得4株产透明圈菌株,编号分别为GN01、GN02、GN03和GN04。其中菌株GN02的菌落形态及细胞形态见图1。由图1a可知,GN02菌落呈白色、圆形、不透明、表面光滑湿润、前期边缘整齐,后期成锯齿状、菌落中间有微小凸起。由图1b可知,菌株GN02为革兰氏阳性,无鞭毛,有荚膜,有芽孢的长杆菌,菌体大小为(3.00~5.75)μm×(0.8~1.0)μm。
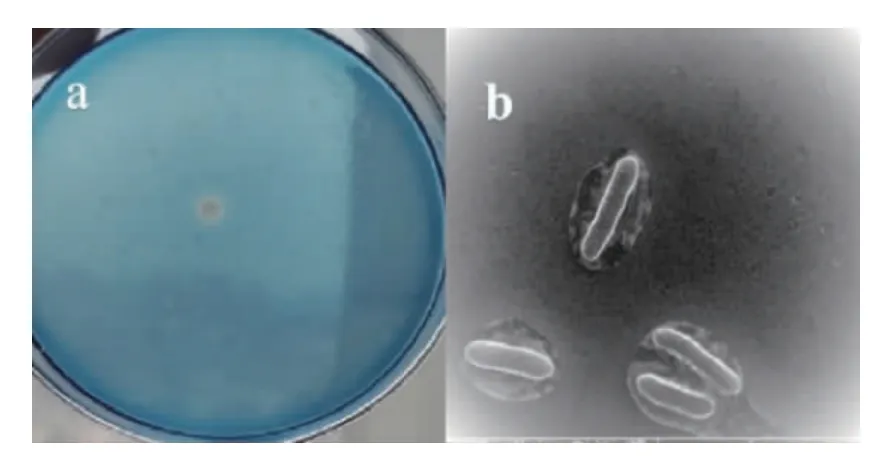
图1 菌株GN02的菌落(a)和细胞(b)形态Fig.1 Colony (a) and cell (b) morphology of strain GN02
2.1.2 生理生化试验
菌株GN02生理生化反应结果见表1。由表1可知,菌株GN02葡萄糖、果糖、阿拉伯糖、木糖、棉籽糖、甘露糖反应结果为阳性,精氨酸脱羧酶反应结果为阴性,其生理生化反应结果与芽孢杆菌属相符。

表1 菌株GN02生理生化反应结果Table 1 Results of physiological and biochemical reactions of strain GN02
2.1.3 分子生物学鉴定
以提取菌株GN02的DNA为模板,以27F、1492R为引物PCR扩增16S rDNA序列,PCR扩增产物经1%琼脂糖凝胶电泳检测,结果见图2。由图2可知,PCR扩增产物经过纯化后,送上海华大基因测序,碱基长度为1 441 bp。
图2 菌株GN02的PCR扩增产物琼脂糖凝胶电泳结果Fig.2 Agarose gel electrophoresis results of PCR amplified products of strain GN02
利用MEGA7.0软件中的NJ法构建系统发育树,结果见图3。由图3可知,菌株GN02的16S rDNA序列在NCBI上BLAST分析,与Bacillus haikouensis的同源性为97.2%。结合形态学特征和生理生化结果,鉴定菌株GN02为芽孢杆菌属(Bacillussp.)。

图3 基于16S rDNA基因序列菌株GN02的系统发育树Fig.3 Phylogenetic tree of strain GN02 based on 16S rDNA gene sequences
2.2 菌株GN02的生长特性
各因素对菌株GN02生长影响结果见图4。由图4a~图4e可知,菌株GN02适应多种碳源,其中米糠最佳;大豆蛋白胨为最适氮源;菌株GN02在初始pH 7.0条件下生长效果最佳,在碱性环境中生长较好;菌株GN02在20~40 ℃均生长良好,最适生长温度为35 ℃,该结果与LAI X H等[11]报道的海洋细菌Catenovulum agarivoransMNH15最适生长温度相似;该菌在NaCl含量1%~11%范围内都可以生长,3%为最适生长NaCl含量,在无NaCl时不生长,表明菌株GN02为耐盐海洋细菌[12]。综上,菌株GN02生长的最适碳源、氮源、初始pH、温度和NaCl含量分别为米糠、大豆蛋白胨、7.0、35 ℃和3%。
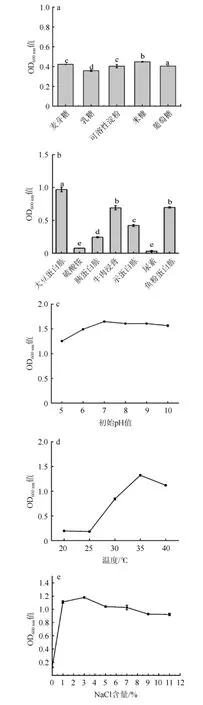
图4 各因素对菌株GN02生长的影响Fig.4 Effect of various factors on strain GN02 growth
2.3 菌株GN02的产酶条件
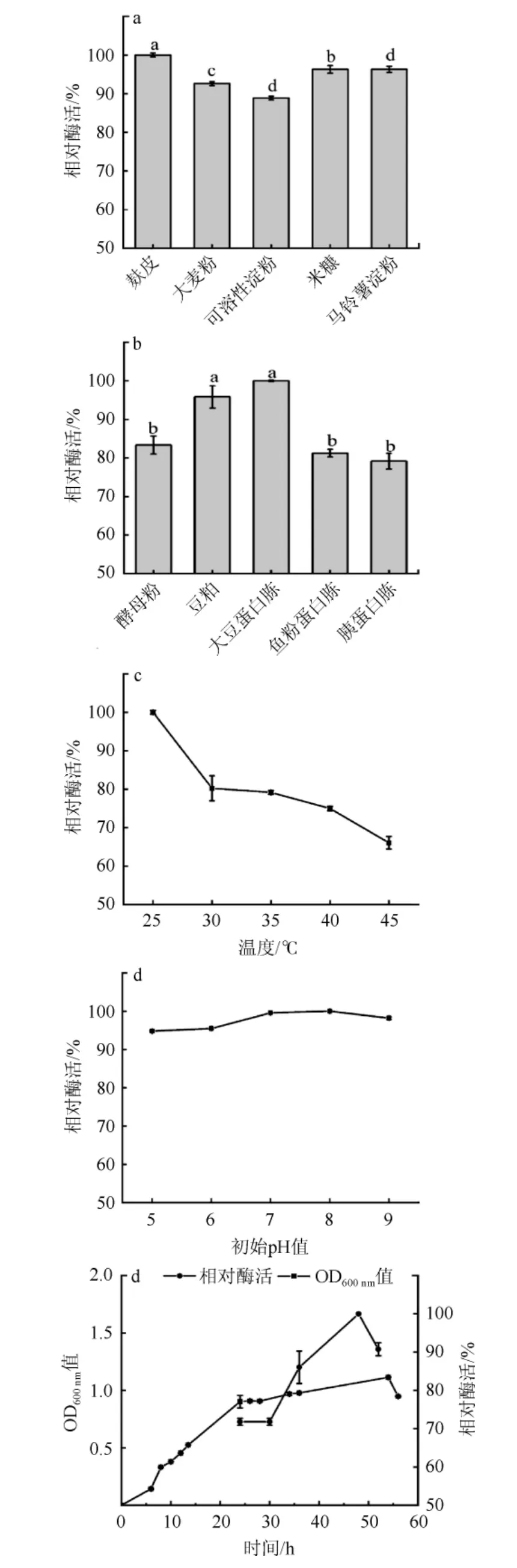
图5 各因素对菌株GN02产酶的影响Fig.5 Effect of various factors on dextranase production by strain GN02
各因素对菌株GN02产酶条件影响结果见图5。由图5a~图5e可知,菌株GN02产胞外酶,该菌株在不同碳氮源中产酶均较好,其中碳源为麸皮时产酶最高;氮源为大豆蛋白胨时产酶最高;菌株GN02在25 ℃培养条件下产酶最高,随着培养温度的升高,产酶下降;在培养基初始pH值为8.0时,菌株GN02产酶量最大;在培养30 h后产酶能力开始大幅提高,48 h时产酶达到最高。该结果与曹研研等[13]报道的真菌产酶时间相比,该菌发酵产酶周期较短。综上,菌株GN02产酶最适碳源、氮源、温度、初始pH和时间分别为麸皮、大豆蛋白胨、25 ℃、8.0和48 h。
2.4 酶学性质

图6 右旋糖酐酶酶学性质测定结果Fig.6 Determination results of enzymatic property of dextranase
由图6a可知,该酶最适作用温度为20 ℃,在15~40 ℃之间,可以保持80%以上的相对酶活。由图6b可知,在20 ℃和45 ℃保温12 h后,仍然保持90%以上和80%以上的相对酶活。由图6c可知,该酶最适pH 7.0。由图6d可知,在pH 7.0缓冲液中保存1 h后,相对酶活保持在90%以上。已报道的右旋糖酐酶最适温度多在40~60 ℃[14]。NUCHAREE J等[15-17]报道的野生菌株、突变菌株和重组菌产酶的最适作用温度分别为37 ℃、45 ℃、60 ℃。该右旋糖酐酶最适作用温度相对较低。低温酶在工业生产中可以节约能源。
2.5 HPLC检测酶水解产物
HPLC检测旋糖酐酶的水解产物,结果见图7。由图7可知,水解产物检测结果显示,主要产物为异麦芽四糖和异麦芽三糖。其中,1 h水解产物中异麦芽四糖含量为85.6%,异麦芽三糖含量为14.3%;3 h 水解产物中异麦芽四糖含量82.4%,异麦芽三糖含量为13.7%。该酶可用于制备异麦芽寡糖[18],张宇琪等[19]报道的芽孢杆菌属产右旋糖酐酶的产物以异麦芽三糖为主。王蔷等[20]报道的水解产物主要为异麦芽糖和异麦芽三糖。异麦芽寡糖具有提高免疫力、增殖肠道益生菌,保持食品感官品质和抑制食品中有害菌增长的功效[21-24]。该酶水解产物中异麦芽四糖含量高,具有较好的应用潜力。
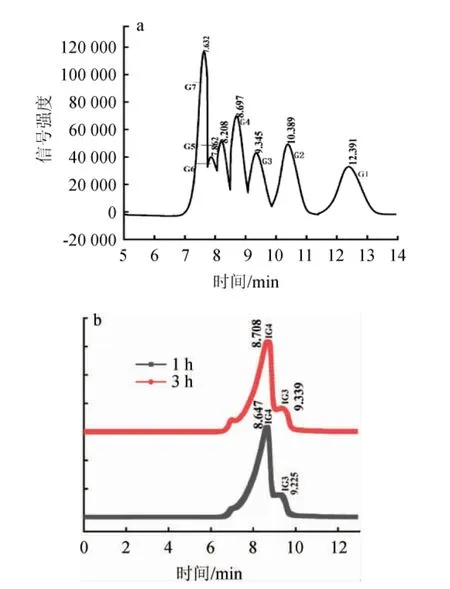
图7 糖标品(a)及酶解产物(b)的HPLC检测结果Fig.7 Determination results of sugar standards (a) and enzymatic hydrolysis product (b) by HPLC
2.6 酶解产物抗氧化活性
由图8可知,自由基清除作用随着多糖质量浓度的增加而增加。清除羟基自由基的效果最好,IC50值为0.42 mg/mL,多糖质量浓度为2.5 mg/mL时清除率为92.7%。清除DPPH的效果次之,IC50值是2.98 mg/mL,多糖质量浓度为10 mg/mL时,最大清除率为84.4%。清除超氧阴离子的IC50值为11.54 mg/mL,在20 mg/mL时的清除率为57.1%。该样品为聚合度3~4为主的低分子量多糖,分子质量小有利于多糖空间结构的舒展和与自由基的结合,提高抗氧化的能力[25]。
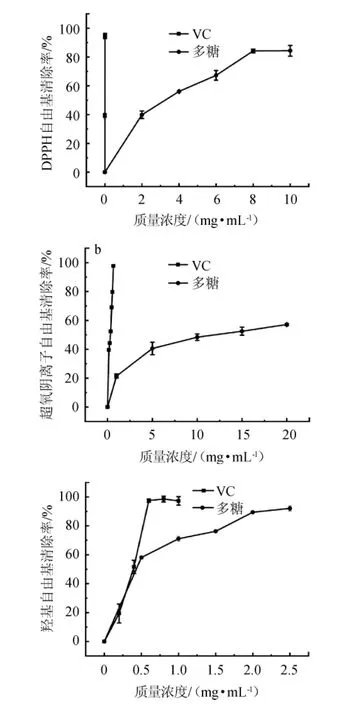
图8 酶解产物清除自由基的能力Fig.8 Free radical scavenging ability of enzymatic hydrolysis product
LIU X等[7]报道的聚合度2~7为主的低聚异麦芽糖清除超氧阴离子的IC50值约29.04 mg/mL,清除羟基自由基的IC50值约为5.32 mg/mL,IC50值分别是本研究的IC50的2.5倍和12.67倍。
3 结论
本研究从连云港海域的海泥中筛选了一株产内切右旋糖酐酶的海洋细菌,经鉴定菌株GN02为芽孢杆菌。该菌株最适生长温度和初始pH值分别为35 ℃和7.0。该菌株产胞外酶,最适产酶温度和初始pH分别为25 ℃和8.0,发酵时间为48 h。酶的最适温度和pH分别为20 ℃和7.0,具有良好的热稳定性。酶解产物以异麦芽三糖和异麦芽四糖为主,1 h水解产物中异麦芽四糖含量达到85.6%。酶解产物具有较高的抗氧化活性,清除羟基、DPPH、超氧阴离子自由基的IC50值分别为0.42 mg/mL、2.98 mg/mL及11.54 mg/mL。该酶在食品和医药等领域中具有较大的应用潜力。

