肿瘤相关成纤维细胞与CD4+、CD8+T淋巴细胞在乳腺癌发生发展及淋巴结转移中的相关性研究
朱 燕,朱永祺,张晓娟*,钱金锋,刘宏斌,盛美红
1南通大学第二附属医院病理科,江苏 南通 226001;2南通大学医学院临床医学系,江苏 南通 226001;3南通大学第二附属医院影像科,江苏 南通 226001
乳腺癌的复发、转移是影响乳腺癌患者预后的重要因素,研究乳腺癌组织侵袭转移情况,寻求新的靶向治疗手段,对于改善乳腺癌患者的预后具有非常重要的意义。研究表明,恶性肿瘤的生物学行为不仅取决于肿瘤细胞本身,肿瘤微环境对肿瘤的发生发展也起着决定性作用。肿瘤相关性成纤维细胞(cancer-associated fibroblast,CAF)是肿瘤微环境中重要的成分,它分泌多种信号分子,包括炎症细胞因子、趋化因子、生长因子等,这些因子通过改变肿瘤微环境来刺激肿瘤细胞,同时重塑肿瘤细胞的细胞外基质[1-2]。正是这些特性,CAF通过促进肿瘤生长、血管生成、耐药性、侵袭和转移,为肿瘤的发生发展提供了合适的条件[3]。尽管CAF可能对乳腺癌的进展起到很强的作用,但关于CAF、CD4+、CD8+T淋巴细胞与乳腺癌发生发展的关系,尤其对淋巴结转移影响的相关研究甚少。
本文通过检测乳腺浸润性导管癌组织及转移淋巴结中CAF[以CAF的特异性蛋白α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)作为免疫酶标的抗原]及CD4、CD8的表达,并结合临床病理特征进行统计学分析,从而探寻CAF诱导的免疫抑制与乳腺癌发生发展及淋巴结转移程度之间的相关性,进一步了解CAF、CD4+及CD8+T淋巴细胞是否参与淋巴结的转移,为用CAF和免疫细胞为靶点的治疗来改善未来乳腺癌患者的生存及预后提供实验依据。
1 对象和方法
1.1 对象
收集南通大学第二附属医院病理科2010—2014年行乳腺癌改良根治术的手术标本110例(均为浸润性导管癌),术前未经过任何放疗、化疗及内分泌治疗,所有患者均为女性,发病年龄32~79岁,平均年龄51岁。按照肿瘤大小分组:肿瘤≤2 cm 64例,肿瘤>2 cm 46例;按照WHO的浸润性导管癌组织学分类标准[4]分类:G1级32例,G2级43例,G3级35例;按照TNM临床分期标准[4]进行分期:Ⅰ期+Ⅱ期89例,Ⅲ期+Ⅳ期21例;按照有无腋窝淋巴结转移情况分组:淋巴结无转移67例;淋巴结有转移43例。其中43例有转移的淋巴结中有11例为微转移淋巴结,32例为宏转移淋巴结(肿瘤转移灶最大径>0.2 mm,但不超过2 mm为微转移;淋巴结转移灶最大径>2 mm,则为宏转移)。选取乳腺癌癌旁3 cm外的正常乳腺组织作为对照。本研究经过医院伦理委员会批准。
1.2 方法
1.2.1 免疫组织化学染色
所有手术标本均经10%中性福尔马林液固定,石蜡包埋及4 μm连续切片。鼠抗人α-SMA抗体、兔抗人CD4抗体、兔抗人CD8抗体均购于北京中杉金桥生物技术有限公司。采用已知的阳性切片作为阳性对照,阴性对照用PBS液代替一抗。
1.2.2 结果判定
α-SMA阳性的细胞定位于乳腺间质内,胞质呈棕黄色或棕褐色,正常乳腺间质成纤维细胞不表达α-SMA,因此以乳腺间质中α-SMA阳性细胞代表CAF,而表达α-SMA的乳腺导管及腺体基底部的肌上皮细胞及间质小血管不计为阳性细胞。随机选取10个高倍视野(×400)约200个细胞,根据阳性细胞所占观察细胞数的百分比计分:1分(阳性细胞数≤10%),2分(10%<阳性细胞数≤50%),3分(50%<阳性细胞数≤75%),4分(75%<阳性细胞数);染色强度的评分:0分(无着色),1分(淡黄色),2分(棕黄色),3分(棕褐色)。将两者分值相乘:0~3分(-),4~5分(+),6~7分(++),≥8分(+++),其中+~+++为阳性表达。CD4、CD8阳性表达定位于淋巴细胞膜,观察显色强度:无显色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分;观察显色面积:进行视野淋巴细胞计数,<5%淋巴细胞着色计0分,5%~25%淋巴细胞着色计1分,25%~50%淋巴细胞着色计2分,>50%淋巴细胞着色计3分;将两者分值相乘:<2分为阴性,≥2分为阳性。
1.3 统计学方法
所有数据分析均在SPSS 21.0软件上进行。采用卡方检验对α-SMA、CD4、CD8在不同亚组患者之间的表达差异进行比较。采用配对样本卡方检验对α-SMA表达与CD4、CD8表达的相关性进行分析。P<0.05为差异具有统计学意义。
2 结果
2.1 α-SMA、CD4及CD8在浸润性导管癌组织与癌旁组织中的表达及意义
α-SMA阳性表达定位在肿瘤间质成纤维细胞的细胞浆中(图1),110例乳腺癌中有52例(47.27%)呈阳性表达,其中8例呈强阳性;癌旁正常乳腺组织未见阳性表达。α-SMA在乳腺癌组织中的阳性率显著高于癌旁正常乳腺组织,两者之间的α-SMA表达有显著性差异(χ2=68.095,P<0.001)。
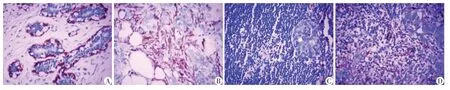
图1 α-SMA在正常乳腺组织、浸润性导管癌、淋巴结微转移及宏转移中的表达(×400)Figure 1 Expresssion of α-SMA in normal breast tissue,invasive ductal carcinoma,lymph node micrometastasis,lymph node macrometastasis(×400)
CD4、CD8阳性表达定位于淋巴细胞膜(图2),CD4+T淋巴细胞在乳腺癌中阳性率为45.45%(50/110),低于癌旁正常乳腺组织(48.18%,53/110),两组相比差异无统计学意义(χ2=0.164,P=0.685)。CD8+T淋巴细胞在乳腺癌中阳性率为55.45%(61/110),高于癌旁正常乳腺组织(31.82%,35/110),两组相比差异有统计学意义(χ2=12.493,P<0.001)。
2.2 α-SMA、CD4及CD8在浸润性导管癌组织的表达及与临床病理特征的关系
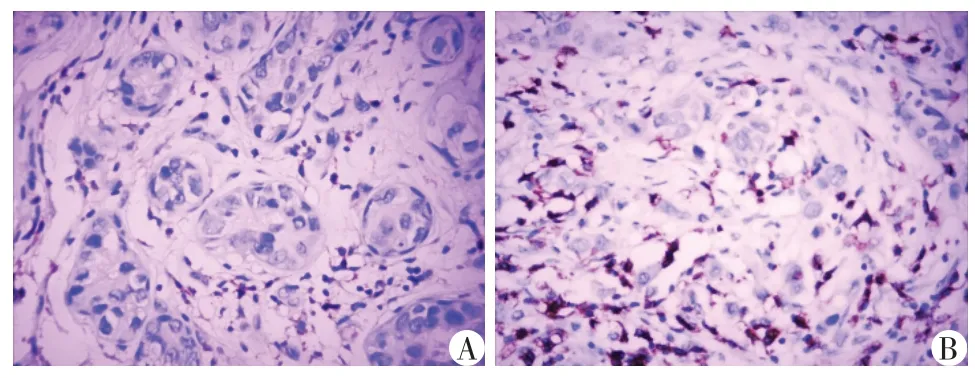
图2 CD4、CD8在浸润性导管癌中的表达(×400)Figure 2 Expression of CD4 and CD8 in invasive ductal carcinoma(×400)

表1 α-SMA、CD4、CD8在不同亚组患者之间的表达差异Table 1 α-SMA,CD4 and CD8 expresssion differences among different subgroups [n(%)]
由表1可见浸润性导管癌中α-SMA的阳性表达与年龄、组织学分级无关(P>0.05),而与肿瘤大小、临床分期及淋巴结转移有关(P<0.05);即肿瘤越大、临床分期越高、有腋窝淋巴结转移的乳腺癌中α-SMA的阳性表达越高;腋窝淋巴结宏转移所有病例均见α-SMA的表达。CD4的阳性表达与年龄、肿瘤大小及临床分期无关(P>0.05),而与组织学分级呈负相关(P<0.05),CD4的阳性表达在淋巴结无转移、微转移、宏转移3组之间的差异处于临界值(P=0.057),但无转移组与转移组(微转移+宏转移)比较时差异有统计学意义(χ2=4.736,P<0.05),即随着肿瘤组织学级别的升高、淋巴结的转移,CD4的阳性率逐渐降低,淋巴结转移情况分组中宏转移组表达率最低。CD8的阳性表达与年龄、肿瘤大小及临床分期无关(P>0.05),而与组织学分级及淋巴结转移呈正相关(P<0.05);即随着肿瘤组织学级别的升高、淋巴结的转移,CD8的阳性率逐渐升高,淋巴结转移情况分组中宏转移表达率最高。
2.3 浸润性导管癌中α-SMA表达与CD4、CD8表达的相关性分析
浸润性导管癌中α-SMA染色阳性52例(52/110,47.27%),其中CD4阳性15例(15/52,28.85%),CD8阳性41例(41/52,78.85%);α-SMA阴性58例(58/110,52.73%),其中CD4阳性35例(35/58,60.34%),CD8阳性20例(20/58,34.48%)。经配对计数资料的相关分析(表2),浸润性导管癌中α-SMA阳性表达与CD8的阳性表达存在正相关性(C=0.446,P<0.001),与CD4的阳性表达存在负相关(C=-0.316,P=0.001)。

表2 α-SMA与CD4、CD8表达的相关性Table 2 Correlation between α -SMA and CD4,CD8 expresssion (n)
3 讨论
研究表明,恶性肿瘤的生物学行为不仅取决于肿瘤细胞本身,肿瘤微环境对肿瘤的发生发展也起着决定性的作用。肿瘤微环境由细胞外基质和各种肿瘤间质细胞(包括成纤维细胞、免疫细胞、炎症细胞、内皮细胞、脂肪细胞和骨髓来源细胞)组成。其中CAF是最丰富的肿瘤间质细胞,目前已经被证实在许多癌症的侵袭及转移过程中都发挥着至关重要的作用[5-7]。CAF通过分泌许多活性蛋白质因子促进了癌细胞的活化与增殖、侵袭和转移,同时也通过促进血管内皮细胞的生成、肿瘤基质的重塑间接促进了肿瘤的发生。研究还发现,CAF还能利用自身分泌的蛋白质因子如TGF-β、IL-6、IL-10等促使癌细胞发生上皮-间质的转化并促使MMP2、MMP9等相关基因的表达上调,进而导致癌细胞的发生,促进癌细胞的转移[8]。回顾文献发现对CAF介导的免疫抑制与乳腺癌发生发展及淋巴结转移程度的相关性报道极少见。
本文以浸润性导管癌中的CAF(以CAF的特异性蛋白α-SMA作为免疫酶标的抗原)及肿瘤浸润性T淋巴细胞(CD4+、CD8+)为切入点,探讨这两种因素与乳腺癌发生发展及淋巴结转移的关系。当肿瘤组织中浸润大量淋巴细胞时表明机体启动了对抗肿瘤的反应,CD4+T淋巴细胞可以促进免疫细胞的增殖及分化,协调免疫细胞间的相关作用[9],CD8+T淋巴细胞是主要的抗肿瘤效应细胞,通过释放穿孔素或者促进细胞凋亡来杀死肿瘤细胞[10],是有效控制肿瘤发展,提高肿瘤患者治疗效果的关键效应细胞。
本组资料显示,α-SMA在乳腺癌组织中的表达明显高于癌旁正常乳腺组织,且肿瘤较大、临床分期较高、有淋巴结转移的乳腺癌中α-SMA的表达较高,提示CAF通过各种机制影响肿瘤微环境而促进肿瘤的发生发展。进一步研究显示α-SMA在无淋巴结转移、淋巴结微转移及淋巴结宏转移中表达逐渐升高,从而可判断CAF具有促进癌细胞在淋巴结中存活、增殖的作用。CD4在乳腺癌组织中的阳性表达低于癌旁正常乳腺组织,且随着肿瘤组织学级别的升高、淋巴结的转移,CD4的阳性率逐渐降低。CD8在乳腺癌组织中的阳性率高于癌旁正常乳腺组织,且随着肿瘤组织学级别的升高、淋巴结的转移,CD8的阳性率逐渐升高,此研究结果与文献报道一致[11-13]。原因可能为肿瘤细胞产生免疫抑制因子,抑制免疫细胞分化增殖而导致CD4+T淋巴细胞减少,CD8+T淋巴细胞反应性增多。随着肿瘤的进展,产生和分泌的抑制因子会越来越多,诱导CD8+T淋巴细胞产生的同时也阻止CD4+T淋巴细胞的产生。进一步分析显示,CD4在无淋巴结转移、淋巴结微转移及淋巴结宏转移中阳性率逐渐降低,而CD8的阳性率则相反,表明淋巴结转移的患者细胞免疫明显受到抑制,随着疾病的进展,机体免疫功能逐渐降低,从而造成肿瘤细胞加速生长,病情出现恶化。经配对计数资料的相关分析,乳腺癌中α-SMA表达与CD8的阳性表达存在正相关性(C=0.446,P<0.001),与CD4的阳性表达存在负相关(C=-0.316,P=0.001)。可能与CAF通过旁分泌或自分泌TGF-β进而引起一系列细胞因子IL-10等的表达,抑制淋巴细胞分化增殖有关;TGF-β还可抑制NK细胞合成γ-干扰素并阻碍CD4+Th细胞向具有抗肿瘤免疫活性的Th1方向分化,导致机体的免疫功能处于抑制状态,肿瘤细胞发生免疫逃逸,进一步促进癌肿的生长和侵袭转移[14-15]。α-SMA表达与CD4、CD8表达密切相关,同时也进一步证实了乳腺癌的发生、发展是多级因子相互作用的复杂过程。α-SMA及CD8的表达在乳腺癌转移淋巴结内明显增多,且与转移淋巴结转移程度有关,即CAF及免疫细胞的改变增强了乳腺癌的淋巴结转移。本研究为进一步用CAF和免疫细胞为靶点的治疗来改善未来乳腺癌患者的生存及预后提供了实验依据。

