腹腔镜下妊娠病灶切除术治疗Ⅱ型及Ⅲ型剖宫产瘢痕部位妊娠的疗效分析
王卫 韩燕华 黄瑾 何惠嫦 苏园园 罗少玲 瞿凡
剖宫产瘢痕部位妊娠(cesarean sar pregnancy,CSP)是指受精卵着床种植在剖宫产瘢痕处的一种少见异位妊娠[1-2]。随着剖宫产率的提高、经阴道超声的广泛应用及认识程度的增加,其报道的发生率也逐年上升[3-4]。尽管报道用于CSP治疗的方式有数十种,但是至今尚无公认的最佳治疗方案[1,5-6]。有研究表明手术治疗,而非药物治疗应该是CSP 治疗的首选[7-8]。CSP 的手术治疗主要包括经腹/经腹腔镜/经阴道妊娠病灶切除术及子宫动脉栓塞术(uterine artery embolization, UAE) 联 合 清 宫术[9-10]。近年来,随着腹腔镜技术的发展及微创意识的提高,腹腔镜下妊娠病灶切除术在CSP 中的应用逐渐增多。本文拟通过对中山市人民医院妇产科相关CSP 患者的回顾性分析,探讨腹腔镜下妊娠病灶切除术在Ⅱ型及Ⅲ型CSP中的应用价值。
资料和方法
一、一般资料
回顾性分析中山市人民医院妇产科2018 年11 月至2020 年8 月收治的39 例行腹腔镜下妊娠病灶切除术的CSP 患者的临床资料。所有患者均由经阴道二维和/或三维彩超诊断并分型。超声诊断及分型标准均参照中华医学会妇产科学分会计划生育学组的《剖宫产术后子宫瘢痕妊娠诊治专家共识(2016)》[11]。
患者年龄22 ~40 岁,平均(29.2 ± 5.3)岁。所有患者均为子宫下段剖宫产,其中有1 次剖宫产史者27 例,2 次剖宫产史者10 例,3 次剖宫产史者2例。距离前次剖宫产时间为1 ~13年,平均(6.0±3.3)年。患者停经时间36 ~64 d,平均(50.1 ±8.4)d。10 例患者的临床症状为阴道流血,4 例为下腹痛,2 例为下腹痛伴阴道流血,23 例无任何临床症状,为常规早孕期超声检查诊断。经阴道超声测量的瘢痕处妊娠病灶平均直径为(27.2±7.5)mm,瘢痕处局部肌层厚度平均值为(2.2±0.7)mm。超声诊断的CSPⅡ型28 例,CSPⅢ型11 例,其中有23 例可探及心管搏动。术前血hCG 为1 343 ~32 112 mIU/mL,平均(12 055.0±7 912.9)mIU/mL。入院时患者均生命体征平稳,无阴道大出血等。本次研究内容已通过本院医学伦理委员会批准,患者均自愿签署手术知情同意书。
二、纳入及排除标准
纳入标准:(1)CSP 超声诊断明确;(2)超声分型为Ⅱ型或Ⅲ型;(3)患者生命体征平稳,无全麻及腹腔镜手术禁忌证;(4)签字同意行腹腔镜下妊娠病灶切除术。排除标准:(1)超声分型为Ⅰ型;(2)患者阴道出血多或生命体征不平稳;(3)患者不愿或不能耐受全麻或腹腔镜下手术。
三、手术情况
1.术前准备
术前完善血常规、尿常规、凝血四项、肝肾功能、电解质及心电图等术前常规检查,排除全麻及腹腔镜手术禁忌证。麻醉前或切皮前1 小时内静脉给予预防性抗生素1 次。所有患者除术前行阴道灌洗上药外,未给予泻药、灌肠、甲氨蝶呤及米非司酮等其他特殊处理。
2.手术方法
全麻后患者取膀胱结石位,常规消毒铺巾。金属导尿管导尿后,于脐孔下缘10 mm 的操作孔置入腹腔镜镜头,在腹腔镜监视下于下腹部麦氏点和反麦氏点各作一5 mm 的操作孔。探查盆腔并分离盆腔粘连,充分游离子宫及附件。分离剖宫产瘢痕位置粘连后用超声刀打开膀胱反折腹膜,下推膀胱,充分游离暴露子宫下段、宫颈上段及CSP 病灶(图1)。于CSP 局部肌层薄弱处用单极电钩横形切开至妊娠病灶内。取出病灶处妊娠组织后,进一步修剪切缘瘢痕组织,检查无妊娠组织残留后用2-0可吸收线分两层连续缝合子宫切口,最后使用同样方法连续缝合返折腹膜(图2)。对于无生育要求,且签字要求行输卵管绝育者,同时行腹腔镜下双侧输卵管切除/结扎术。将切除组织置入标本袋后自左侧腹壁穿刺孔取出。生理盐水反复冲洗盆腔,观察创面无活动性出血后,留置盆腔防粘连液,常规关气,退出腹腔镜,术毕。将取出组织送病理检查。

图1 打开膀胱返折腹膜,下推膀胱后重复暴露瘢痕部位妊娠病灶
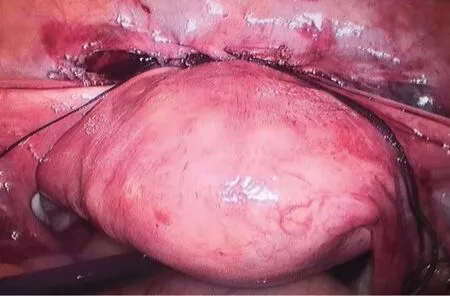
图2 切除瘢痕部位妊娠病灶后,连续缝合子宫肌层及腹膜
3.术后处理
术后无需留置导尿,再次静脉给予预防性抗生素1 次。术后第2 天复查血常规、血hCG 及经阴道超声。出院标准:患者一般情况好,血hCG 较术前下降>50%,血红蛋白无明显下降,超声提示宫腔及子宫下段瘢痕处无异常回声。
四、术后随访
患者出院后门诊每周复查1 次血hCG,直至降至正常。同时记录随访术后出血时间、月经复潮时间及腹痛等。建议有生育要求者术后严格避孕1 年以上,无生育要求者月经复潮后门诊行宫内节育器置入术或口服复方短效避孕药。
结 果
39例患者均顺利完成手术,术中均可见子宫前壁下段瘢痕处有蓝紫色凸起及绒毛样组织,均成功清除妊娠组织物。有11例患者术中同时行双侧输卵管绝育术。手术时间45 ~75 min,术中出血20 ~1 000 mL。除2 例因术中出血多(分别为800 mL 及1 000 mL)行输血治疗(分别为红细胞悬液2 U 及3 U)外,无其他手术并发症。术后患者均恢复良好,无发热、感染、大出血及膀胱损伤等并发症,未补充其他辅助治疗。出院前阴道超声均提示宫腔及子宫下段未见明显异常回声,术后住院时间为2 ~6 d。术后病理检查示子宫平滑肌组织及绒毛妊娠组织。术后门诊随访至所有患者血hCG 降至正常及月经复潮2 次。患者术后阴道出血时间为3 ~7 d,血hCG降至正常时间为16 ~25 d,初次月经复潮时间为26 ~45 d(表1)。所有患者均无月经淋漓不尽及宫腔粘连等并发症。有16例患者在月经复潮后于门诊行宫内节育器置入术,12例患者采用口服避孕药避孕。
讨 论
经阴道超声的广泛应用及认识程度的增加使得CSP 的诊断已多不困难,因此如何有效安全地治疗CSP是目前探讨的重点[1,10]。文献报道中用于CSP治疗的方式多达数十种,但至今尚未形成公认的最佳治疗方案。纵观CSP 的治疗发展史,可以将其简单分为直接清宫术或药物保守治疗、UAE 联合清宫术、CSP 病灶切除及瘢痕修补术三个时期[12]。由于CSP 发病率低,难以进行随机对照研究,因此现有系统综述及荟萃分析是指导CSP 的诊疗最高证据。在现有为数不多的相关研究中,以Birch Petersen K等对CSP 治疗选择的研究指导价值最大[7]。其对截至2015 年6 月的2 037 例CSP 患者的治疗方式进行对比分析后,发现共有五种治疗方案值得推荐,分别是经阴道妊娠病灶切除术、腹腔镜下妊娠病灶切除术、UAE联合宫腔镜下清宫术、UAE联合清宫术及宫腔镜下妊娠病灶切除术。因此作者认为现有的证据支持手术治疗,而非药物治疗才是CSP 治疗的首选方案。近年来,手术治疗在CSP 的应用逐渐增多,并显示出了良好的治疗效果。
CSP 治疗方案的合理选择首先需要考虑患者的一般情况及生育要求等,其次也要考虑到医院的硬件条件及医生的认知程度和手术技能等[1,10-12]。UAE尽管具有微创及恢复快等优点,但是医院必须具有相关设备及技术人员,而且其可能对患者后续生育力存在不良影响[1,3]。经宫腔镜下妊娠病灶切除术对操作人员和设备均有很高的要求,而且术中无法修复剖宫产瘢痕,对于Ⅲ型CSP 应慎用[1,11]。经阴道妊娠病灶切除术在CSP 治疗中的应用时间最短,尽管其对设备无特殊要求,但是对医生的阴式手术技巧有很高的要求[10,13]。由于CSP 患者为育龄期女性,治疗后有再次妊娠的可能。对于有生育要求的患者,手术治疗时应尽量避免对其生育力的影响。而对于无生育要求的患者,应将科学避孕作为其治疗的一部分。2020 年的一项荟萃分析显示,有CSP史的女性再次妊娠时发生复发性CSP 的几率高达17.14%[14-15]。因此,我国和美国母胎医学会的共识/指南均建议应为CSP 患者提供有效的避孕方法(包括长效可逆避孕和永久避孕)[8,10-11]。
表1 患者治疗结局(n=39,±s)

表1 患者治疗结局(n=39,±s)
手术时间(min)62.3±7.2术中出血(mL)138.3±202.9住院时间(d)3.3±1.1阴道流血时间(d)4.8±1.2血hCG降至正常时间(d)19.6±2.6月经恢复时间(d)35.0±4.5
目前腹腔镜下手术已在各类妇科手术中得到了广泛的应用,大多数妇科医生已熟练掌握了腹腔镜的手术技巧。腹腔镜下妊娠病灶切除术对设备无特殊要求,可同时切除CSP 病灶以及对剖宫产瘢痕进行修复,具有操作简单及术后恢复快等优点[1,10]。对于Ⅱ型和Ⅲ型CSP 患者,尤其是Ⅲ型CSP 尤为适合[5,12]。与UAE、宫腔镜下妊娠病灶切除术及经阴道妊娠病灶切除术相比,腹腔镜下妊娠病灶切除术还具有以下独特的优势:(1)术中可以分离盆腔粘连,改善盆腔情况,有利于术后受孕;(2)对于无生育要求者,可同时行输卵管绝育,避免再次意外妊娠及复发性CSP 的可能。本文研究中,所有患者均顺利完成腹腔镜下妊娠病灶切除术,术后恢复良好,且对11例无生育要求者术中同时行了输卵管绝育术,有效减少了复发性CSP的可能。
综上所述,腹腔镜下妊娠病灶切除术是一种治疗CSP 的有效方式,对设备及医生手术技能无特殊要求,值得推广。手术不仅可以同时切除CSP 病灶及对剖宫产瘢痕进行修补,而且可以同时分离盆腔粘连及行输卵管绝育术,可为治疗后的妊娠提供更加科学的管理。

