伴副肿瘤综合征儿童神经母细胞瘤临床特征分析
刘登辉 唐湘莲 黄 召 周宇翔 李 勇
副肿瘤综合征(paraneoplastic syndrome,PS)为恶性肿瘤伴发的临床症候群,目前认为这些症候群与自身免疫因素有关,而并非肿瘤直接侵犯、转移或治疗后遗症所致[1]。恶性肿瘤中10%~15%合并PS,且可出现一种或多种临床症状[2]。神经母细胞瘤(neuroblastoma,NB)是儿童常见的实体肿瘤之一,绝大部分患者的临床表现与原发肿瘤的位置、是否转移及转移部位有关[3],但少数患者首先表现为长期持续发热[4]、重症肌无力[5]、走路不稳共济失调[6]、顽固性水样腹泻[7]、儿茶酚胺代谢异常的高血压[8]、异位库欣综合征[9]、电解质紊乱[10],少数还会出现皮疹、过敏性紫癜[11]等。以PS起病的NB患者临床表现复杂,且出现的时间与肿瘤不一致,易造成临床诊断困难,从而延误治疗。本研究回顾性分析湖南省儿童医院收治的9例伴有副肿瘤综合征神经母细胞瘤患者的病例资料,对其临床特点、治疗策略及预后进行总结,以提高对本病的认识和临床诊疗水平。
材料与方法
一、一般资料
回顾性分析2010年1月至2019年12月由湖南省儿童医院收治的9例伴副肿瘤综合征神经母细胞瘤患者的临床资料,其中男5例,女4例;中位年龄32.0个月。发病到确诊NB的治疗时间2.1~5.7个月,中位时间为3.9个月。采用最新修订的国际神经母细胞瘤分期系统(International Neuroblastoma Staging System,INSS)标准临床分期,危险度分组参考美国儿童肿瘤协作组(Children’s Oncology Group,COG)标准。所有患者术后获得病理诊断,3例确诊为NB,预后良好2例,预后不良1例;6例确诊为节细胞性神经母细胞瘤,结节型2例,混杂型4例;INSS临床分期:Ⅱ期7例,Ⅲ期2例;COG危险度分组:低危组3例,中危组6例。
二、诊断方法
记录患者的诊断年龄、肿瘤部位、副肿瘤综合征症状的出现至NB确诊时间、治疗经过及转归情况。根据临床表现、体格检查、实验室检查病初时神经元特异性烯醇化酶(neuron specific enolase,NSE )、血清乳酸脱氢酶(lactate dehydrogenase,LDH)、尿香草扁桃酸(vanillyl mandelic acid,VMA)、 尿高香草酸(homovanillic acid,HVA)。所有患者行N-MYC基因检测以及骨髓穿刺检查,影像学检查[12]包括B超、CT、磁共振成像、18F-FDG/PET-CT、骨扫描,手术后病理检查确诊为NB。并与内科相关科室联合会诊,参考文献或共识,确定副肿瘤综合征NB患者纳入标准及诊断标准[10,13,14]。患者入院检查及治疗前均签署知情同意书,本研究经医院医学伦理委员会批准通过(批准文号:HCHLL-2020-80)。
三、综合治疗
严格按照标准筛选入组病例,明确副肿瘤综合征NB患者诊断及评估瘤灶,确定INSS分期及COG危险度分组,采用手术、系统化疗和(或)间断大剂量人血丙种球蛋白(high-dose intravenous immunoglobulin,HD-IVIG)、糖皮质激素免疫抑制等综合治疗手段。手术选择开腹和腹腔镜两种手术方式,化疗方案由血液内科制定,PS治疗方面,与内科团队商议共同制定免疫抑制及免疫调节等药物的治疗,一线免疫用药HD-IVIG和(或)糖皮质激素(甲基强的松龙或醋酸泼尼松片)、小剂量环磷酰胺、二线用药利妥昔单抗(美罗华)等。
结 果
一、临床表现及检查结果
本组9例中神经系统受累5例,消化系统受累2例;心血管系统受累1例,血液系统受累1例(骨髓未受累)。原发肿瘤病灶位于单侧肾上腺5例,腹膜后3例,骶前区1例。1例腹膜后病灶存在肿瘤局部椎体侵犯,其余患者未见骨髓及远处转移(表1)。
二、治疗及随访结果
本组9例在确诊NB后转我科手术治疗。神经内科5例确诊NB前予以HD-IVIG,剂量400 mg·kg-1·d-1,连续使用5天;甲基强的松龙(methylprednisolone,MP)冲击治疗(15~20 mg·kg-1·d-1)连续使用3天,每月一次,治疗时长为2.6~5.5个月。其中有2例经上述治疗后PS症状明显改善,确诊NB后接受手术、术后化疗和继续免疫治疗,至PS症状消失;另外3例术前PS症状无改善,手术后予以化疗及免疫治疗PS症状缓解,但未消失。消化内科2例出现PS症状至获得NB诊断时间分别是3.1个月、2.5个月,予以补液、肠内外营养支持、纠正水电解质及酸碱平衡紊乱、止泻、奥曲肽等对症支持治疗,确诊NB后接受手术、化疗等治疗。心血管内科1例诊断川崎病患者,予以阿司匹林、HD-IVIG及MP序贯治疗,3个月后确诊NB转我科手术,术后接受4周期化疗,PS症状消失。血液内科1例表现为瘀点瘀斑、血小板减少,确诊NB较早,予以HD-IVIG和糖皮质激素冲击治疗,手术前输注血小板5个单位,改善凝血功能等,转我科手术,术后接受4周期规律化疗。目前9例患者均获有效随访,随访时间为4.0~37.0个月,未见肿瘤复发,且无肿瘤微小残留病灶。3例累及神经系统副肿瘤综合征症状未完全消失,表现为语言认知能力下降以及行为共济失调,仍采取激素维持以及康复训练等治疗,其他患者副肿瘤综合征状态/肿瘤转归良好,无事件生存率66.7%,总体生存率100%,见表2。
讨 论
NB是儿童时期常见的恶性肿瘤之一,约占儿童恶性肿瘤的8%~10%[3,15]。PS是指发生在癌症患者体内,肿瘤未转移的情况下引起的远隔自身器官功能异常,而非癌肿直接侵犯所致,可以出现一种或几种副肿瘤综合征[1]。其临床表现形式各异,患者往往是以先于肿瘤的PS症状就诊,可累及神经系统、结缔组织、内分泌系统、消化系统、血液系统以及皮肤、关节等部位,其中以累及神经系统最多见[4-11]。
文献报道,PS的发病高峰年龄为1~4岁,约50%患者诊断此病时年龄<2.5岁,中位诊断年龄为28个月[16]。本组9例诊断时中位年龄32个月,略高于文献报道,但仍低于无PS症状NB患者。 研究发现,NB是儿童中最容易出现PS的肿瘤,多种副肿瘤综合征NB病例已被报道,且见于NB的不同病理类型中,包括节细胞神经母细胞瘤(ganglioneuroblastoma,GNB)和神经节细胞瘤(ganglioneuroma,GN)[17],但本组中未见GN病例,这可能与病例数少有关。副肿瘤综合征临床症状以神经系统功能受累最多见,包括走路不稳、肢体抖动、眼球震颤、双眼睑下垂、共济失调以及语言认知能力下降、Horner综合征以及眼痉挛-肌肉痉挛-共济失调综合征(opsoclonus-myoclonus-ataxiasyndrome,OMAS)等临床表现[18]。这些又可统称为副肿瘤性神经系统疾病(paraneoplastic neurologic disorders,PNDs)或副肿瘤神经综合征(paraneoplastic neurologic syndrome,PNS)。OMAS是PNS最常见的临床表现形式,其发生率约占NB病例数的2%~3%,而OMAS患者中并NB者约50%[16]。本组中5例累及神经系统,无肿瘤转移表现;且因肿瘤原发部位见于肾上腺、腹膜后及盆腔等机体较深部位,体积小,无骨、骨髓及远处淋巴结转移,故建议患者在出现PS症状,尤其是在针对PNS治疗后症状仍无缓解或缓解不明显时,需高度警惕神经源性肿瘤的可能,行腹部彩超及腹部增强CT以排除NB。而在消化系统受累的病患中,常以顽固性腹泻、电解质紊乱以及库欣综合征等临床症状出现。文献报道,出现消化系统症状直至获得NB诊断的时间为2~10个月,提示此类NB生物学行为偏惰性,临床疾病进展及诊断较缓慢,这可能与机体肿瘤负荷、病理组织类型及预后有关。尤其在顽固性腹泻的诊治中,患者往往以慢性持续性腹泻、体重减轻、代谢异常为主要临床特征。因此,血管活性肠肽(vasoactive intestinal peptide,VIP)分泌性神经源性肿瘤应作为鉴别诊断的一种可能;或者对伴有长期腹泻症状的NB患者,术后应检测肿瘤组织中VIP的表达情况,为更好地解释临床症状和肿瘤关系提供佐证[10]。本研究中1例临床表现为持续发热、皮疹、淋巴结肿大,心脏彩超提示有左冠状动脉扩张3.9 mm,右冠状动脉扩张2.4 mm,呈现典型的川崎病(Kawasaki disease,KD)症状。据目前文献所报道的累及心血管系统、表现出KD症状的病例仅7例,免疫系统异常被认为是KD伴副肿瘤综合征NB患者的主要病因;因而,有学者提出在KD规范化治疗后仍有临床症状者,无法采用“一元化”解释患者临床表现时,应考虑是否有肿瘤(尤其是神经源性肿瘤)导致患者代谢和免疫紊乱方面的因素。另1例表现为瘀点、瘀斑以及血小板减少,临床考虑血小板减少性紫癜诊治,文献报道的这种与恶性肿瘤相关的紫癜患者多见于成年人,且以老年男性居多,儿童病例较少,但本组中该例患者为非典型的过敏性紫癜。目前,在儿童恶性肿瘤中有皮肤疾病表现(神经母细胞瘤、白血病/淋巴瘤、朗格汉斯细胞组织细胞增多症等)者[14],仅见个案报道[11]。
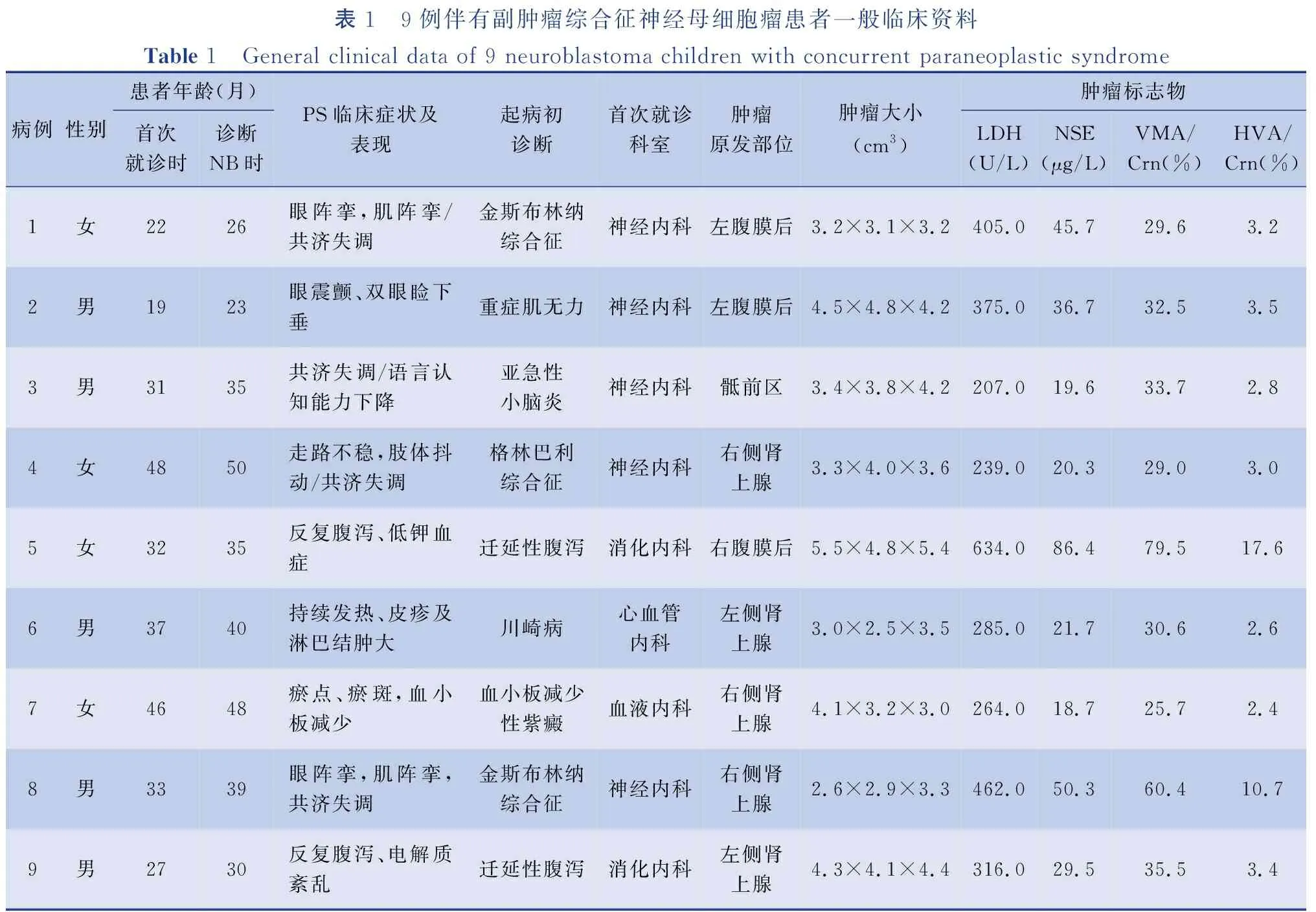
表1 9例伴有副肿瘤综合征神经母细胞瘤患者一般临床资料Table 1 General clinical data of 9 neuroblastoma children with concurrent paraneoplastic syndrome病例性别患者年龄(月)首次就诊时诊断NB时PS临床症状及表现起病初诊断首次就诊科室肿瘤原发部位肿瘤大小(cm3)肿瘤标志物LDH(U/L)NSE(μg/L)VMA/Crn(%)HVA/Crn(%)1女2226眼阵挛,肌阵挛/共济失调金斯布林纳综合征神经内科左腹膜后3.2×3.1×3.2405.045.729.63.22男1923眼震颤、双眼睑下垂重症肌无力神经内科左腹膜后4.5×4.8×4.2375.036.732.53.53男3135共济失调/语言认知能力下降亚急性小脑炎神经内科骶前区3.4×3.8×4.2207.019.633.72.84女48 50走路不稳,肢体抖动/共济失调格林巴利综合征神经内科右侧肾上腺3.3×4.0×3.6239.020.329.03.05女3235反复腹泻、低钾血症迁延性腹泻消化内科右腹膜后5.5×4.8×5.4634.086.479.517.66男3740持续发热、皮疹及淋巴结肿大川崎病心血管内科左侧肾上腺3.0×2.5×3.5285.021.730.62.67女46 48瘀点、瘀斑,血小板减少血小板减少性紫癜血液内科右侧肾上腺4.1×3.2×3.0264.018.725.72.48男3339眼阵挛,肌阵挛,共济失调金斯布林纳综合征神经内科右侧肾上腺2.6×2.9×3.3462.050.360.410.79男2730反复腹泻、电解质紊乱迁延性腹泻消化内科左侧肾上腺4.3×4.1×4.4316.029.535.53.4
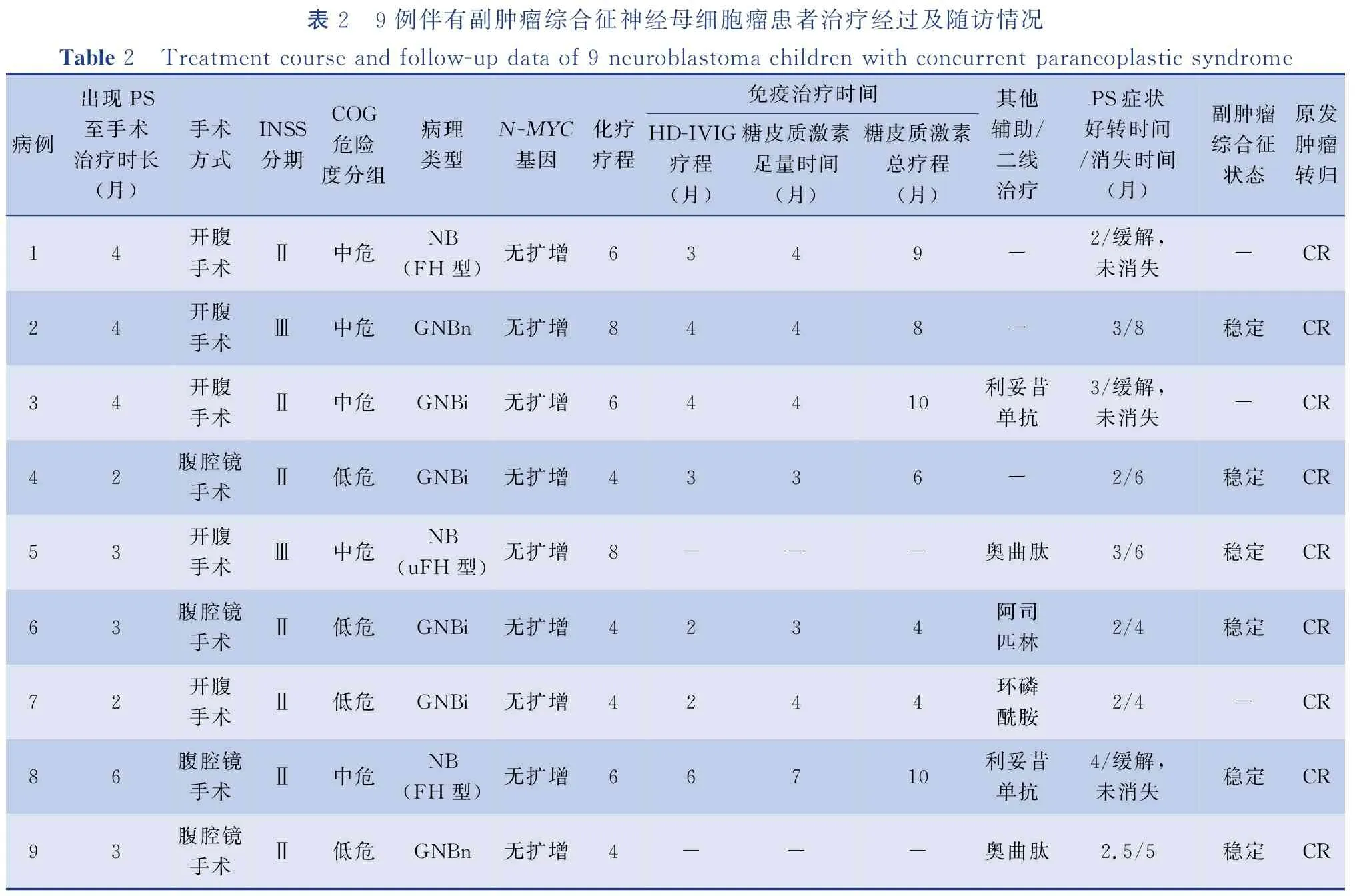
表2 9例伴有副肿瘤综合征神经母细胞瘤患者治疗经过及随访情况Table 2 Treatment course and follow-up data of 9 neuroblastoma children with concurrent paraneoplastic syndrome病例出现PS至手术治疗时长(月)手术方式INSS分期COG危险度分组病理类型N-MYC基因化疗疗程免疫治疗时间HD-IVIG疗程(月)糖皮质激素足量时间(月)糖皮质激素总疗程(月)其他辅助/二线治疗PS症状好转时间/消失时间(月)副肿瘤综合征状态原发肿瘤转归14开腹手术Ⅱ中危NB(FH型)无扩增6349-2/缓解,未消失-CR24开腹手术Ⅲ中危GNBn无扩增8448-3/8稳定CR34开腹手术Ⅱ中危GNBi无扩增64410利妥昔单抗3/缓解,未消失-CR42腹腔镜手术Ⅱ低危GNBi无扩增4336-2/6稳定CR53开腹手术Ⅲ中危NB(uFH型)无扩增8---奥曲肽3/6稳定CR63 腹腔镜手术Ⅱ低危GNBi无扩增4234阿司匹林2/4稳定CR72开腹手术Ⅱ低危GNBi无扩增4244环磷酰胺2/4-CR86腹腔镜手术Ⅱ中危NB(FH型)无扩增66710利妥昔单抗4/缓解,未消失稳定CR93腹腔镜手术Ⅱ低危GNBn无扩增4---奥曲肽2.5/5稳定CR
神经母细胞瘤预后与PS症状轻重无关,一般认为伴副肿瘤综合征NB预后较单纯NB好,一方面原因是PS症状出现先于癌症本身,这必定会引起家长关注而早期就诊。另一方面,其肿瘤临床分期、组织学类型,N-MYC基因扩增及生物学表现均相对较好。本组病例9例患者Ⅱ期7例,Ⅲ期2例,低危组3例,中危组6例,N-MYC基因无扩增,无远处淋巴结转移及骨髓浸润,提示肿瘤预后良好。但副肿瘤综合征尤其是在累及神经系统的病例中后遗症常见,研究发现发病超过30周才开始治疗的PS患者,其遗留严重的神经系统后遗症比率远高于30周之前开始治疗的患者[21]。
总之,PS出现临床表现较肿瘤本身更早,且并发症较多。对PS的充分认识和其产生机制的进一步研究,必定对相关肿瘤的早期诊断、治疗及并发症的预防产生深远的影响,早发现原发肿瘤病灶,尽早采取针对性治疗,有利于改善患者预后。

