脂多糖诱导星形胶质细胞炎性反应的机制研究
郭敏芳,张慧宇,穆秉桃,尉杰忠,2*,马存根,3*
(1.山西大同大学脑科学研究所,山西大同 037009;2.大同市第五人民医院神经科,山西大同 037009;3.国家中医药管理局多发性硬化益气活血重点研究室/神经生物学研究中心,山西中医药大学,山西晋中 030619;)
星形胶质细胞是中枢神经系统(central nervous system,CNS)中数量最多的胶质细胞,主要起支持营养神经细胞,调控神经递质循环,维持内环境稳定及支持血脑屏障等作用[1]。近年来研究发现星形胶质细胞可以调节中枢免疫反应,在多种神经免疫性疾病的病理生理过程中发挥关键作用。星形胶质细胞在神经疾病病理过程中具有两面性,即有害角色/保护角色。作为有害角色,可以通过增加血脑屏障的通透性,分泌各种炎性因子和趋化因子,抑制轴突和髓鞘再生等机制促进疾病的严重程度[2]。NO是由诱导型一氧化氮合酶(inducible nitric oxide synthase,iN⁃OS)合成的,是诱导神经元损伤的特征性炎性因子,此外,炎性因子,比如肿瘤坏死因子−α(tumor necro⁃sis factor−α,TNF−α)、白细胞介素−1β(interleukin−1β,IL−1β)和IL−6等,也在神经损伤过程中发挥重要作用。体外实验证实,LPS激活的星形胶质细胞可以释放NO,多种炎性因子和趋化因子[3]。
有研究表明,星形胶质细胞表达的Toll样受体4(toll−like receptor 4,TLR4)可以识别LPS,被LPS激活的星形胶质细胞源性TLR4能触发信号级联导致核因子κB(nuclear factor−kappa B,NF−κB)炎性反应通路活化[4],NF−κB信号通路被激活可以引起iNOS的表达,多种炎性因子和应激反应介质的释放[5],从而参与神经变性疾病的炎性反应。
在本次试验中,我们用LPS刺激C57BL/6小鼠大脑皮质星形胶质细胞,观察由LPS触发的星形胶质细胞损伤过程是否与NF−κB通路的异常激活有关,从而探讨LPS诱导星形胶质细胞产生炎性反应及其可能机制。
1 材料和方法
1.1 材料
C57/BL6小鼠(体质量18~20 g),购于中国医学科学院实验动物中心;ELISA检测试剂盒购自美国Pe⁃proTech公司;LPS购自美国Sigma公司;小鼠GFAP抗体、兔抗iNOS抗体、兔抗NF−κB抗体及兔抗GAP⁃DH抗体购自美国Cell Signaling Technology公司;Al⁃ex Flour ®488和Alex Flour ®594标记的山羊抗兔IgG二抗、HRP标记的山羊抗兔IgG二抗购自美国Abcam公司;蛋白提取和蛋白定量试剂盒购自上海碧云天生物技术有限公司;高糖DMEM细胞培养液和胎牛血清购自美国Gibco公司。
1.2 方法
1.2.1 原代小鼠星形胶质细胞培养
新生1~2 d C57/BL6小鼠乳鼠于无菌条件下断头,分离大脑皮质,放入预冷的PBS液中,分离脑膜和血管后用巴氏滴管轻轻吹打,制成单细胞悬液,1 000 r/min离心5 min;弃上清,细胞沉淀用星形胶质细胞基本培养液(含200 mL/L胎牛血清的高糖DMEM)重新悬浮,然后将细胞接种入75 cm2的培养瓶(预先用多聚赖氨酸处理)中,放入CO2培养箱中培养。10~14 d后细胞铺满瓶底。然后以180 r/min的速度在37 ℃恒温摇床中震荡5 h,去除上层的少突胶质细胞和小胶质细胞[6]。最后胰酶消化传代。
1.2.2 鉴定星形胶质细胞
用GFAP免疫荧光细胞化学染色法对纯化的星形胶质细胞进行鉴定,荧光显微镜下随机观察10~12个视野,计算GFAP阳性细胞的百分比。
1.2.3 实验分组
将纯化后的第2代星形胶质细胞以5×106/mL的密度接种于6孔细胞培养板中,24 h后更换基本培养液,实验分2组:对照组,加PBS;LPS刺激组,加入1µg/mL LPS,作用24 h后收集培养上清液用于后续实验。
1.2.4 检测上清液中NO的含量
取各组细胞培养上清液,按照试剂盒说明书操作,检测上清液中NO的含量,单位是µmol/L。
1.2.5 ELISA法检测上清液中炎性因子的水平
收集各组细胞培养上清液,采用ELISA试剂盒测定IL−6、IL−1β和TNF−α的水平,单位为pg/mL。
1.2.6 免疫荧光法检测iNOS和NF−κB的表达
LPS作用24 h后,细胞用4%多聚甲醛固定30 min;PBS洗5 min × 3次,用含有0.3% Triton X−100和1%BSA的PBS封闭并通透1 h;然后加入兔抗iN⁃OS抗体(1∶500)、兔抗NF−κB抗体(1∶500),4 ℃孵育过夜;次日加488和594标记的山羊抗兔IgG二抗,室温下孵育2 h,PBS洗5 min ×3次;用含有DAPI的抗荧光淬灭封片液封片,荧光显微镜下观察,并采用Im⁃age−Pro Plus 6.0图像分析软件检测iNOS和NF−κB的荧光强度值。
1.2.7 Western blot法检测iNOS和NF−κB蛋白表达
LPS作用24 h后,收集细胞,4 ℃条件下提取蛋白。蛋白定量试剂盒将各组蛋白浓度调成一致。采用10% SDS−PAGE凝胶电泳分离,转膜,5%脱脂牛奶封闭2 h,TBST洗膜5 min×3次。用封闭液稀释兔抗iNOS(1∶200)抗体,兔抗NF−κB (1∶400)和兔NADPH抗体(1∶1 000)一抗,将抗体稀释液加至膜上,4 ℃孵育过夜。次日TBST洗膜5 min × 3,加山羊抗兔HRP偶联的二抗(1∶10 000),室温孵育2 h。最后用Bio−Rad凝胶成像仪检测染色条带并分析条带灰度。
1.2.8 统计学分析
实验重复3次,取平均值,采用SPSS 13.0统计软件对数据进行分析处理。组间比较采用t检验,P<0.05为具有统计学意义。
2 结果
2.1 AST纯度鉴定结果
GFAP免疫荧光染色结果显示星形胶质细胞纯度达95%以上(图1)。
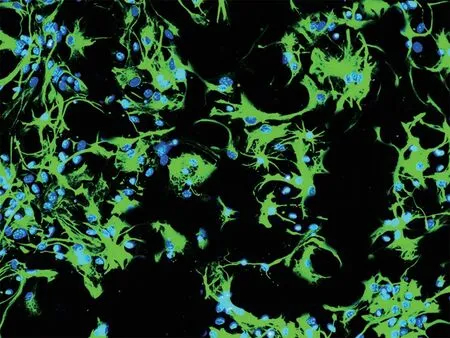
图1 星形胶质细胞的鉴定(×400)
2.2 LPS刺激对星形胶质细胞释放NO的影响
LPS刺激星形胶质细胞24 h以后,按照试剂盒说明书检测2组细胞培养上清液中NO水平。结果显示,LPS引起星形胶质细胞分泌NO明显增加,与PBS组相比,差异有统计学意义(图2)。

图2 LPS刺激对星形胶质细胞释放NO的影响
2.3 LPS刺激对星形胶质细胞释放炎性因子的影响
LPS刺激星形胶质细胞24 h以后,按照ELISA检测试剂盒说明书检测2组细胞培养上清液中IL−6、IL−1β 和TNF−α 的水平,结果显示,星形胶质细胞经LPS刺激后炎性因子IL−6、IL−1β 和TNF−α 的分泌显著增加,与PBS组相比,差异有统计学意义(图3)。
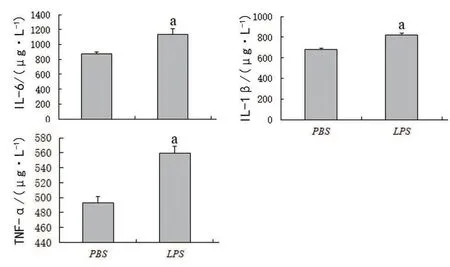
图3 LPS刺激对星形胶质细胞分泌炎性因子的影响
2.4 LPS刺激对星形胶质细胞的iNOS和NF-κB蛋白表达的影响
利用免疫荧光细胞化学染色法和免疫印迹法检测LPS对星形胶质细胞iNOS和NF−κB蛋白表达的影响,结果显示,LPS刺激24 h后,星形胶质细胞iNOS和NF−κB的表达显著升高,与PBS组相比,差异有统计学意义(图4~5)。
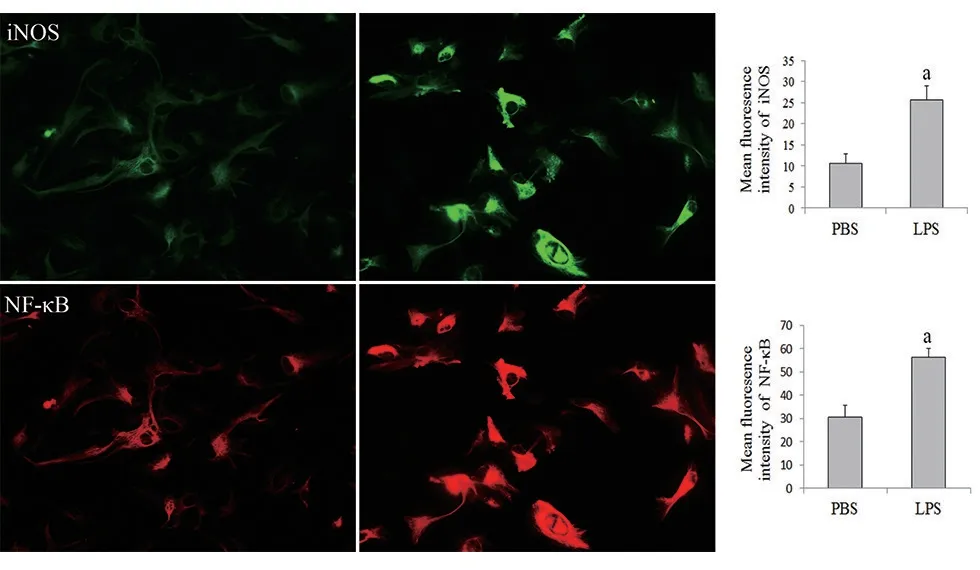
图4 免疫荧光法检测星形胶质细胞iNOS和NF-κB的表达(×400)
3 讨论
神经炎症在神经系统疾病的发病机理中起着非常重要的作用,包括细菌/病毒性脑膜炎在内的各种传染性疾病和非传染性疾病,包括帕金森病(Parkin⁃son's disease,PD)、阿尔茨海默病(Alzheimer's dis⁃ease,AD)和亨廷顿病(Huntington's disease,HD)等神经退行性疾病,脑外伤(traumatic brain injury,TBI)、肌萎缩性侧索硬化症(amyotrophic lateral scle⁃rosis,ALS)和中风等运动神经元疾病,多发性硬化症(multiple sclerosis,MS)等神经免疫性疾病[7]。免疫系统的2个组成部分(固有免疫和适应性免疫)在多种神经系统疾病神经炎症的产生中都起着至关重要的作用。虽然小胶质细胞是CNS的固有免疫细胞,但是越来越多的证据证明星形胶质细胞是具有免疫功能的细胞,能够通过分泌炎性细胞因子和趋化因子诱发炎性反应,因此星形胶质细胞在神经炎症过程中也发挥着关键作用[8]。
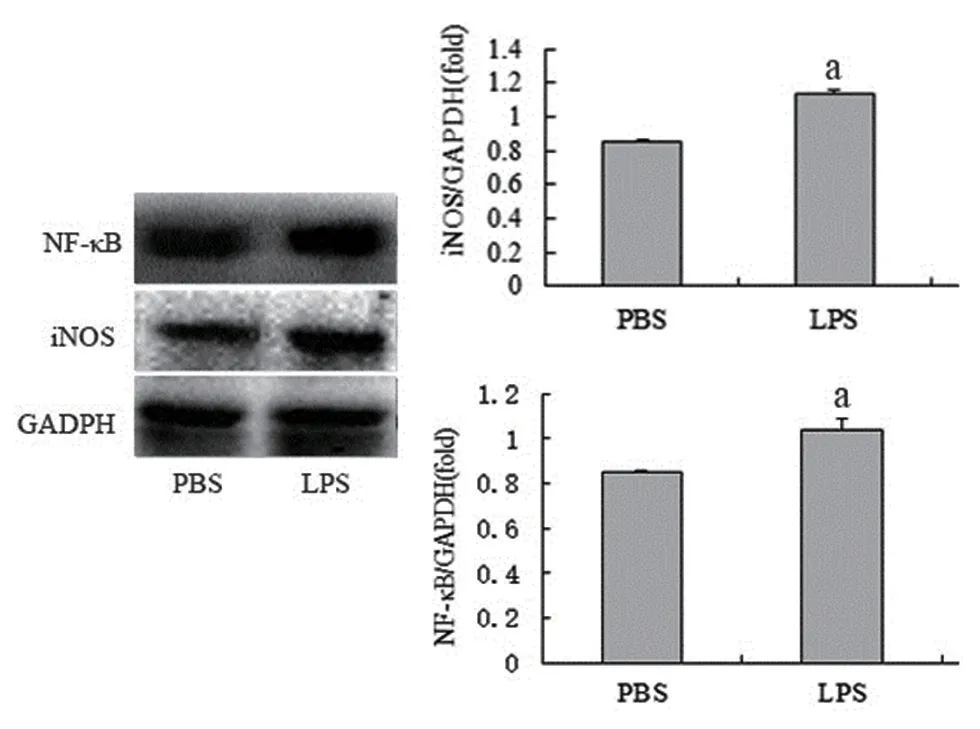
图5 免疫印迹法检测星形胶质细胞iNOS和NF-κB的表达
LPS是存在于革兰氏阴性细菌外膜中的分子,是研究最深入的免疫刺激分子之一,可诱发全身性炎症。它的主要目标TLR4,通过激活TLR4募集下游的一系列衔接子,例如髓样分化因子MyD88,最终导致NF−κB的激活,进而诱导大量促炎基因的激活[9]。目前神经炎症领域的大多数研究工作都使用LPS来刺激星形胶质细胞和小胶质细胞。因此本研究也采用LPS刺激星形胶质细胞,来促发其炎性反应。
NF−κB是一种普遍存在且用途广泛的核转录因子,是体内炎症反应和氧化应激反应的关键调节剂。例如,NF−κB参与炎性因子的分泌和诱导型环氧合酶(cyclooxygenase,COX−2)的表达,而COX−2参与iNOS和花生四烯酸类物质的合成,iNOS可以增强神经胶质细胞和内皮细胞的NO生成[10]。炎性因子和NO在病理性炎症中起着不可或缺的作用,它们可导致血脑屏障的破坏,上调黏附分子表达并刺激有毒物质扩散,并且可导致兴奋毒作用,最终引起神经元的死亡,而炎性介质TNF−α 和IL−1β 反过来又可以促进NF−κB的活化,引发炎性反应的放大[11]。NF−κB是小胶质细胞的关键驱动器,小胶质细胞中NF−κB信号通路激活可以导致神经炎症,引起神经损伤,而转录组学和生化分析显示,NF−κB不仅存在于小胶质细胞中而且也存在于星形胶质细胞中[12]。由于星形胶质细胞具有与免疫相关的功能,因此推测星形胶质细胞的NF−κB信号通路激活有助于神经炎症级联反应。在本研究中,我们用1µg/mL LPS刺激星形胶质细胞24 h,然后检测炎性因子和NO的水平,实验结果表明,LPS可以促发星形胶质细胞炎性反应,引起NO的释放增加,同时,引起星形胶质细胞分泌IL−6、TNF−α和IL−1β明显增加。为了阐明其可能的机制,我们检测了NF−κB和iNOS的表达,免疫荧光和免疫印迹结果均显示,LPS可以诱导星形胶质细胞NF−κB和iNOS的表达显著增加。
综合以上实验结果,LPS刺激星形胶质细胞导致NF−κB表达增加,活化后的NF−κB进入胞核,启动炎性介质及促炎因子的转录、合成和分泌增加,从而导致神经损伤。因此,研发和使用NF−κB的特异性抑制剂,可以有效抑制CNS炎性反应,为神经炎症患者的治疗提供希望和帮助。

