循环肿瘤DNA在胰腺癌诊治研究进展
贾艳会 杜双双 刘树业
1天津市第三中心医院检验科(天津300170);2天津市人工细胞重点实验室(天津300170);3卫生部人工细胞工程技术研究中心(天津300170)
胰腺癌的发病率和死亡率逐年上升。2019年美国癌症协会颁布的数据显示,胰腺癌的5年生存率仅为9%,在美国位列恶性肿瘤死亡率第4[1]。同年,中国国家癌症中心数据显示,我国每年有9.5 万例胰腺癌新发病例,位列我国恶性肿瘤发病率的第10 位;死亡率在男性和女性肿瘤相关死因中分别居于第6位和第7位[2]。由于缺乏完善、规范的胰腺癌早期诊断体系,导致胰腺癌早期诊断率和手术切除率较低,甚至在切除后,约80%的患者会因残留病变而复发,接受完全切除的患者5年生存率约25%[3],因此早期诊治并准确预测疾病复发对提高预后有重要意义。影像学(CT、MRI 和超声)、血清糖类抗原19-9(CA19-9)和组织活检等在胰腺癌的应用中都有一定的局限性,临床上迫切需要一种简便、灵敏、准确的技术对肿瘤进行动态监测。
近年来,液体活检(liquid biopsies)作为一种新兴的肿瘤无创诊断技术,在肿瘤的诊治及预后中发挥着潜在的优势。液体活检技术主要分析体液中的循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤细胞(circulating tumor cell,CTC)、外泌体(exosomes)等肿瘤相关分子,具有操作简便、快速、非侵入性等优势。液体活检技术中的液体除血液(全血、血清或血浆)外,还包括尿液,唾液,脑脊液等,胰液也是检测胰腺癌的常用液体[4]。液体活检可以反映肿瘤的基因谱,对推进肿瘤诊治的精准化进程具有重要意义。本文就ctDNA 在胰腺癌诊治研究进展作一综述,以期给科研和临床提供一些参考。
1 ctDNA 及其检测技术
所有的细胞都可以通过主动分泌或细胞坏死、凋亡的方式释放DNA 进入循环系统中,这些DNA 统称为游离DNA(cfDNA)。肿瘤细胞在凋亡和坏死过程中释放的DNA称为ctDNA。因此肿瘤患者cfDNA 中包含了正常细胞来源的DNA 片段和肿瘤来源的ctDNA。凋亡cfDNA长度约166 ~200 bp,ctDNA 比凋亡cfDNA 要短[5],约134 ~144 bp。由于正常血细胞凝固时可释放DNA 到血清中,因此血浆比血清更适合检测ctDNA[6]。从抽血到离心分离血浆的时间也很关键,必须在1 h 内完成。ctDNA 浓度受肿瘤负荷的影响,正常情况下,血液中的ctDNA 浓度很低,占整个循环DNA 的0.01%左右,当机体有肿瘤发生时,可高达90%以上[7]。良性病变、炎性疾病和组织损伤时ctDNA 浓度也会增加。ctDNA 半衰期较短,为16 min 至数小时,因此能够反映肿瘤的实时状态[8]。ctDNA 释放到循环中后,会立即通过核酸酶的作用和尿液排泄从循环中清除;此外,肝脏和脾脏对其的吸收和巨噬细胞的降解也可影响循环中的清除。这种短半衰期也使早期癌症中ctDNA 的的检测变得困难。
ctDNA 的检测包括浓度检测和结构(突变、甲基化等)检测。依据检测原理主要分为以选择性扩增法为核心和以测序技术为核心的两类技术[9]。以选择性扩增为核心的技术包括荧光定量PCR、微滴式数字PCR(ddPCR)、扩增阻滞突变系统(ARMS-PCR)、高分辨溶解曲线分析技术(HRM)等(表1),这类方法灵敏度较高,但易发生偏向性扩增,且只可检测已知突变。这些方法在乳腺癌、小细胞肺癌的应用均有报道[10-12],可以指导癌症患者选择靶向药物,为靶向治疗提供临床诊断依据。但在胰腺癌中尚未开展利用ctDNA 指导靶向治疗的相关研究。以测序原理为核心的技术主要包括一代测序的Sanger 测序和二代测序(NGS)(表1)。NGS 在早期肿瘤的筛查和晚期肿瘤的治疗是目前临床应用的主要领域,由于肿瘤的临床NGS 检测仍然是一个未成熟的、充满探索性的领域,现阶段还无法标准化,加之临床应用NGS 测序成本较高,造成NGS 临床推广应用困难[13]。
ddPCR 技术和NGS 技术在液体活检中互为补充:NGS 技术可以发现新的突变,ddPCR 可以对单个突变进行动态分析,二者联合可以检测0.001%稀有突变[14]。BRCA1/2、PALB2、CDKN2A、RBM10、ARID1A 等基因突变被证实与家族性胰腺癌发病密切相关[15-16]。《胰腺癌综合诊治指南(2018版)》[17]指出高通量测序技术联合系统生物学分析对胰腺癌进行分子分型,同时结合动物模型开展药物敏感性的临床前研究,将为胰腺癌“个体化诊疗”提供思路。两种技术结合将会在医学、生物学等领域发挥更大的作用。
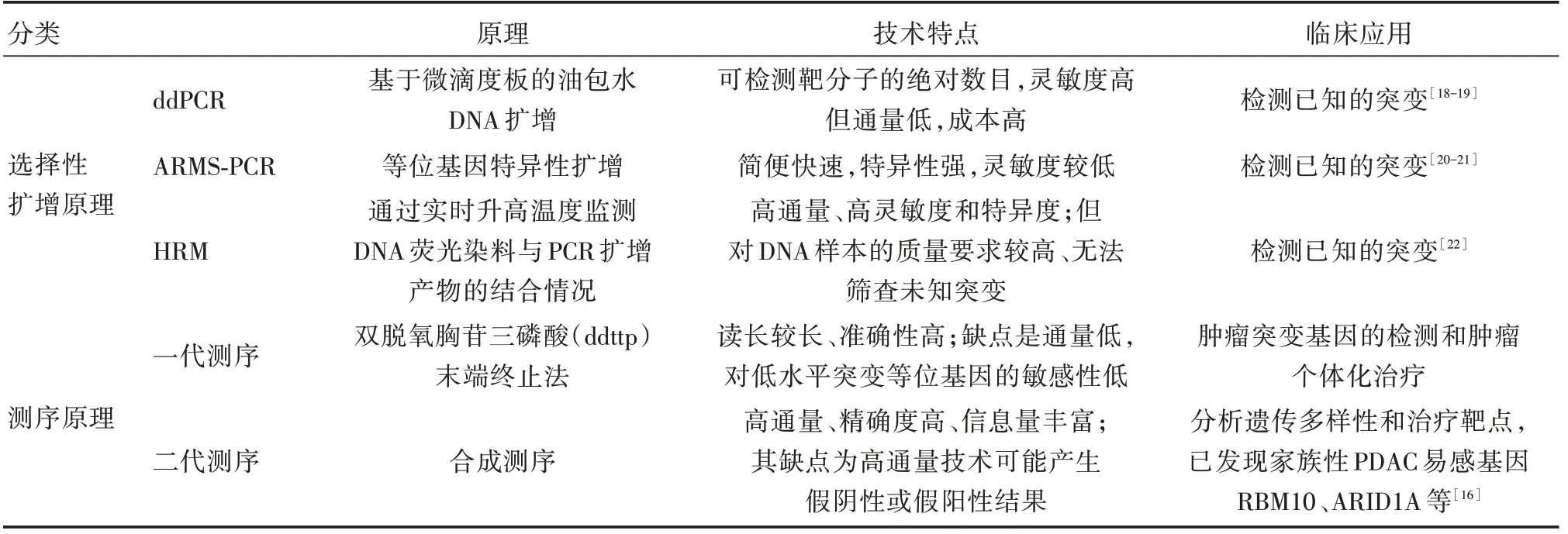
表1 ctDNA 主要分析技术Tab.1 Main analytical techniques of ctDNA
2 ctDNA 在胰腺癌中的应用
2.1 早期诊断和肿瘤分期早期胰腺癌是指肿瘤直径≤2 cm,局限于胰腺内,无胰腺外浸润和淋巴结转移者。胰腺癌的发生与癌基因和抑癌基因的突变密切相关,如KRAS、TP53、SMAD4、CDKN2A等,以KRAS 突变最常见[23],该突变在癌变早期即可发生。胰腺导管腺癌(PDAC)是胰腺癌最常见的类型,约90%的PDAC 可检测到KRAS 突变,但78%的ctDNA 突变不是在原发肿瘤样本中检测到的,这是因为早期胰腺癌血液中ctDNA 浓度较低,检测比较困难;而在肿瘤进展时ctDNA 浓度较高更容易检测到[24]。
KRAS 突变的ctDNA(KRASmutctDNA)的特异度高达96%,但较低的灵敏度限制了其在胰腺癌无症状患者筛查和早期诊断中的应用,因此一些研究常把ctDNA 和蛋白生物标志物联合用于早期胰腺癌的检测。COHEN 等[25]研究表明KRASmutctDNA单独用于检测早期胰腺癌的灵敏度为30%,而将KRASmutctDNA 与蛋白生物标志物(CA19-9、癌胚抗原、肝细胞生长因子和骨桥蛋白)结合,可使灵敏度提高至64%。
异常甲基化状态与肿瘤的发生密切相关,精准的分期是肿瘤诊治和评估预后的基础。HENRIKSEN 等[26]研究结果显示ctDNA 启动子甲基化在胰腺癌发展和恶化过程中积累和改变,对胰腺癌分期有较大的价值。
虽然KRASmutctDNA 和ctDNA 启动子甲基化对诊断早期胰腺癌有重要价值,但2019年8月美国预防服务工作组(USPSTF)指出目前还没有生物标志物被批准用于早期胰腺癌的准确检测[27]。有研究[28]指出ctDNA 可能是胰腺癌晚期生存预测的较好的生物标志物,但在胰腺癌早期诊断中的价值不如CTC 和肿瘤外泌体。
2.2 疗效评估和耐药监测胰腺癌术后辅助化疗可以改善患者生存,因此需要可靠的生物标志物来评估化疗方案。CA19-9 和CT 成像评估化疗方案有一定的局限性,ctDNA 在监测转移性胰腺癌化疗应答中有潜在作用:当治疗失败时,血浆中可检测到耐药胰腺癌细胞的DNA 片段,而失败的治疗又可能会促进基因突变,导致耐药。CHENG等[29]首次在转移性胰腺癌患者的ctDNA 中发现了四种(BRCA2、EGFR、KDR 和ERBB2)有临床意义的基因突变率,其中EGFR 在胰腺癌中过表达提示预后较差;ERBB2 突变与肿瘤进展相关,可在癌细胞亚群中上调。
FOLFIRINOX(奥沙利铂+伊利替康+氟尿嘧啶+亚叶酸钙)疗法是晚期PDAC 患者的一线选择。WEI 等[30]前瞻性纳入38 例接受FOLFIRINOX化疗的晚期PDAC 患者,发现化疗后cfDNA 总浓度的变化与肿瘤负荷有关:在化疗应答的受试者中,特定改变基因座的等位基因片段比例下降;而对该化疗方案耐药的患者,ctDNA 突变等位基因片段(mutant allele fraction,MAF)增加。他们不仅提供了治疗前ctDNA 水平与PDAC 肿瘤负荷相关的证据,也证实了连续的cfDNA 分析是监测化疗应答的有力工具。
Eryaspase(L-天冬酰氨酶包埋于红细胞)是近年来发现的一种新的治疗方法,联合吉西他滨或FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)可作为转移性胰腺癌的二线治疗方案。BACHET 等[31]前瞻性搜集晚期胰腺癌患者治疗前、后的血浆,评估ctDNA 对Eryaspase 治疗胰腺癌预测和预后的价值,最后得出结论:ctDNA 的基线水平是无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)的一个独立的预后因素;ctDNA 水平的早期变化与治疗效果有关,因此ctDNA可以做为评估Eryaspase 对晚期胰腺癌患者疗效的生物标志物。
除化疗外,胰腺癌治疗还包括免疫治疗和不可逆性电穿孔等方法,ctDNA 在这些治疗中的应用也有报道[32-33],不过目前多在临床试验阶段。ctDNA 可用于监测治疗的应答和耐药性,并能比组织活检更好地捕获肿瘤异质性,因此化疗过程中ctDNA 可能是早期治疗效果的预测性生物标志物。
2.3 识别术后MRD、预测复发及评估生存期PDAC 术后较高的复发率是PDAC 高死亡率的原因之一。常规术后监测方法包括临床症状、CA19-9 等肿瘤标志物和CT 成像对微小残留病变(minimal residual disease,MRD)缺乏敏感性和特异性,因此迫切需要一种可靠的方法来识别MRD 并预测复发风险。研究表明ctDNA 可以识别MRD,对预测肿瘤复发具有较高的敏感性。SAUSEN 等[34]应用ddPCR 技术检测早期胰腺癌患者血浆发现:术后检出ctDNA 的患者比未检出ctDNA 的患者更易复发;ctDNA 预测复发的平均时间为3.1 个月,而CT确定复发的平均时间为9.9 个月,因此胰腺癌患者术后血浆ctDNA 可以较早预测外科术后是否有病灶残留或疾病复发。GROOT 等[35]不仅有相同的结论,还评估了ctDNA 预测PDAC 术后复发的准确性,准确率为89%,他们的研究证实ctDNA 检测是PDAC 术后复发的准确预测因子。
JIANG 等[36]分析PDAC 患者术前及术后血浆ctDNA,结果发现ctDNA 检出率随PDAC 分期的增加而增加;ctDNA 的最大变异等位基因分数(variant allelic fraction,VAF)与肿瘤最大直径正相关;术后ctDNA 阳性是无病生存期(disease free survival,DFS)的独立因素。因此术后监测ctDNA 可以识别MRD,从而预测复发的风险。PIETRASZ 等[37]研究结果表明ctDNA 与DFS 和OS 负相关,是晚期胰腺癌患者一个独立的预后生物标志物。HADANO等[38]有类似的发现。但他们只证实了ctDNA 阳性提示预后不良,均未分析术后及治疗后ctDNA 浓度变化。BETTEGOWDA 等[39]则进行了ctDNA 浓度方面的相关研究,结果表明生存率随ctDNA 浓度的增加而下降。因此动态监测ctDNA 浓度可以尽早区分疾病稳定和病情进展,评估预后。
综上,检测胰腺癌患者术前和术后血浆ctDNA 有非常重要的意义:如果胰腺癌患者术前的血浆中检测到ctDNA,则可选择术前化疗而避免不必要的开腹手术;若胰腺癌患者术后血浆中未检测到ctDNA,则需考虑更强的辅助治疗方案,这既有助于对高危患者提供充分的辅助治疗,又可避免对低危患者的过度治疗[40]。
3 总结与展望
精准的个体化治疗是癌症治疗的新目标。在个体化理念下,胰腺癌的精准治疗需要全面评估患者个体差异如伴随的基础疾病,以及肿瘤个体差异如大小、数目、播散转移及血管浸润等情况,以实现治疗的精准化,提高患者生活质量。ctDNA代表了肿瘤细胞的基因组信息,可以反映患者整体疾病的基因组状态,为精准医疗和制定胰腺癌个体化治疗方案提供了一新的参考模式。然而迄今为止,经FDA 批准的ctDNA 检测只可用于转移性和局部进展期非小细胞肺癌(NSCLC)及晚期乳腺癌等极少数癌症[41]。要实现ctDNA 对早期肿瘤尤其是早期胰腺癌的筛查和诊治还面临一些挑战,具体如下:(1)ctDNA 检测缺乏标准化的技术规范:2019 国家卫生健康委临床检验中心开展的ctDNA 室间质评共计173 个假阳性、67 个假阴性突变结果,因此ctDNA 检测质量仍有待提高[42]。(2)缺乏高灵敏度的检测方法:胰腺癌早期(Ⅰ期、Ⅱ期)ctDNA 检出率不超过30%[43];2019 国家卫生健康委临床检验中心开展的ctDNA 室间质评中,cfDNA 平均提取效率仅为41.5%,因此亟需高灵敏度的检测方法[42]。(3)目前可尝试用于治疗胰腺癌的分子靶点不多,加之胰腺癌具有较强的肿瘤异质性和功能复杂的间质成分,其基于基因测序进行精准治疗的难度更大[44]。如何从血液中分离足量、高质量的cfDNA,并将ctDNA 从正常的cfDNA中区分出来,这是研究ctDNA 的关键。临床需要建立指导方针和标准操作程序,积极开展临床多中心研究,从而使ctDNA 成为肿瘤精准治疗一个强大的科研和临床工具。

