固相萃取-高效液相色谱-质谱联用检测牛奶中地塞米松残留
任宏彬 花 锦 杨蒲晨 杨晓伟 贾晓婷 张志华
(太原海关技术中心,太原030024)
地塞米松是一种人工合成的皮质类固醇,具有消炎、抗病毒、促进泌乳等多种功效,在养殖业中被大量使用,造成不同程度药物残留,人体摄入过量可能会引起激素代谢紊乱、肥胖、骨质疏松等病症,并可能产生致畸、致癌等风险[1~5]。根据我国GB 31650-2019 《食品安全国家标准 食品中兽药最大残留限量》 规定,地塞米松在牛奶中的最大残留限量为0.3 μg/kg[6]。因此,为保障牛奶饮用安全,有必要建立一种安全、有效地分析牛奶中地塞米松残留的方法。
目前,地塞米松检测手段主要包括酶联免疫法[7]、气相色谱法[8~9]、气相色谱-质谱法[10]、液相色谱法[11~12]和液相色谱-质谱法[13~14]等。其中,液相色谱-质谱联用法因其具有灵敏度高、特异性强、分析速度快等优点,成为兽药残留检测最有效的方法,被广泛应用于牛奶中地塞米松残留的检测[15~18]。本文基于农业部1031号公告-2-2008 《动物源性食品中糖皮质激素类药物多残留检测 液相色谱-串联质谱法》[19],通过简化色谱条件,对比两种样品前处理方法的提取效果,改进标准曲线的绘制方式,旨在建立一种安全、高效、稳定的检测牛奶中地塞米松残留的方法,为相关研究提供借鉴。
一、材料与方法
(一)材料与试剂学生饮用奶,大同市牧同乳业有限公司; 地塞米松标准品 (纯度98.7%),Bepure 公司; 甲醇、正己烷、乙酸乙酯 (色谱纯),北京迪马欧泰科技发展中心; 丙酮 (分析纯),天津市科密欧化学试剂有限公司; Silica 固相萃取柱(500 mg/3 mL)、有机滤膜 (0.22 μm),上海安谱实验股份科技有限公司。
(二)仪器与设备LC-30AD 高效液相色谱,LCMS-8050 三重四极杆串联质谱仪 (配有电喷雾离子源ESI),日本Shimadzu 公司; ST40R 高速冷冻离心机,美国Thermo 公司; vortex genie 2 涡旋混合器,美国SI 公司; LE244S 电子天平,德国Sartorius 公司。
(三)试验设计
1.标准溶液的配制。准确称取地塞米松标准品用甲醇溶解配制成浓度为100 μg/mL 的标准贮备液。称取5 份阴性牛奶样品2.00 g,分别准确加入稀释后的标准贮备液,按照下文步骤进行样品前处理,以最终定容体积得到浓度为1、2、5、10、50 ng/mL 的标准工作液。
2.样品前处理。(1)提取。称取牛奶样品2.00 g 于50 mL 聚丙烯离心管中,加10 mL 乙酸乙酯,涡旋混匀3 min,超声提取10 min,以8000 r/min离心5 min,移取上层乙酸乙酯,在40℃水浴下氮气吹干,加3 mL 乙酸乙酯-正己烷(1∶5,V∶V)振荡溶解残渣,待净化。(2)净化。将溶解液转移到固相萃取柱上 (使用前以3 mL 正己烷进行活化),自然流干,以3 mL 正己烷淋洗,抽干。加3 mL 正己烷-丙酮(6∶4,V∶V)洗脱,收集洗脱液,在40℃水浴下氮气吹干,以20%乙腈水溶液定容至1 mL,过滤膜后待上机分析。
3.色谱条件。色谱柱为Shim-pack GIST C18(100×2.1 mm,2 μm); 柱流量为0.3 mL/min; 柱温40℃; 流动相A 为0.1%甲酸水溶液,流动相B为乙腈,等度洗脱,流动相比例A∶B 为50∶50;进样体积为10 μL。
4.质谱条件。扫描方式为负离子扫描; 接口电压4.0 kV; 雾化气为氮气,3 L/min; 加热气流量为10 L/min; DL 温 度 为250℃; 加 热 块 温 度 为400℃; 碰撞气为氩气,270 kPa; 检测方式为多反应检测(MRM)模式。质谱参数见表1。

表1 MRM 质谱参数
二、结果与讨论
(一)色谱条件的优化农业部1031号公告-2-2008 标准[19]中通过3 种流动相 (水-乙腈-甲酸水)对多种糖皮质激素类药物进行梯度洗脱。考虑到本试验仅需检测地塞米松,因此,简化为2种流动相0.1%甲酸水-乙腈 (50∶50,V∶V)进行等度洗脱,结果如图1 所示,在此条件下,目标物在2 min 前出峰,峰型良好,有效节约了分析时间。
(二)质谱参数的优化以5 ng/mL 地塞米松进行扫描,对其母离子、子离子、碰撞能量等条件进行优化,使分子离子和特征碎片离子强度达到最大,选择丰度最高的碎片离子作为定性与定量特征离子,优化后的质谱参数见表1。
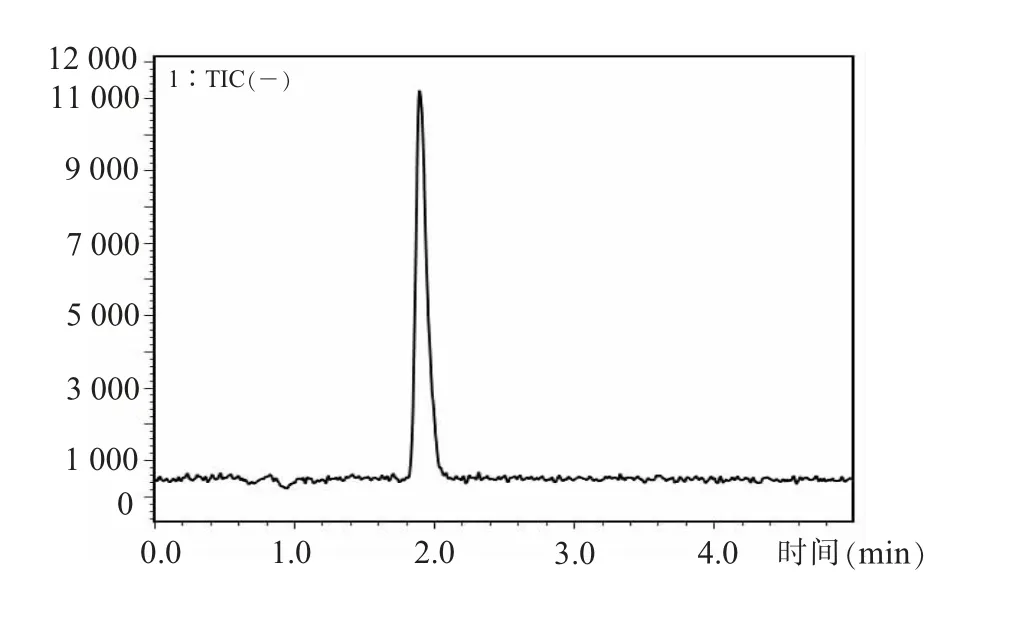
图1 5 ng/mL 地塞米松的总离子流色谱图
(三)前处理方法的对比验证据文献报道,正己烷脱脂法[20]是将待净化滤液以正己烷脱脂,定容过膜后上机检测,相较于固相萃取法,在保证检测结果准确性的前提下,可有效节约样品前处理时间和试验成本。为验证正己烷脱脂法和固相萃取法的差异,选取阴性牛奶样品,在加标浓度5 μg/kg下,分别按照文献中的正己烷脱脂法和本试验中的固相萃取法对样品进行前处理后上机检测,结果如图2 所示。

图2 两种前处理方法加标检测结果质谱图对比
由图2 中2 种前处理方法加标检测结果质谱图对比可知,在相同加标浓度下,正己烷脱脂法检测结果存在明显的杂峰干扰,且目标峰强度相对较低; 而固相萃取法检测结果目标峰峰型尖锐对称,响应强度高,杂峰干扰小,更有利于定量分析。另外,在前处理过程中发现,正己烷脱脂法在脱脂后,滤液呈白色浑浊状态,过滤膜时阻力较大,说明存在大颗粒杂质,上机液呈白色半透明状,存在阻塞管路、污染离子源的可能; 而固相萃取法定容后的滤液和过滤膜后的上机液均澄清透明,更有利于对仪器的保护。虽然正己烷脱脂法可在一定程度上节约时间和试验成本,但从峰型、响应强度和仪器安全风险角度考虑,选择固相萃取法更为可靠。
(四)标准曲线绘制和精密度试验在痕量分析中,样品前处理过程常常伴随着目标物的损失,影响分析结果的准确性,同位素内标法[21]可有效降低这一影响,但同位素内标往往价格昂贵,大幅提高了试验成本。因此,采用两种方式进行定量。方式1 采用外标法,参考农业部1031号公告-2-2008 标准[19]要求,准确移取地塞米松标准储备液,以20%乙腈水溶液稀释,配制成浓度为1、2、5、10、50 ng/mL 的系列浓度标准工作液; 方式2 采用标准加入法,按照本试验所述标准溶液的配制步骤操作。将两组标准工作液上机检测,以目标化合物峰面积(Y)与浓度(X)进行线性回归,绘制标准曲线,结果见表2。
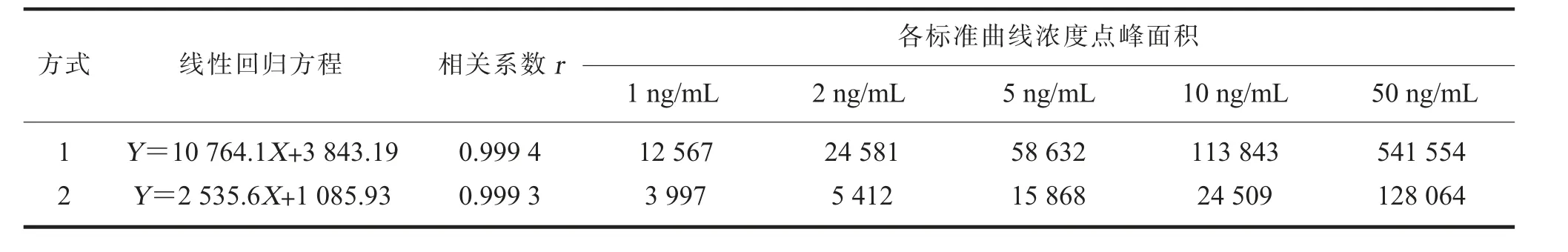
表2 地塞米松的两种标准曲线绘制方式的线性回归方程
由表2 可知,两种标准曲线绘制方式的线性关系良好,但各浓度点峰面积差别较大,方式1 是方式2 对应标准浓度点峰面积的3~5 倍,表明受样品前处理过程的影响,目标物损失较为明显。为进一步验证两种标准曲线绘制方式的适用性,在线性范围内选择0.5、2.5、5.0 μg/kg 水平加标浓度(每个浓度点平行测定6 次),按照本试验所选择的固相萃取法进行前处理后上机检测,分别代入上述两条标准曲线进行线性拟合,考查回收率和相对标准偏差,结果见表3。

表3 地塞米松在三水平加标浓度下的回收率及精密度 (%)
由表3 可知,3 水平加标检测结果代入方式1所绘制的标准曲线中,平均回收率<20%,RSD>10%,无法满足实验要求; 代入方式2 所绘制的标准曲线中,平均回收率在65.7%~85.7%,RSD<10%,满足农业部1031号公告-2-2008 标准[19]中关于地塞米松在牛奶样品中的回收率 (50%~120%)及精密度(<20%)要求。因此,选择标准加入法定量结果更为准确。
(五)方法定量限和检出限准确移取稀释后的地塞米松标准贮备液逐级递减添加到空白样品中,按照上文选择的固相萃取法和条件进行处理和分析,以10 倍信噪比作为定量限,如图3 所示,加标浓度为0.25 μg/kg 可作为地塞米松在牛奶中的定量限,依据定量限为3 倍检出限原则,得到方法检出限约为0.08 μg/kg,满足农业部1031号公告-2-2008 标准[19]中关于地塞米松在牛奶样品中的灵敏度(定量限0.2 μg/L)要求。
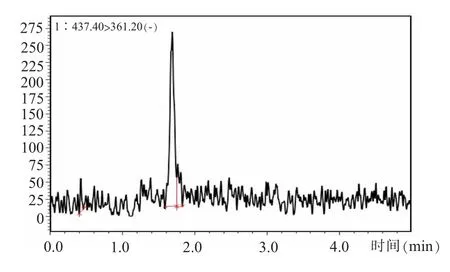
图3 牛奶中地塞米松加标浓度为0.25 μg/kg 时检测结果质谱图
(六)样品检测抽取当地中小学的牛奶样品14 份,采用本方法对其地塞米松残留进行测定,与农业部1031号公告-2-2008 标准[19]中的检测方式和定量方法相比,可有效节约试验成本,提高分析准确度。结果均未检出地塞米松残留,满足食品安全国家标准关于牛奶中地塞米松最大残留限量的要求。
三、结论
本研究通过简化农业部1031号公告-2-2008标准[19]中的流动相组合,缩短分析时间,优化质谱参数,对比两种样品前处理方法,改进标准曲线绘制方式,建立了检测牛奶中地塞米松残留的固相萃取-高效液相色谱-质谱联用分析方法。该方法经济、简便、可靠,能够满足实验室对批量牛奶样品中地塞米松残留的检测要求。

