僵蚕碱溶性蛋白质的提取工艺优化及指纹图谱分析
朱锐灵 黄佳滢 刘莹
摘要:建立稀碱法提取僵蚕蛋白质的最佳工艺,并对其进行相应SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)指纹图谱分析。单因素考察缓冲液pH值、液料比、提取时间和提取温度对僵蚕碱溶性蛋白质提取率的影响,随后以Box-Behnken組合设计响应面优化,对试验结果进行回归拟合分析,获得上述因素对碱溶性蛋白质提取率的量化关系,确定最佳提取条件,并对提取的碱溶性蛋白质进行SDS-PAGE指纹图谱分析。结果表明最佳提取工艺条件为:Tris-HCl(三羟甲基氨基甲烷盐酸盐)缓冲液pH值8.0、液料比58 mL ∶ 1 g,提取温度为40 ℃,提取时间为 205 min,此时碱溶性蛋白质提取率可达2.29%。SDS-PAGE指纹图谱结果表明僵蚕碱溶性蛋白质含有29.85、27.28 ku 2条迁移率相近的高丰度特征性条带,分别占总蛋白量的36.37%、32.65%,同时还有78.8、69 ku较高丰度特征性条带,该指纹图谱具有种属特异性。本研究建立了僵蚕碱溶性蛋白质的最佳提取工艺条件,所得SDS-PAGE指纹图谱可为僵蚕药材的分子鉴定提供参考依据。
关键词:僵蚕;碱溶性蛋白质;响应面;提取工艺;指纹图谱
僵蚕(Bombyx Batryticatus)为蚕蛾科昆虫家蚕(Bombyx mori L.)4~5龄的幼虫感染(或人工接种)白僵菌[Beauveria bassiana (Bals.) Vuillant]而致死的干燥体,为我国常用的大宗动物类中药材[1]。因其息风止痉、祛风止痛、化痰散结的功效,僵蚕常用于抽动障碍、支气管哮喘、顽固性蛋白尿及多种儿科疾病的临床治疗,且疗效甚佳[2-3]。由于僵蚕售价较高,市场常见增质量僵蚕、绿僵蚕、黄僵蚕、鼓炒僵蚕等伪品出售,严重影响临床用药的安全性与有效性[4]。
当前僵蚕主要由药工依其身直、肥壮、质坚、色白、断面光亮程度鉴别真伪及划分等级。此外,赵建国等用红外光谱法鉴别僵蚕[5],张丽增等用薄层法鉴别僵蚕及含有僵蚕的中成药[6],贾静等建立了僵蚕药材的DNA条形码,为建立相应分子鉴定技术提供了参考[7]。僵蚕含有丰富的蛋白质,但未有系统提取工艺及特征种属蛋白质研究的报道。本研究旨在建立僵蚕蛋白质的稀碱法提取工艺,并以Design-Expert软件进行响应面优化,进而建立僵蚕碱溶性蛋白质的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)指纹图谱,为后续研究基于蛋白质组成的僵蚕分子鉴定技术提供依据。
1 材料与方法
1.1 材料与试剂
僵蚕于2019年购自安徽亳州中药材市场(批号9-23539),经江苏大学药学院欧阳臻教授鉴定为蚕蛾科昆虫家蚕4~5龄的幼虫感染(或人工接种)白僵菌而致死的干燥体。
牛血清白蛋白(BSA)、Bradford蛋白浓度测定试剂盒[生工生物工程(上海)股份有限公司];蛋白质分子量标准品(上海碧云天生物技术有限公司);丙烯酰胺、N,N′-亚甲双丙烯酰胺、十二烷基硫酸钠、考马斯亮蓝R-250(中国医药集团有限公司)。
1.2 仪器与设备
CS-700高速智能粉碎机(武义海纳电器有限公司)、SpectraMax 190酶标仪(美国Molecular devices公司)、H1650-W台式微量高速离心机(湘仪离心机仪器有限公司)、FE20型实验室pH计(Mettler Toledo 公司)、垂直电泳槽VE-180(上海天能科技有限公司)、DYY-6C稳流稳压电泳仪(南京驰顺科技发展有限公司)、GenoSens 2100凝胶成像系统(上海勤翔科学仪器有限公司)。
1.3 试验方法
1.3.1 蛋白质提取 僵蚕药材水洗后40 ℃烘干,打粉后过70目筛,称取适量僵蚕粉末,按预设液料比加入0.1 mol/L Tris-HCl(三羟甲基氨基甲烷盐酸盐)缓冲液,50 ℃水浴振荡,到预设提取时间后以9 700 g离心10 min,上清即为碱溶性蛋白质样品。
1.3.2 蛋白质提取率测定 以考马斯亮蓝(Bradford)法测定蛋白质含量,牛血清白蛋白溶液作为蛋白质工作液,测定溶液的D595 nm[8-9]。以蛋白质浓度为横坐标x,吸光度为纵坐标y,绘制标准曲线,得到回归方程y=2.925 7x+0.191 3(r2=0999 3)。对“1.3.1”节所述蛋白质样品进行相应的处理,测定D595 nm值,依据标准曲线可得蛋白质含量,按式(1)计算蛋白质提取率。
蛋白质提取率=提取液中的蛋白质质量僵蚕粉末质量×100%。(1)
1.3.3 单因素试验 (1)pH值对僵蚕蛋白质提取率的影响试验。固定提取温度50 ℃,提取时间 200 min,液料比40 mL ∶ 1 g,Tris-HCl缓冲液pH值分别设置为7.0、7.5、8.0、8.5、9.0。(2)液料比对僵蚕蛋白质提取率的影响试验。固定Tris-HCl缓冲液pH值8.0,提取温度50 ℃,提取时间 200 min,液料比分别设置为10 mL ∶ 1 g、25 mL ∶ 1 g、40 mL ∶ 1 g、55 mL ∶ 1 g、70 mL ∶ 1 g。温度对僵蚕蛋白质提取率的影响试验:固定提取时间200 min,Tris-HCl缓冲液pH 值为8.0,液料比为55 mL ∶ 1 g,提取温度分别设置为30、40、50、60、70 ℃。(3)时间对僵蚕蛋白质提取率的影响试验。固定提取温度40 ℃,Tris-HCl缓冲液pH值为 80,液料比为 55 mL ∶ 1 g,提取时间分别为100、150、200、250、300 min。
1.3.4 响应面试验 采用Design-Expert(8.0.6.1)软件,根据Box-Behnexn设计响应面试验,以Tris-HCl缓冲液pH、液料比、提取温度、提取时间4个因素为自变量,僵蚕碱溶性蛋白质提取率为响应值,设计4因素3水平响应面分析试验,其因素与编码水平见表1。
1.3.5 SDS-PAGE分析 利用最佳条件下提取得到的僵蚕提取液,向其中加入体积分数为10%的三氯乙酸(TCA),涡旋,14 000 r/min离心10 min,弃溶液。加入适量丙酮后,再次涡旋,离心,得到僵蚕碱溶蛋白质。加裂解液,置于4 ℃冰箱中待其充分溶解,加上样缓冲液,沸水浴煮沸10 min,即得到蛋白质电泳样品。制备5%浓缩胶和14%分离胶,80 V 恒压电泳,直至溴酚蓝指示剂距离凝胶底部05 cm处,停止电泳,剥凝胶,进行固定、染色、脱色[10]。
1.3.6 凝胶分析 使用凝胶成像仪对凝胶拍照,用Quantity One软件计算僵蚕碱溶性蛋白质的分子量和灰度值,按式(2)计算各蛋白质的含量。
蛋白质含量=待测蛋白质灰度值蛋白质总灰度值×100%。(2)
2 结果与分析
2.1 单因素试验结果分析
蛋白质为兼性分子,缓冲液pH值可以显著影响其溶解度。考察pH值为 7.0~9.0时僵蚕碱溶性蛋白质的提取率变化,结果见图2-A。在pH值为7.0~8.0之间,碱溶性蛋白质的提取率随着pH值的升高而增加,当pH值达到8.0时提取率为最高,随后提取率随pH值升高而逐步降低。因此,缓冲液pH值为 8.0为最适条件。
缓冲液体积越大,越有利于蛋白质的溶出,但过高的液料比会导致后处理较为困难。考察液料比为(10~70) mL ∶ 1 g时僵蚕碱溶性蛋白质提取率变化,结果见图2-B。在一定范围内,随着提取液体积的增大,僵蚕碱溶性蛋白质的提取率呈上升趋势,液料比为55 mL ∶ 1 g时提取率达到最大值。进一步提高液料比,蛋白质提取率反而呈下降趋势,因此,液料比55 mL ∶ 1 g为最适条件。
提取温度升高可以加速蛋白质溶出,且增加其溶出量。考察提取温度为30~70 ℃时僵蚕碱溶性蛋白质提取率变化,结果如图2-C所示。在30~40 ℃的范围内,蛋白质提取率逐渐增加,40 ℃时达到最大值。进一步升高提取温度则导致蛋白质提取率逐步降低,可能由温度升高导致僵蚕蛋白质变性所致,因而最适提取温度为40 ℃。
提取时间延长可以增加蛋白质溶出量。考察提取时间为100~300 min时僵蚕碱溶性蛋白质提取率变化,结果见图2-D。提取时间在100~200 min 內时,提取率呈直线式上升趋势;提取时间超过200 min后,提取率却随着提取时间的延长而缓慢下降。因此最佳提取时间为200 min。
2.2 响应面分析及优化条件
根据单因素试验结果,设计响应面优化试验(表1),综合考察缓冲液pH值、液料比、提取温度和提取时间对蛋白质提取率的影响,试验结果见表2,僵蚕蛋白质提取率在1.495%~2.275%。
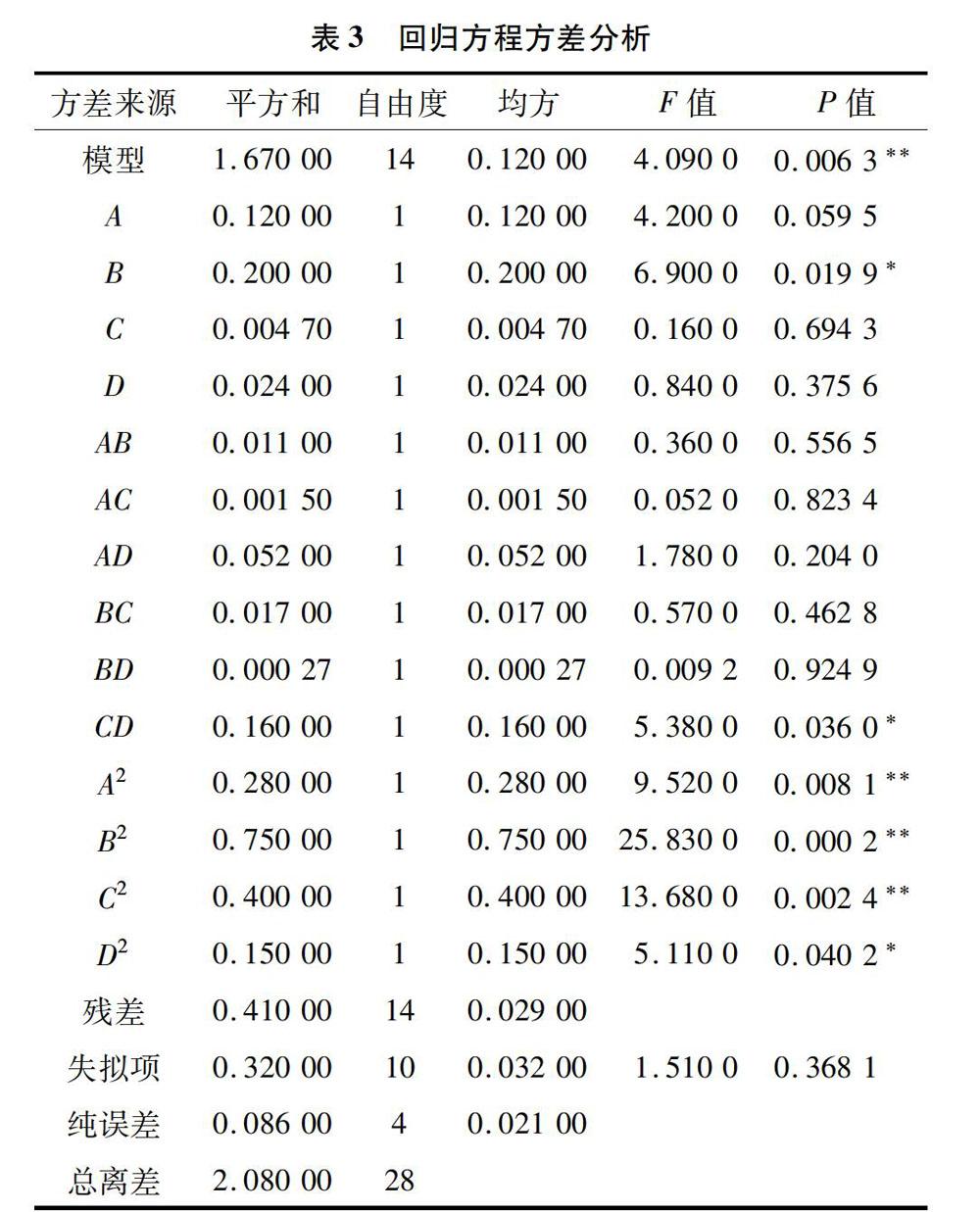
对二次回归方程进行方差分析,结果见表3。从表3可知,回归模型具有极显著性(P<0.01),失拟项不显著(P>0.05),可知该回归模型可以较好地拟合实测值。在此次试验中,一次项B影响显著,二次项A2、B2和C2对蛋白质提取率影响极显著,交互作用项除CD外P值均大于0.05,表明交互作用不显著。4个单因素对蛋白质提取率的影响顺序为液料比>提取液pH值>提取时间>提取温度。
2.3 响应曲面的分析
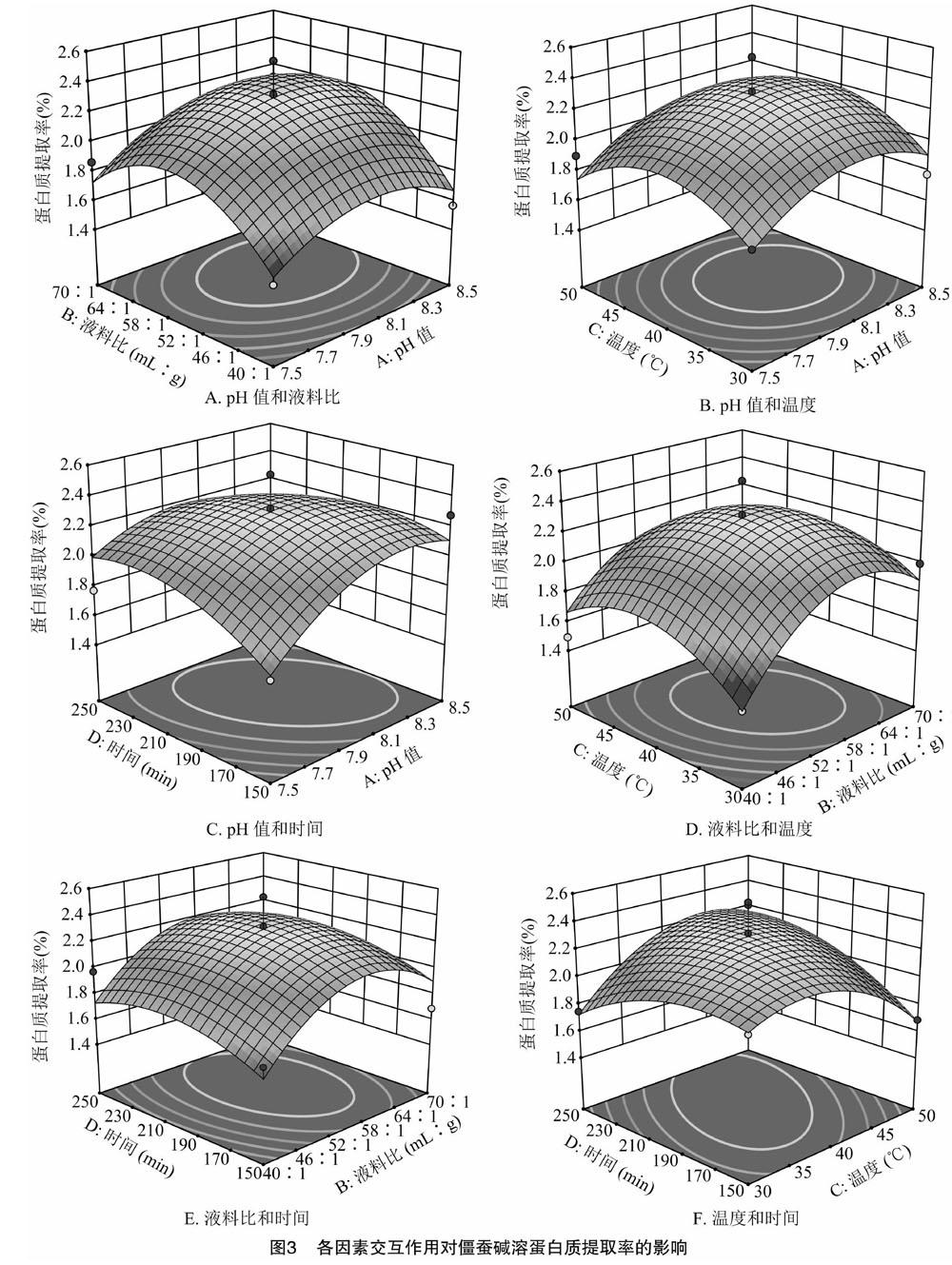
利用Design-Expert 8.0.6.1软件对回归方程进行分析,得到等高线和响应曲面,见图3,考察4个因素及两两因素的交互作用对僵蚕蛋白质提取率的影响。
由图3-A可知,液料比的曲面较陡,说明对僵蚕蛋白质的提取率影响显著;pH值的曲面比较平缓,且随着pH值的增加,蛋白质提取率先增加后降低。等高线形状呈椭圆形,表明pH值和液料比的交互作用显著。由图3-B可知,随着pH值的增加与温度的升高,蛋白质提取率先上升后下降,从2个因素的曲面来看,说明pH值对蛋白质提取率的影响比温度更大。等高线呈圆形,证明pH值和温度的交互作用不显著。由图3-C可知,随着提取的时间延长,提取率先增加后略微降低;等高线图表明2个因素的交互作用显著。由图3-D可知,响应面反映出蛋白质提取率随着液料比的增加先上升后下降;从等高线可知,沿液料比轴向等高线比沿温度轴向等高线密集,表明液料比对蛋白质提取率影响更明显。由图3-E可知,时间对蛋白质提取率的影响没有液料比显著,等高线图的形状为圆形,说明两因素的交互作用不显著。由图3-F可知,随着时间延长和温度提高,蛋白质提取率均呈现先增加后减少的趋势。等高线图可表明时间和温度的交互作用显著。
2.4 验证试验
通过响应面回归模型,确定提取僵蚕蛋白质的最佳条件:pH 值为8.12,液料比为58.03 mL ∶ 1.00 g,温度40.06 ℃,时间204.49 min。在此条件下,预测其提取率值2.33%。考虑实际操作,设置条件为:pH 值8.0,液料比58 mL ∶ 1 g,温度40 ℃,时间 205 min,此时平均提取率为2.29%,与理论值基本吻合。
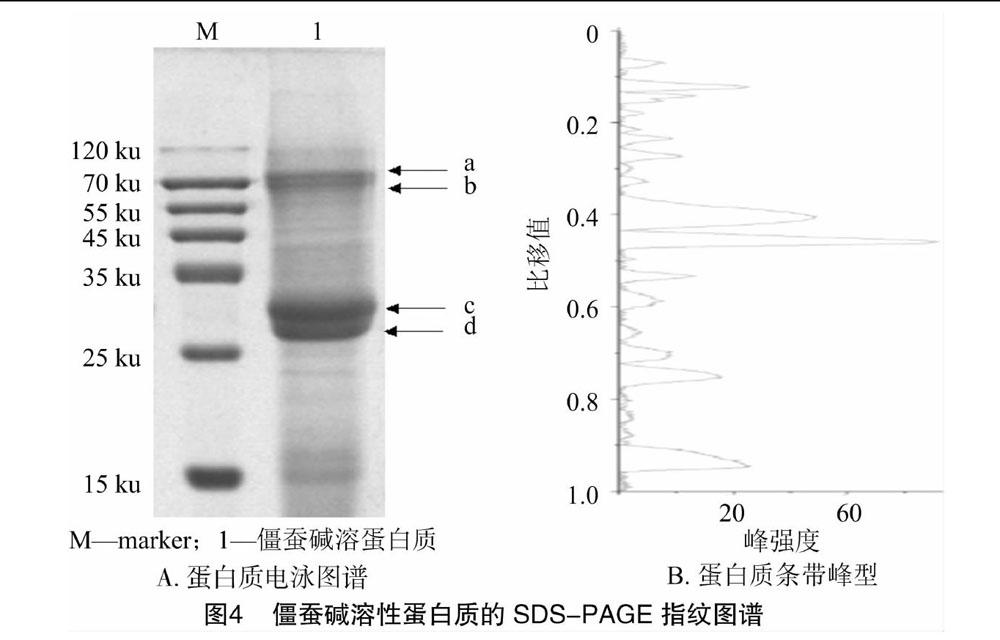
2.5 SDS-PAGE指纹图谱分析
SDS-PAGE在蛋白质的量化、比较及特性鉴定中是一种经济、方便和重复性好的方法[11-13]。僵蚕碱溶性蛋白质的SDS-PAGE指纹图谱结果(图4)表明,僵蚕蛋白质含有29.85 ku(c)与27.28 ku(d)的 2 条迁移率相近的高丰度特征性条带,分别占总
蛋白量的36.37%与32.65%,同时还有78.8 ku(a)和69 ku(b)的较高丰度特征性条带。范玮等进行的僵蚕、蜈蚣、土鳖虫的蛋白质指纹图谱对比研究,也表明了上述条带的种属特异性[14]。由图4可知,26~120 ku区间至少可观察到11条蛋白质条带,25 ku 以下区间还至少可观察到12条蛋白质条带,分辨率优于已有文献报道的结果。
3 结论与讨论
近年来,已有很多响应面法优化蛋白质提取工艺的报道。田景民等利用响应面法优化沙棘籽渣水溶性蛋白质的提取工艺[15];王岸娜等采用响应面
法优化超声辅助提取猕猴桃糖蛋白,与传统提取法相比较,明显缩短时间且蛋白得率提高[16];刘合生等采取响应面法优化水飞蓟子中的可溶性蛋白质提取工艺[17];张红霞等采用响应面法优化苦荞蛋白质的提取工艺,使其提取率达到1.27%[18]。本研究首次尝试稀碱法提取僵蚕蛋白质,在单因素试验基础上对提取工艺进行响应面优化,确定了僵蚕碱溶性蛋白质的最佳提取条件:缓冲液pH 值为8.0,液料比为58 mL ∶ 1 g,提取温度为40 ℃,提取时间为205 min。此时僵蚕蛋白质提取率为229%。验证试验表明实际值与理论值相吻合,证明响应面法可以有效优化僵蚕蛋白质提取条件,为充分利用僵蚕蛋白质资源提供科学依据。本研究同时建立的僵蚕碱溶性蛋白质SDS-PAGE指纹图谱,为开发基于蛋白质的僵蚕分子鉴定方法提供了参考依据,也为其他动物类中药材的鉴定提供思路。
参考文献:
[1]国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社,2015.
[2]张 玉. 胡国俊名老中医治疗支气管哮喘经验的数据挖掘研究[D]. 合肥:安徽中医药大学,2014.
[3]孙鲁艳,李庆朋,赵丽丽,等. 丁元庆教授治疗抽动障碍用药规律的挖掘分析[J]. 中国中药杂志,2015,40(16):3314-3318.
[4]武汗青. 白僵蚕化学成分及应用研究进展[J]. 河南农业,2015(3):27-27.
[5]赵建國,曲伟红,石向群. 傅里叶变换红外光谱法鉴定中药僵蚕[J]. 九江学院学报(自然科学版),2016,31(3):98-100.
[6]张丽增,代云桃,秦雪梅,等. 僵蚕薄层鉴别方法的改进[J]. 中国药品标准,2006,7(4):61-62.
[7]贾 静,石林春,姚 辉,等. 市售动物药材僵蚕的DNA条形码鉴定研究[J]. 药学学报,2016,51(11):1784-1790.
[8]王福荣. 生物工程分析与检验[M]. 北京:中国轻工业出版社,2005.
[9]柳 荫,吴凤智,陈 龙,等. 考马斯亮蓝法测定核桃水溶性蛋白含量的研究[J]. 中国酿造,2013,32(12):131-133.
[10]闻崇炜,毛春友,胡萍萍,等. Tricine蛋白质电泳定量检测溶菌酶方法的研究[J]. 江苏农业科学,2012,40(5):290-292.
[11]尚宏丽,孟 鑫,张 挺. 薏米蛋白提取及其SDS-PAGE电泳分析[J]. 中国农学通报2012,28(18):260-265.
[12]姜先刚,赵 雨,张 巍,等. 人参水溶性蛋白SDS-聚丙烯酰胺凝胶电泳指纹图谱研究[J]. 药物分析杂志,2008,28(6):873-876.
[13]李莹莹,吴彩娥,杨剑婷,等. 白果蛋白质提取及SDS-PAGE分析[J]. 食品科学,2010,31(22):43-47.
[14]范 玮,余伯阳,刘吉华. 3种虫类药材蛋白指纹图谱的建立[J]. 药物生物技术,2014,21(6):511-514.
[15]田景民,陈贵林. 响应面法优化沙棘籽渣水溶性蛋白质提取工艺研究及其氨基酸组成分析[J]. 食品安全质量检测学报,2016,7(3):1321-1329.
[16]王岸娜,崔文慧,吴立根,等. 响应面法优化超声辅助提取猕猴桃糖蛋白[J]. 粮食与油脂,2018,31(6):14-19.
[17]刘合生,胡瑞斌,戚向阳.响应面法优化的水飞蓟子可溶性蛋白质提取工艺[J]. 湖北农业科学,2011,50(20):156-161.
[18]张红霞,赖佳慧,王 倩,等. 响应面法优化苦荞蛋白质提取工艺[J]. 粮食科技与经济,2019,44(8):93-96.陈 丽,夏兴隆,卜树坡,等. 基于LoRa的低功耗水产养殖监测系统设计[J]. 江苏农业科学,2021,49(3):176-182.

