黔产五种卷柏黄酮含量测定及其对α-葡萄糖苷酶抑制活性研究
晏英 王丹 陈洁 唐攀 陈文章 廖伟科 杨小生
摘 要:建立中药卷柏特征成分总黄酮及穗花杉双黃酮的快速含量分析方法,比较不同卷柏药材中的含量及活性差异。采用紫外分光光度法和高效液相色谱法分别测定卷柏总黄酮和穗花杉双黄酮含量;通过建立体外α-葡萄糖苷酶抑制模型,对卷柏活性部位进行活性测试。不同卷柏中总黄酮含量在1.48%~2.67%之间,穗花杉双黄酮含量在0.49%~0.93%之间,活性部位的总黄酮含量在9.14%~16.46%之间,穗花杉双黄酮含量在2.26%~4.74%之间。卷柏活性部位的α-葡萄糖苷酶活性为:垫状卷柏IC50 6.56 μg/mL;疏叶卷柏IC50 4.47 μg/mL;兖州卷柏IC50 4.41 μg /mL;剑叶卷柏IC50 4.23 μg /mL;块茎卷柏IC50 3.12 μg/mL,均明显强于阳性对照阿卡波糖(IC50 76.82 μg/mL)。总黄酮和穗花杉双黄酮含量在不同品种间存在差异,其中对α-葡萄糖苷酶抑制作用和黄酮含量呈量效关系,且具有显著的α-葡萄糖苷酶抑制活性。
关键词:卷柏;总黄酮;穗花杉双黄酮;α-葡萄糖苷酶;抑制作用
Abstract:A rapid quantitative determination method of total flavonoids and amentoflavone,a characteristic component of the traditional Chinese medicine,was establisheto compare the content and activity differences in different Selaginella medicinal materials.The content of total flavonoidsand amentoflavone were determined by ultraviolet spectrophotometry and high performance liquid chromatography(HPLC),respectively.The activity test of the active part ofSelaginella was carried out through the establishment of α-glucosidase inhibition model in vitro. The results showed thatthe content of total flavonoids ranged from 1.48% to 2.67%,and the content of amentoflavone ranged from 0.49% to 0.93% in different plants. Meantime,the content of total flavonoidswas between 9.14% and 16.46%,and the content of amentoflavone ranged from 2.26% to 4.74% in the activity of five active parts. The α-glucosidaseactivity of five active partsofSelaginella,IC50 of S.pulvinate,S.remotifolia,S.involvens,S.xipholepis,S.chrysocauloswas6.56 μg/mL,4.47 μg/mL,4.41 μg/mL,4.23 μg/mL,3.12 μg/mL,respectively,which was significantly stronger than the positive control acarbose(IC50 76.82 μg/mL).The contents of total flavonoids and amentoflavone weredifferentamongdifferent varieties.and the inhibitory effect on α-glucosidase was in a dose-effect relationship with the content of flavonoids,and has significant α-glucosidase inhibitory activity.
Keywords:Herba Selaginella;total flavonoids; amentoflavone; α-glucosidase; inhibitory activity
卷柏为蕨类植物门卷柏科(Selaginellaceae)卷柏属植物,约有700种。我国约有50种,分布全国各地,主产于湖南、福建、四川、陕西、江西、浙江等地[1]。卷柏为中国药典收载品种,卷柏属植物卷柏Selaginella tamariscina(Beauv.)Spring和垫状卷柏Selaginella pulvinate(Hook.et Grev.)Maxim.均作为卷柏入药[2]。现代药理及临床研究表明,卷柏具有抗炎、抗病毒、镇痛、降血压、降血糖、抗痛风和增强人体免疫功能等作用[3-8]。在化学成分研究中,卷柏中含有丰富的黄酮类成分,以双黄酮为主,其中双黄酮化学成分是以穗花杉双黄酮为代表的双黄酮类化合物[9-11]。研究表明,穗花杉双黄酮具有抗炎、抗氧化、抗肿瘤、抗病毒、抗真菌、抗老化、抗痴呆、降血糖、降血脂、抗抑郁、抗溃疡等生物活性[11-16]。在降血糖方面,穗花杉双黄酮可改善糖尿病小鼠血糖紊乱,调节胰岛素分泌,修复胰岛组织。
当前对降血糖活性物质的体外评价主要通过其对α-葡萄糖苷酶的抑制作用实现。从天然产物制备α-葡萄糖苷酶抑制剂比合成制品价格低廉且毒副作用小,越来越多的学者开始青睐于从药用植物中筛选天然的α-葡萄糖苷酶抑制剂,以期寻找到新的安全、有效的药物[17-20]。近年来在国内主要以α-糖苷酶为作用靶点,建立体外微量筛选模型,从各种中药中筛选治疗糖尿病的有效成分并对其α-糖苷酶抑制活性进行评价已成为糖尿病治疗药物研究的热点之一。
本文建立了合理的卷柏黄酮提取工艺,针对总黄酮提取过程中的各项参数,通过正交设计试验进行了优选,获得最佳工艺。卷柏总黄酮中主要成分为穗花杉双黄酮,以该成分为对照品,分别对总黄酮和穗花杉双黄酮建立快速的含量测定方法,可以作为该组分的质量控制方法。本研究对五种卷柏及其活性部位的总黄酮、穗花杉双黄酮进行了含量测定研究,在含量测定基础上进行了α-葡萄糖苷酶体外活性筛选,为建立卷柏属药材的质量控制标准提供新的依据和参考。
1 材料与方法
1.1 仪器
Agilent 1200型高效液相色谱仪(配备低压四元泵、自动进样器、柱温箱、DAD检测器、ChemStations色谱工作站,美国安捷伦科技有限公司),HP8345紫外分光光度仪(美国惠普公司),MR-96A 多功能酶标仪(瑞士TECAN 有限公司),BS224S型电子天平、SQP型十万分之一电子天平(德国赛多利斯公司),101型电热鼓风干燥箱(北京中兴伟业仪器有限公司),HH-2 数显恒温水浴锅(金坛市天瑞仪器有限公司)。
1.2 材料
α-葡萄糖苷酶对照品(美国Sigma公司,批号:SLBX6245);阿卡波糖对照品(批号:J1824027)、对硝基苯-α-D-葡萄糖吡喃苷(PNPG)对照品(批号:E1828029)均购自阿拉丁试剂(上海)有限公司;穗花杉双黄酮(批号111902-201603)购于中国食品药品检定研究院;乙腈为色谱纯;水为娃哈哈纯净水;其余试剂均为分析纯。试验用五种卷柏均采自贵州省水城市玉舍公园,经贵州师范大学王培善教授鉴定为垫状卷柏(Selaginella pulvinata),疏叶卷柏(Selaginella remotifolia),兖州卷柏(Selaginella involvens),剑叶卷柏(Selaginella xipholepis),块茎卷柏(Selaginella chrysocaulos)。
2 结果与分析
2.1 单因素试验
采用加热回流提取,提取温度为60℃,分别以乙醇浓度、提取时间、料液比及提取次数对总黄酮提取率影响设置单因素试验,各因素设置4个不同的水平,对垫状卷柏药材进行提取工艺考察,找出不同因素的最佳處理。
2.1.1 乙醇体积分数对总黄酮提取率的影响
为了研究乙醇浓度对垫状卷柏总黄酮提取效果的影响,本试验设置了4个不同的乙醇体积分数,分别为65%、75% 、85%、95%乙醇。料液比为1∶15,每个样品提取3次,每次2 h,测定并计算总黄酮的提取率分别为1.01%、1.47%、1.20%、1.05%,结果表明75%乙醇的提取率为最佳。
2.1.2 料液比对总黄酮提取率的影响
为了研究料液比对垫状卷柏总黄酮提取效果的影响,本试验设置了4个不同的料液比,分别为1∶8、1∶10、1∶15、1∶20,乙醇体积分数为75%,每个样品提取3次,每次2 h,测定并计算总黄酮的提取率分别为1.18%、1.26%、1.48%、1.41%,结果表明料液比1∶15的提取率为最佳。
2.1.3 提取时间对总黄酮提取率的影响
为了研究提取时间对垫状卷柏总黄酮提取效果的影响,本试验设置了4个不同的提取时间,分别为每次提取1 h、2 h、3 h、4 h。乙醇体积分数为75% ,料液比为1∶15,每个样品提取3次,测定并计算总黄酮的提取率分别为0.95%、1.48%、1.43%、1.31%,结果表明提取时间以每次提取2 h为宜。
2.1.4 提取次数对总黄酮提取率的影响
为了研究提取次数对垫状卷柏总黄酮提取效果的影响,本试验设置了4个不同的提取次数分别为提取1、2、3、4次。乙醇体积分数为75% ,料液比为1∶15,每次提取2 h,测定并计算总黄酮的提取率分别为1.02%、1.42%、1.48%、1.47%,综合考虑成本、时间因素,简化操作流程,一般选择提取3次。
2.2 垫状卷柏总黄酮的提取工艺优化
2.2.1 正交试验 以单因素试验结果为参考,对乙醇浓度、料液比、提取时间及提取次数进行4因素3水平正交试验(表1)。以总黄酮提取率为指标,通过L9(34)正交试验确定最佳提取条件。结果及极差分析见表2,方差分析见表3。
由表2的极差可知,各因素对卷柏总黄酮提取率影响大小顺序为A(乙醇浓度)>D(提取次数)>C(料液比)>B(提取时间)。表3的方差分析表明,乙醇浓度、提取次数及料液比均对卷柏总黄酮提取率具有极显著影响,提取时间对卷柏总黄酮的转移率存在明显影响。从试验结果来看,卷柏总黄酮提取的最佳工艺条件为A2B1C2D3,即乙醇体积分数为75% ,提取时间每次2 h,料液比1∶15,提取3次。
2.2.2 最佳提取工艺的验证 精密称取干燥的垫状卷柏药材三份,每份各1.0 g,加15倍的75%乙醇回流提取3次,每次2 h,冷却后过滤,合并滤液定容至100 mL,重复测定三次取平均值,得总黄酮提取率,结果见表4。表明本提取工艺较为稳定可靠,且提取率较高。
2.3 五种卷柏样品中总黄酮的测定
2.3.1 对照品溶液的制备
精密称取干燥恒重的穗花杉双黄酮对照品5.45 mg,置50 mL量瓶中,加甲醇超声溶解,定容至刻度,摇匀,作为对照品溶液。
2.3.2 供试品溶液的制备
精密称取五种卷柏粉末,在相同的条件下用75%乙醇进行回流提取三次,每次2 h,料液比在1∶15倍,提取液滤过合并,定容至100 mL,摇匀,即得。
2.3.3 线性关系考察
分别精密吸取“2.3.1”项下的对照品溶液1 mL、1.5 mL、2 mL、2.5 mL、3 mL、3.5 mL、4 mL置25 mL量瓶,加甲醇至刻度,摇匀。在335 nm处测定吸光度。以吸光度对质量浓度进行线形回归,得回归方程Y=0.053X-0.010(r=0.9999),总黄酮在4.36~17.44 μg/mL内线性范围内良好。
2.3.4 精密度试验
精密吸取同一供试品溶液,重复测定6次吸光度,计算总黄酮的含量,总黄酮含量的RSD为0.66%,结果表明该方法精密度良好。
2.3.5 稳定性试验
精密称取同一份提取物,配制供试品溶液,分别于0、2、4、8、12、24、48 h测定吸光度,计算总黄酮的含量,结果总黄酮含量的RSD为1.46%,说明供试品溶液在48 h内稳定。
2.3.6 加样回收率试验
称取五种卷柏样品约0.5 g,共6份,加入穗花衫双黄酮对照品适量,按“2.3.2”项下供试品溶液制备方法处理,按上述吸收波长测定并计算回收率。垫状卷柏回收率为99.15%,RAD值为2.14%,疏叶卷柏回收率为100.36%,RAD值为1.35%,兖州卷柏回收率为99.47%,RAD值为1.11%,剑叶卷柏回收率为99.93%,RAD值为1.92%,块茎卷柏回收率为101.86%,RAD值为1.77%。
2.3.7 样品测定
取五种卷柏样品适量,精密称定,按“2.3.2”项下方法制备样品溶液,按上述吸收波长测定,计算五种卷柏样品的总黄酮含量,结果分别为:垫状卷柏为1.48%,疏叶卷柏为1.72%,兖州卷柏为1.84%,剑叶卷柏为2.55%,块茎卷柏回收率为2.67%。
2.4 五种卷柏样品中穗花衫双黄酮的测定
2.4.1 色谱条件
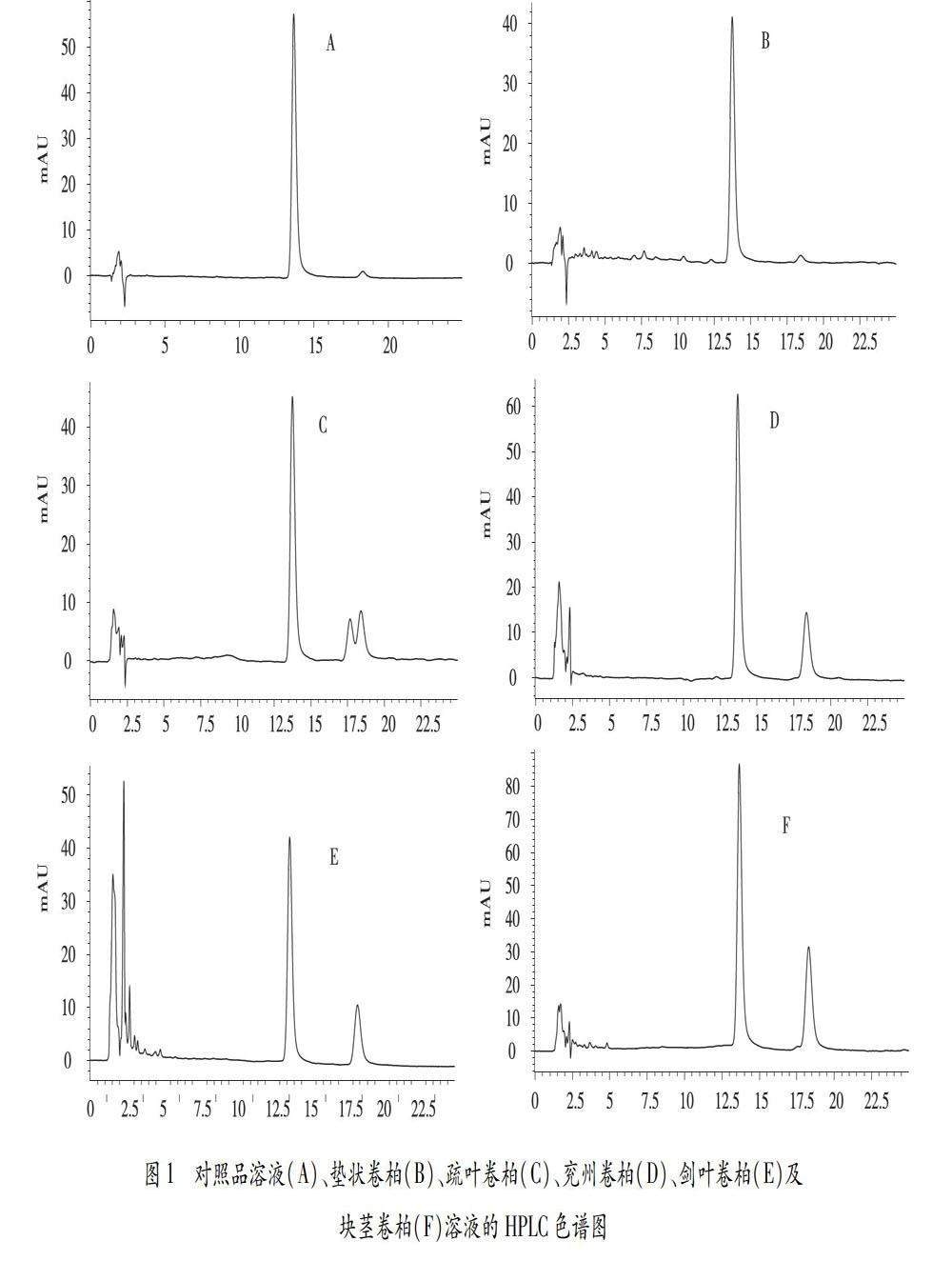
色谱柱为SunFire TM-C18色谱柱(4.6 mm×150 mm,5 μm);动相:乙腈-0.2%磷酸水溶液(35∶65),体积流量:0.8 mL/min,检测波长:335 nm;柱温:30℃;进样量:10 μL。按上述色谱条件获得对照品和五种卷柏样品的色谱图见图1。
2.4.2 对照品溶液的制备
精密称取干燥恒重的穗花杉双黄酮对照品4.50 mg,置50 mL量瓶中,加甲醇超声溶解,定容至刻度,摇匀,得对照品溶液。
2.4.3 供试品溶液的制备
按“2.3.2项”制备供试品溶液,取2 mL定容50 mL为相应供试品溶液。加甲醇至刻度,搖匀,用0.45μm的微孔滤膜滤过,作为供试品溶液。
2.4.4 线性关系考察
分别精密吸取上述对照品储备液适量,制成7种不同浓度的混合对照品溶液,按“2.4.1”项下色谱条件进样测定,以对照品溶液的浓度(μg/mL)为横坐标X,峰面积为纵坐标Y,绘制标准曲线,得回归方程Y=247.40X-1.48(r=0.9999),穗花杉双黄酮在4.5~54.0 μg/mL范围内与峰面积线性关系良好。
2.4.5 精密度试验
精密吸取同一供试品溶液10 μL,注入高效液相色谱仪,重复测定6次,记录穗花杉双黄酮峰面积,计算得RSD值为0.20%。结果表明该方法精密度良好。
2.4.6 稳定性试验
精密吸取同一供试品溶液,分别于0、2、4、8、12、24、48 h进样10 μL,记录峰面积,结果穗花杉双黄酮的峰面积,RSD为1.67%。结果表明供试品溶液在48 h内稳定。
2.4.7 加样回收率试验
分别精密称取五种卷柏样品6份,每份约0.5 g,分别加入穗花杉双黄酮对照品,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱进样测定,记录峰面积,计算样品中的平均加样回收率及RSD值,结果分别为:垫状卷柏回收率为100.98%,RAD值为1.40%,疏叶卷柏回收率为100.76%,RAD值为1.01%,兖州卷柏回收率为100.85%,RAD值为1.34%,剑叶卷柏回收率为100.06%,RAD值为0.78%,块茎卷柏回收率为100.29%,RAD值为1.02%。
2.4.8 样品的测定
分别精密称定五种卷柏样品1.0 g,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进样测定,计算五种卷柏样品中的穗花杉双黄酮的含量。结果分别为:垫状卷柏为0.49%,疏叶卷柏为0.52%,兖州卷柏为0.68%,剑叶卷柏为0.53%,块茎卷柏回收率为0.93%。。
2.5 五种卷柏活性部位的确定及含量测定
2.5.1 五种卷柏活性部位的确定
采用正交设计对卷柏的提取工艺进行优化,精密称取五种卷柏样品,在相同的条件下用75%乙醇进行回流提取三次,每次2 h,料液比1∶15倍,提取液滤过合并,浓缩至无醇味,用石油醚、乙酸乙酯萃取,得到石油醚层、乙酸乙酯层、水层,分别进行体外α-葡萄糖苷酶活性筛选,卷柏各提取物部分中乙酸乙酯萃取物对α-葡萄糖苷酶抑制活性最强,其余部分不具有α-葡萄糖苷酶抑制活性,确定乙酸乙酯萃取物为卷柏的活性部位。经薄层色谱TLC检验,黄酮部分基本完全集中在乙酸乙酯层,浓缩乙酸乙酯层成稠膏状,置真空干燥箱中干燥至恒重,得相应卷柏活性部位。
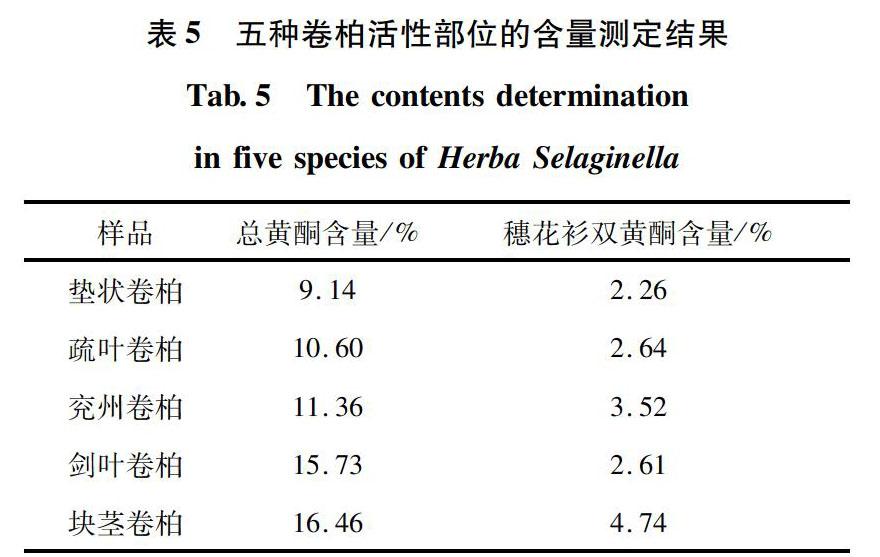
2.5.2 五种卷柏活性部位的含量测定
取五种卷柏活性部位,精密称定,置100 mL量瓶中,加甲醇至刻度,摇匀,即得。按紫外分光光度法和高效液相色谱条件进样测定,计算五种卷柏活性部位中总黄酮和穗花杉双黄酮的含量。结果见表5。
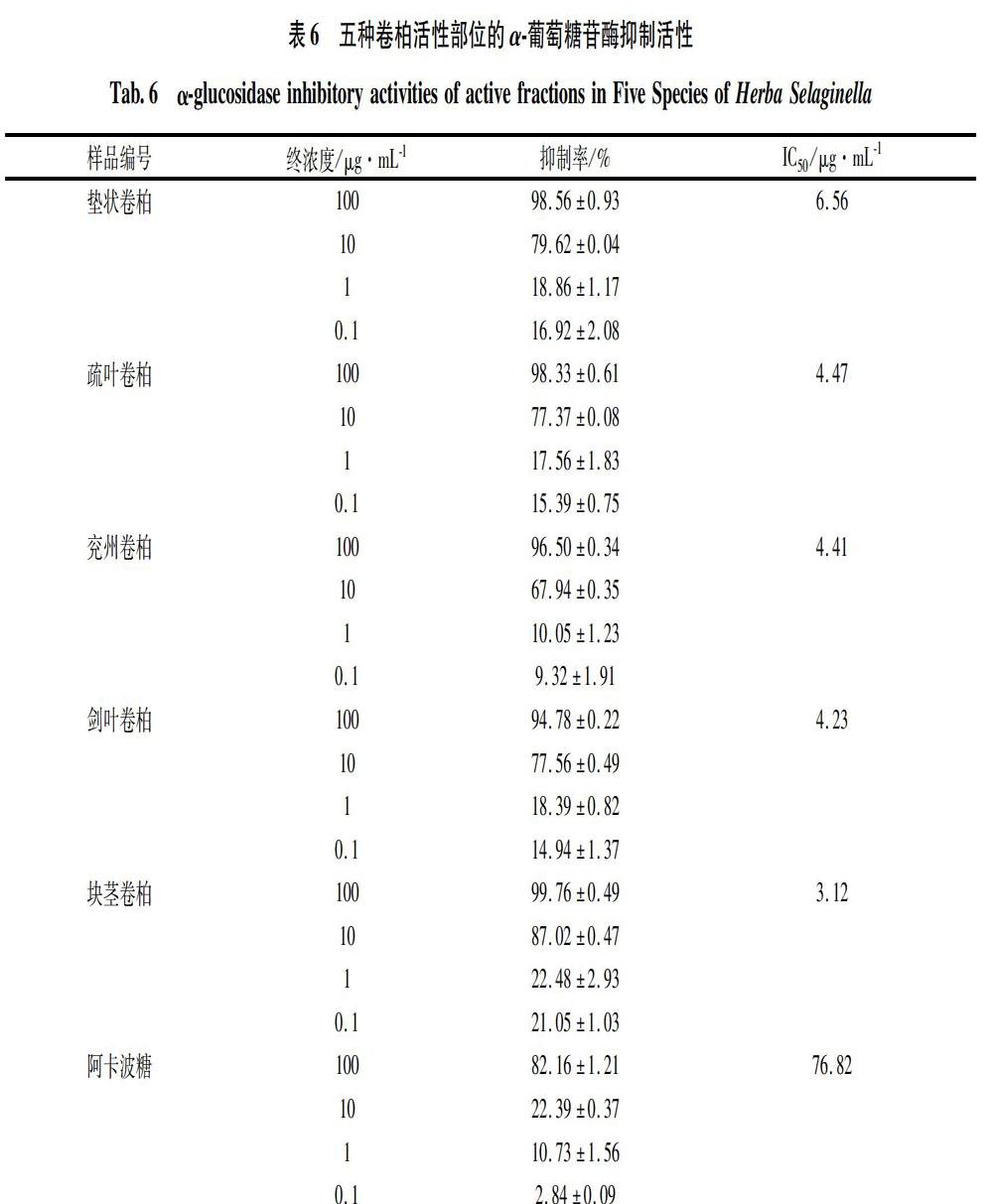
2.6 五种卷柏活性部位的α-葡萄糖苷酶抑制活性
2.6.1 阿卡波糖对照品溶液的制备
精密称取阿卡波糖对照品适量,加水溶解并稀释,配制成四个浓度梯度0.1 μg/mL,1 μg/mL,10 μg/mL,100 μg/mL的对照品系列溶液。
2.6.2 五种卷柏活性部位供试品溶液的制备
将卷柏各活性部位用DMSO溶解,配制成浓度为10 g/L的溶液,再用0.1 mol /L PB缓冲液依次稀释10倍,配制成四个浓度梯度0.1 μg/mL,1 μg/mL,10 μg/mL,100 μg/mL的溶液。
2.6.3 α-葡萄糖苷酶抑制活性测定方法
精密吸取“2.6.1”和“2.6.2”项下的阿卡波糖对照品系列溶液和卷柏活性部位供试品溶液各10 μL,置于96孔板中,加入PBS 60 μL,再加入2 U/mL α-葡萄糖苷酶水溶液10 μL,混匀,于37℃孵育15 min;随后加入5 mmol/L PNPG水溶液20 μL,于37℃孵育20 min,加入0.1 mol/L碳酸钠溶液50 μL终止反应。以水为空白对照,以阿卡波糖为阳性对照,于405 nm波长下测定吸光度值(OD)值,计算抑制率和半数抑制浓度(IC50),抑制率(%)=(OD空白-OD样品)/OD空白×100%。各样品均重复测定3次,结果见表6。由表6可知,阿卡波糖和五种卷柏活性部位对α-葡萄糖苷酶的抑制活性均呈现随着剂量升高而增强的趋势;五种卷柏活性部位对α-葡萄糖苷酶抑制活性明显强于阳性对照阿卡波糖,说明五种卷柏活性部位具有显著抑制α-葡萄糖苷酶活性的作用。
3 结论与讨论
3.1 不同种间的含量差异
分别测定了贵州产五种卷柏植物及其活性部位中的总黄酮和穗花衫双黄酮的含量,由测定结果可以看出,总黄酮、穗花杉双黄酮在不同卷柏植物中及不同卷柏活性部位中的含量存在差异,在不同卷柏及其活性部位中,以块茎卷柏含量最高,垫状卷柏含量最低。说明总黄酮、穗花杉双黄酮在药材中的含量分布可能与种属密切相关,本分析方法为优良卷柏药材的筛选提供依据。
3.2 含量與活性之间的关系
卷柏不同提取物的α-葡萄糖苷酶抑制活性进行了初步筛选,结果表明乙醇提取物中乙酸乙酯萃取部分有较强的活性,为卷柏的活性部位,单体化合物穗花衫双黄酮为主要活性成分。从五种卷柏活性部位的总黄酮、穗花杉双黄酮含量来看,块茎卷柏黄酮含量最高,提取物对α-葡萄糖苷酶的抑制作用也最强,其余提取物在量效上均有一定对应关系。
该研究建立了一种快速定量分析卷柏属总黄酮的紫外测定方法,典型双黄酮类化合物穗花杉双黄酮的HPLC方法,以及体外α-葡萄糖苷酶抑制活性筛选的方法,并对同一产地不用品种的卷柏植物进行了含量和活性测定。结果表明,该方法操作简单、快速、准确,灵敏度高,重现性好。将含量测定与活性测试相结合,更加科学和有效地对卷柏药材及其活性部位进行质量控制。
参 考 文 献:
[1] 国家药典委员会.中国药典[S].2020:237.
[2] 谢永华,温扬敏,罗彩林,等.充州卷柏乙醇提取物对食管癌细胞增殖及NO-cGMP通路的影响[J].天然产物研究与开发,2016,28(3):424-428.
[3] 夏燕平,马腾,齐向云,等.卷柏多糖抗肠道病毒71型活性及机制研究[J].生物技术通讯,2015,26(4):454-459.
[4] 龙红萍,李富双,杨中保,等.充州卷柏的肽类化学成分及对低氧/复氧诱导的PC-l2细胞损伤的保护作用[J].天然产物研究与开发,2014,26(6):947-951.
[5] 李玉洁,王小兰,孙曙光,等.卷柏各部位对糖尿病大鼠胰岛组织形态及骨骼肌葡萄糖转运蛋白-4表达的影响[J].中华中医药杂志,2015,30(7):2554-2556.
[6] 金旭东,卢轩,王惠国,等.卷柏属植物化学成分及其药理作用研究进展[J].时珍国医国药, 2018,29(4): 959-963.
[7] 邱丹缨,温扬敏,谢永华,等.兖州卷柏提取物对CCl4的保护作用[J].福建医科大学学报,2016,50(5):285-289.
[8] 郑晓珂,刘彩霞,翟英英,等.卷柏中穗花杉双黄酮对TNF-α诱导的血管内皮细胞损伤的保护作用[J].药学学报,2013,48(9):1503-1509.
[9] 曹园,姚毅,范慧佳,等.卷柏药材质量标准研究[J].中国药事,2015,6:581-587.
[10] 吴彩霞,杨宇婷,康文艺.HPLC法测定卷柏及其炮制品中穗花杉双黄酮的含量[J],天然产物研究与开发,2013,25:1089-1091.
[11] 晏英,朱海燕,马琳.贵州产五种卷柏总黄酮含量测定[J].云南大学学报,2010,32:227-231.
[12] ISHOLA I O,CHATURVEDI J P,RAI S,et al.Evaluation of amentoflavone isolated from cnestis ferruginea Vahl ex DC(Connaraceae) on production of inflammatory mediators in LPS stimulated rat astrocytoma cell line(C6) and THP-1 cells [J].Journal Ethnopharmacol,2013,146(2):440-448.
[13] JI H H,CHOI H,WOO E R,et al.Antibacterial effect of amentoflavone and its synergistic effect with antibiotics [J].Journal of Microbiology Biotechnology,2013,23(7):953-958.
[14] COULERIE P,NOUR M,MACIUK A,et al.Structure-activity relationship study of biflavonoids on the dengue virus polymerase DENV-NSS RdRp [J].Planta Med,2013,79(14):1313-1318.
[15] ISHOLA S O,TOTA S,ADEYEMI O O,et al.Protective effect of Cnestis ferruginea and its active constituent on scopolamine-induced memory impairment in mice:a behavioral and biochemical study[J].Pharm Biology,2013,51(7):825-835.
[16] 郑晓珂,苏成福,张莉,等.卷柏中穗花杉双黄酮降血糖作用[J].中国实验方剂学杂志,2013,19(17):198-202.
[17] 缪子敬,李志万,周学海.α-葡萄糖苷酶抑制剂的研究进展[J].广东化工,2019,17:96-101.
[18] 程轩轩,陈亮元,郑诗嘉,等.广金钱草多糖指纹图谱的建立、含量测定及其对α-葡萄糖苷酶的抑制活性研究[J].中国药房,2020,31(2):183-189.
[19] 蔡伟兰,韩慢慢,孙彦敏,等.灰兜巴乙酸乙酯部位的化学成分及琢-葡萄糖苷酶抑制活性研究[J].江西科技师范大学学报,2019,6:60-63.
[20] 陈哲,张进,钟振声.金线莲α-葡萄糖苷酶抑制剂提取工艺优化研究[J].中国酿造, 2017(7):135-138.

