滞育期九香虫卵巢组织蛋白的LC-MS/MS鉴定
郭建军 田莹 檀军 金道超

摘 要:九香虫的越冬滞育是影响其大规模人工繁殖的桎楛,保幼激素可调控九香虫的滞育,并可促进卵巢发育。为探索滞育期九香虫卵巢组织蛋白的组成,本研究提取滞育期与滞育解除期的九香虫卵巢组织蛋白,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行初步分析,液相色谱-串联质谱法(LC-MS/MS)对胰酶消化产生的肽段混合物进行分析。结果表明,质谱共检测到448条肽段,唯一肽段为341条,分布于205种蛋白中,分子量集中在10~60 kDa,其中,保幼激素结合蛋白、过氧化氢酶、ATP酶、精氨酸激酶、热休克蛋白及相关同源蛋白的表达可能与九香虫滞育期的越冬抗逆性、调控生长发育、能量代谢及维持滞育有关。
关键词:九香虫;滞育;卵巢;LC-MS/MS;蛋白鉴定
Abstract:The overwintering diapause of Aspongopus chinensis Dallas affected their large-scale artificial reproduction,juvenile hormone could regulate the diapause of of A.chinensis and promote the development of ovarian.In order to explore the composition of the ovarian tissue proteins during the diapause period,this study extracted the ovarian tissue proteins during the diapause and diapause termination period.Sodium dodecyl sulphate-polyacrylamide gel (SDS-PAGE) was used for electrophoresis analysis,and the peptides digested by trypsin were analyzed by liquid chromatography-tandem mass spectrometry (LC-MS/MS).The results showed that mass spectrometry detected a total of 448 peptide,the number of unique peptide was 341,which were distributed in 205 kinds of proteins,and the molecular weight of these proteins ranged from 10 to 60 kDa.The expression of juvenile hormone binding protein,catalase,ATPase,arginine kinase,heat shock protein and related homologous proteins may be related to the resistance to overwintering,growth,development,energy metabolism and maintenance of diapause in A.chinensis.
Keywords:aspongopus chinensis dallas;diapause; ovary; LC-MS/MS;protein identification
九香蟲(Aspongopus chinensis Dallas)是昆虫纲半翅目兜蝽科昆虫[1-2],也是《本草纲目》收录的传统中药,其具有理气止痛、温中助阳、抗癌、抗菌、抗凝血的功效[3-7]。九香虫血淋巴、水提液、水煎液、甲醇提取物及纯化蛋白等可抑制胃癌及乳腺癌细胞的体外增殖。近年来,随着人工大规模采集及环境污染,野外九香虫产量逐渐减少,九香虫的市场价格逐年攀升,常供不应求。因此,亟需人工养殖以解决野外虫源不足的问题[8]。
九香虫为不完全变态昆虫,有卵、若虫和成虫3个虫态,其中,卵历期8~10 d,一至五龄若虫共历期80~101 d,成虫寿命约为320~350 d,滞育期高达约210 d,九香虫的越冬滞育现象严重制约了其大规模人工繁殖[9-11]。滞育是一种复杂的生理过程,昆虫在滞育期,其体内的蛋白、多糖、脂类等代谢会发生相应的变化,降低新陈代谢速率,以度过不良环境,保留种群[12]。滞育期九香虫总蛋白含量较高,但其种类尚不明确[13];此外,保幼激素可调控九香虫的滞育[14],其在昆虫的咽侧体中产生,可促进卵巢发育[15],且滞育期与滞育解除期的九香虫卵巢在形态上存在差异[9],那么,在滞育期的九香虫卵巢中是否存在与滞育或抗逆性等相关的蛋白?为探究上述问题,本研究采集滞育期与滞育解除期的九香虫,提取卵巢组织蛋白,采用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳进行初步分析,用胰蛋白酶消化产生肽段混合物,采用液相色谱-串联质谱法(LC-MS/MS)对肽段进行分析,探索滞育期九香虫卵巢组织蛋白的组成,为九香虫的人工繁育提供参考。
1 材料与方法
1.1 材料
滞育期九香虫成虫,于2017年12月采集自贵州省遵义市习水县 (E 106°10′,N 28°09′),并储存于-80℃冰箱备用;滞育解除期九香虫于2018年5月采集自上述同样的地点,在人工气候箱中饲养,温度(28±1)℃,湿度(85±5)%,光照周期16L∶8D,以观察到交配的发生为滞育解除的标准。
1.2 主要试剂
SDS-PAGE凝胶配制试剂盒(货号:P0012A)、SDS-PAGE蛋白上样缓冲液(5×,货号:P0015)、Bradford蛋白浓度测定试剂盒(货号:P0006)、蛋白酶抑制剂混合物(通用型,100×,货号:P1005)、RIPA裂解液(强,货号:P0013B)、考马斯亮蓝R-250(货号:ST1123)均购自上海碧云天生物技术有限公司。
1.3 Bradford法检测九香虫蛋白含量
采用磷酸盐缓冲液(PBS)稀释牛血清白蛋白(BSA)标准品,配制0、0.125、0.25、0.5、0.75、1、1.5 mg/mL BSA标准液,参照Bradford蛋白浓度测定试剂盒说明书制作蛋白标准曲线。取滞育期与滞育解除期九香虫卵巢组织,液氮研磨,加入150 μL RIPA裂解液,于冰浴上裂解10 min,取5 μL九香虫蛋白样品,加到96孔板中,再加入250 μL G250染色液,设置4个复孔,用酶标仪(Multiskan FC型,美国Thermo Fisher Scientific公司)测定595 nm处吸光度值,根据上述制作的蛋白标准曲线计算滞育期与滞育解除期九香虫卵巢组织的蛋白浓度。
1.4 SDS-PAGE检测九香虫蛋白
配置SDS-PAGE胶(5%浓缩胶,15%分离胶),向蛋白样品中加入1/4体积的SDS-PAGE蛋白上样缓冲液(5×),沸水浴煮沸5 min,12000 g离心5 min,根据上述检测的蛋白浓度,调整蛋白上样量加入电泳孔中,因滞育期与滞育解除期蛋白浓度相差太大,故使上样量组内3个复孔一致。80 V电泳30 min,待蛋白进入分离胶,120 V继续电泳1 h,待指示剂条带离底部1 cm时停止电泳。考马斯亮蓝R-250染色30 min,洗脱液洗脱2 h,每30 min换一次洗脱液,直至条带清晰,采用蛋白凝胶成像系统(SYSTEM GelDoc XR+,美国Bio-Rad公司)拍照。
1.5 LC-MS/MS分析滞育期九香虫蛋白组成
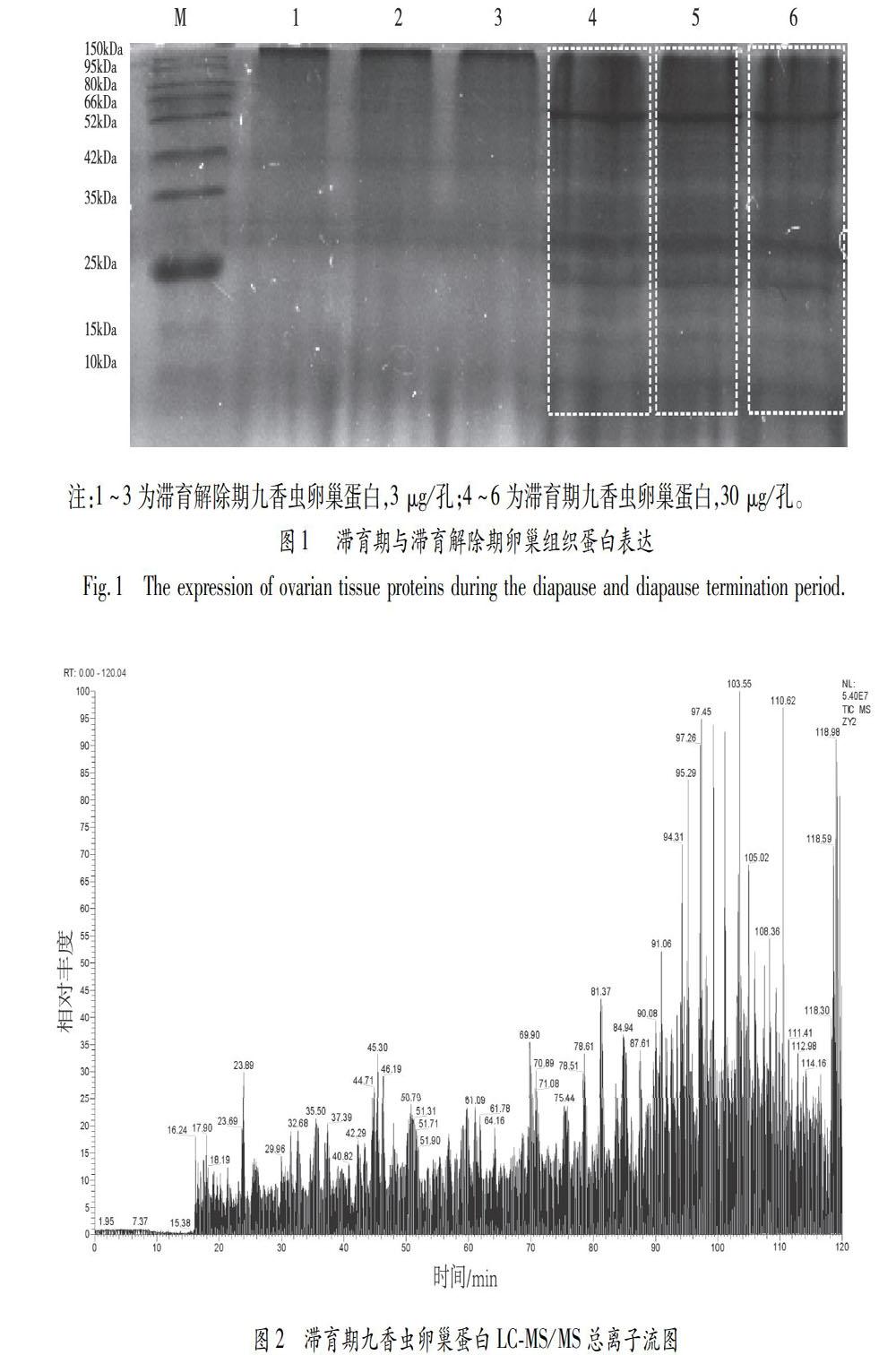
对滞育期九香虫蛋白条带进行胶条LC-MS/MS分析,样品预处理及LC-MS/MS检测参照Tan等的实验方法进行[4],具体操作简述如下,切下胶条(如图1所示),用400 μL 50 mM 的NH4HCO3/ACN(50% v/v)洗涤两遍;0.05 μg/μL胰蛋白酶25℃恒温水浴酶解12 h,冷冻干燥。采用TripleTOF 5600质谱仪(AB SCIEX,Framingham,US),结合Eksigent UPLC425液相色谱系统进行LC-MS/MS分析,使用C18柱(150 mm×75 μm,3 μm)进行高效液相色谱分离,采用Protein Pilot 4.5(AB SCIEX,Framingham,US)软件分析,结合UniProt (https://www.uniprot.org/)蛋白质数据库进行搜库分析。
2 结果与分析
2.1 滞育期九香虫蛋白含量及组成分析
Bradford法制作的蛋白标准曲线方程为Y=0.3414X+0.5284(R2=0.9699),根据蛋白标准曲线,结合样品检测的吸光度值(OD值),计算滞育期与滞育解除期的九香虫蛋白含量分别为1.226±0.031、0.113±0.009 μg/μL。SDS-PAGE蛋白电泳检测结果显示,滞育解除期的九香虫蛋白条带较少,滞育期九香虫蛋白条带较多,主要集中在10~60 kDa(虚线方框所示),其中,10、15、25、66 kDa附近的条带较明显。以上结果表明,滞育期九香虫蛋白条带较丰富,可满足后续LC-MS/MS實验要求。
2.2 肽段的LC-MS/MS分析
LC-MS/MS检测结果显示,滞育期九香虫卵巢组织蛋白经液相色谱分离后,在质谱中检测到的肽段数量与丰度较高(图2),共检测到448条肽段,其中唯一肽段为341条,分布于205种蛋白中。在所有搜库所得到蛋白中,唯一肽段数主要集中在1~2条,少数蛋白的唯一肽段高达17条。对蛋白理论分子量数据进行分析发现,大多数蛋白的分子量分布在10 kDa~60 kDa,与SDS-PAGE检测结果基本一致(图3)。以MS/MS数据搜库比对的唯一肽段数量、覆盖率、准确率得分等为指标,结合九香虫滞育期的相关生物学现象,本研究筛选到25种具有功能注释的高可信度蛋白,其中,保幼激素结合蛋白(Juvenile hormone binding protein)可能与九香虫滞育相关;热休克蛋白家族成员Hsp 60、Hsp 70及相关同源蛋白的高表达可能与九香虫在滞育期间的越冬抗逆性有关[16];过氧化氢酶(Catalase)的高表达有利于增强滞育期九香虫的防御功能;ATP酶(ATP synthase)、精氨酸激酶(Arginine kinase)等可能与调控九香虫滞育期的能量代谢相关[17]。此外,在所鉴定的卵巢组织蛋白中仍有大量未知名称及功能的蛋白(表1)。
3 结论与讨论
随着人工大规模采集、农药的使用及野外环境的恶化,野外九香虫的数量逐年骤减,市场供不应求的现象近年来愈加明显,人工养殖是解决九香虫野外种群数量不足的重要途径,但九香虫存在越冬滞育现象,严重制约了这一药食两用昆虫资源的大规模人工繁殖[8]。本文在长期(2012年—至今)进行九香虫人工繁育行为研究的基础上,首次对滞育期九香虫卵巢组织蛋白的含量及组成进行分析,发现滞育期九香虫卵巢组织蛋白含量及条带较丰富。其中,保幼激素结合蛋白可能与九香虫滞育相关。研究表明,保幼激素结合蛋白可与保幼激素相作用,保幼激素在昆虫咽侧体中产生,可促进卵巢发育,并调控昆虫的生殖、发育[15]。保幼激素可调控九香虫滞育;类似研究结果显示,滞育期二化螟幼虫血淋巴的保幼激素含量比非滞育幼虫的高;保幼激素处理可促使柞蚕Antherea pernyi、三带喙库蚊Culex tritaeniorhynchus解除滞育。此外,在滞育期九香虫卵巢组织蛋白中还鉴定到大量热休克蛋白家族成员(Hsp 60、Hsp 70等),研究表明,昆虫在受到热激或冷激等环境刺激时,体内可能会产生热休克蛋白,以提高昆虫的抗逆性;热休克蛋白在大多数蝇类、舞毒蛾Lymantria diapar、竹蠹螟Omphisa fuscidentalis、二化螟Chilo suppressalis等昆虫的滞育期表达均高于滞育解除期[16]。九香虫9~10月寻找越冬场所越冬,次年的5~6月陆续交尾,越冬期间调查点的气温较低、食物短缺[9],本研究所发现的滞育期九香虫卵巢组织大量表达ATP酶、过氧化氢酶、精氨酸激酶等可能与调控九香虫滞育期的能量代谢速率相关,滞育在九香虫野外度过低温、食物短缺等不良环境中具有重要作用。
综上,为探究九香虫滞育期卵巢组织蛋白的含量、组成,本研究首次通过LC-MS/MS对滞育期九香虫卵巢蛋白酶解肽段进行分析,共检测到448条肽段,唯一肽段为341条,分布于205种蛋白中,分子量大多分布在10~60 kDa,其中,保幼激素结合蛋白、热休克蛋白及相关同源蛋白、过氧化氢酶、ATP酶、精氨酸激酶的表达可能与九香虫在滞育期间的越冬抗逆性、调控生长发育、能量代谢及维持滞育有关。但是,在所鉴定的卵巢组织蛋白中仍有大量未知名称及功能的蛋白,这些蛋白的高表达也可能在九香虫滞育中发挥作用,尚需进一步研究。
参 考 文 献:
[1] 郭建军,檀军,张平.贵州省药用昆虫名录[J].西南师范大学学报:自然科学版,2012,37(2): 51-65.
[2] 郭建军,檀军,杨佳琪,等.贵州省药用昆虫资源开发利用的现状与对策[J].贵州农业科学,2013,41(2): 100-103.
[3] 檀军,郭建军,魏超,等.九香虫血淋巴对胃癌SGC-7901细胞体外增殖的抑制作用[J].山地农业生物学报,2013,32(2): 119-122.
[4] TAN J,TIAN Y,CAI R L,et al.Antiproliferative and proapoptotic effects of a protein component purified from Aspongopus chinensis Dallas on cancer cells in vitro and in vivo[J].Evidence-Based Complementary and Alternative Medicine,2019:12.
[5] TAN J,TIAN Y,CAI R L,et al.Chemical Composition and Antiproliferative Effects of a Methanol Extract of Aspongopus chinensis Dallas[J].Evidence-Based Complementary and Alternative Medicine,2019:9.
[6] 田莹,檀军,赵帅,等.九香虫水煎液主要成分分析及对乳腺癌细胞增殖的抑制作用[J].环境昆虫学报,2020,42 (2): 299-305.
[7] 田莹,檀军,赵帅,等.九香虫水提液化学成分及其对乳腺癌细胞增殖的抑制作用[J].中成藥,2020,42(4):943-948.
[8] 郭建军,檀军,魏超,等.九香虫人工养殖越冬条件的优化[J].山地农业生物学报,2019,38(2) : 71-74.
[9] 魏超,舒国周,罗会嵩,等.九香虫的形态特征和生物学特性[J].山地农业生物学报,2015,34(4): 26-30.
[10] 古欣瑶,魏超,冯瑶,等.九香虫交配产卵节律研究[J].应用昆虫学报,2017,54(1): 121-125.
[11] 周汶桢,吴有芳,郭建军.光周期对九香虫卵及若虫历期的影响[J].山地农业生物学报,2019,38(6): 58-60.
[12] HARSIMRAN KG,GAURAV G,GURMINDER C.Insect diapause: A review[J].Journal of Agricultural Science and Technology,2017(7): 454-473.
[13] 吴有芳,周汶桢,赵帅,等.九香虫滞育期脂肪、糖类和蛋白质含量的变化规律[J].应用昆虫学报,2019,56(5): 1019-1025.
[14] 吴有芳.九香虫滞育生理原因初步研究[D].贵阳:贵州大学,2019:7-8.
[15] YAMASHITA O,ISOBE M,IMAI K,et al.Serum albumin as an effective carrier for diapause hormone of the silkworm,Bombyx mori [J].Applied Entomology and Zoology,1980(15): 90-95.
[16] 肖海军,魏兆军,薛芳森.昆虫滞育关联热休克蛋白的研究进展[J].昆虫学报,2011,54(9): 1068-1075.
[17] JAMES J M,COLLIER G E.Hormonally regulated expression of arginine kinase in Drosophila melanogaster[J].Rouxs archives of Development Biology,1990,198(8):474-478.

