小熊猫源铜绿假单胞菌耐药性和耐药基因的研究
邹洁建 古河祥 翟俊琼 萨家祺 陈 武* 杜雪晴*
(1.广东省野生动物救护中心,广州,510520;2.广州动物园,广州市野生动物研究中心,广州,510070)
小熊猫(Ailurusfulgens)为我国二级重点保护野生动物,具有独特的生态学价值和观赏价值,许多动物园都有保育和展示,因人工保育条件下,小熊猫圈养的场地环境、食物种类、种群密度等因子的影响,小熊猫疾病防控压力也随之增大,特别是小熊猫疫病的防控已成为圈养小熊猫保育的重点[1]。小熊猫的主要疫病包括犬瘟热、细小病毒病、大肠杆菌病、绿脓杆菌(铜绿假单胞菌)病、克雷伯氏菌病、巴氏杆菌病、嗜水气单胞菌病等[1-3]。2019年6月,广东某公司饲养的3只1岁龄雄性小熊猫突然出现卧地不起、呼吸加快、抽搐、口流水样液体、眼神无光、体温下降等症状,使用庆大霉素等药物治疗无效死亡。解剖发现心脏塌陷,心包积液;肺严重淤血,水肿,切面浸润;肝淤血肿胀,局灶性出血,坏死。无菌条件下分别取3只小熊猫的肝脏和肺脏组织样本进行病原的分离培养与鉴定,结果从肺脏和肝脏组织样品中分离培养出1株具有较强致病性的铜绿假单胞菌(Pseudomonasaeruginosa,PA)。
PA又称绿脓杆菌,是一种专性需氧革兰氏阴性菌,为常见的条件致病菌,在自然界中广泛存在,不同的株型带有不同的耐药基因并具有不同的致病性[4]。PA易感染人和动物的肺部、眼角膜、外伤部位等组织,已报道的感染动物种类包括牛(Bostaurus)、林麝(Moschusberezovskii)、斑马(Equusburchellii)、北美水貂(Mustelavison)等[5-8],分离获得的PA菌株携带多种耐药基因,对多种抗生素具有耐药性[5-10]。研究PA的耐药性、耐药机制及耐药基因转移传播的途径对临床用药具有指导意义。Bauer和Kirby所建立的纸片琼脂扩散法(即K-B法)是检验细菌对抗菌药物敏感性而广泛使用的一种方法,这种方法能鉴定细菌的表型特征,可与耐药基因的克隆鉴定相互验证。因此,本研究进行PA药敏试验和小鼠致病性试验,PCR检测PA的28种β-内酰胺酶基因、6种氨基糖苷类修饰酶基因(AMEs)、外膜蛋白D2基因(oprD2)、磺胺耐药基因(qacE△1-sul1)、3种整合子基因(intⅠ1、2、3)和主动外排泵调节基因(mexR)共40种耐药相关基因,研究其致病性、耐药谱和耐药机制,为小熊猫铜绿假单胞菌病的防控提供参考。
1 材料与方法
1.1 材料
普通琼脂培养基、血琼脂培养基、MH培养基、LB液体培养基、药敏纸片、SPF小鼠、革兰氏染色试剂盒、细菌基因组DNA提取试剂盒、2×TaqPCR MasterMix均采购自广州维宁生物科技有限公司。细菌16S rDNA、耐药基因的引物合成和测序,均委托广州睿博兴科生物技术公司完成。
1.2 细菌的分离培养及形态学观察
无菌采集死亡小熊猫肺脏和肝脏组织,接种于普通琼脂培养基上,37℃恒温培养箱内培养24 h后,观察菌落形态特征,纯化至单个菌落。用接种环挑取平板上单个菌落,接种于LB液体培养基。将纯化的菌液接种在血琼脂平板上,37℃恒温培养24 h,观察菌落形态,并进行革兰氏染色。
1.3 细菌分离株的药物敏感性试验
采用K-B法,按照美国临床实验室标准委员会(CLSI)制定的《抗微生物药物敏感性执行标准第22版信息增刊》的操作要求[11],无菌条件下,将扩增的细菌培养液用LB液体培养基稀释至0.5麦氏比浊管浓度(该管为0.048 mol/L的BaCl2,此时菌液浓度为1.5×108个/mL)均匀涂布于MH培养基,贴上药敏纸片,于37℃培养24 h后,测量各抑菌环直径。依据说明书上的判断标准判别分离菌株对所用药物的敏感程度。药敏纸片包括:青霉素、阿莫西林、头孢氨苄、头孢克洛、头孢曲松、头孢克肟、头孢吡肟、头孢哌酮舒巴坦、丁胺卡那、链霉素、庆大霉素、阿奇霉素、氯霉素、利福平、甲硝唑、诺氟沙星、恩诺沙星、氧氟沙星及左氧氟沙星等。
1.4 分离株的PCR检测及序列分析
取过夜培养的菌液1—2 mL,采用细菌基因组DNA提取试剂盒提取分离菌DNA,作为PCR反应模板。选用16S rRNA基因通用引物F(5′-AGAGTTTGATCCTGGCTCAG-3′)和R(5′-TACGGTTACCTTGTTACGACTT-3′)[5]进行PCR扩增,目标片段约1 600 bp,PCR反应体系为:2×TaqPCR Master Mix 12.5 μL,引物F和R各1 μL,DNA模板1 μL,nuclease-free water 9.5 μL,合计总体积25 μL。PCR反应程序如下:94℃,4 min;94℃,30 s,55℃,30 s,72℃,45 s,35个循环;72℃,10 min。1%琼脂糖凝胶电泳20 min。紫外线下凝胶上出现与目的条带分子量相同的条带即判别为阳性。扩增阳性产物送测序公司测序,测序结果经GenBank中BLAST比对,确定其种属地位。
1.5 耐药基因的检测
铜绿假单胞菌的40种耐药基因的检测采用PCR法[12-14],引物序列见表1。以分离菌株的DNA作为模板,进行PCR扩增,检测相关耐药基因。每种耐药基因的PCR扩增体系均为:每反应体系F、R引物各为1 μL(1.0 μmol/L),2×TaqPCR Master Mix 12.5 μL;nuclease-free water 8.5 μL,DNA模板2 μL,合计总体积25 μL。PCR反应程序如下:95℃ 4 min;95℃ 30 s →Tm℃ 30 s →72℃ 1 min,35个循环;72℃,7 min。PCR扩增产物经1%琼脂糖凝胶电泳20 min,紫外线下凝胶上出现与目的条带分子量相同的条带即判别为阳性。
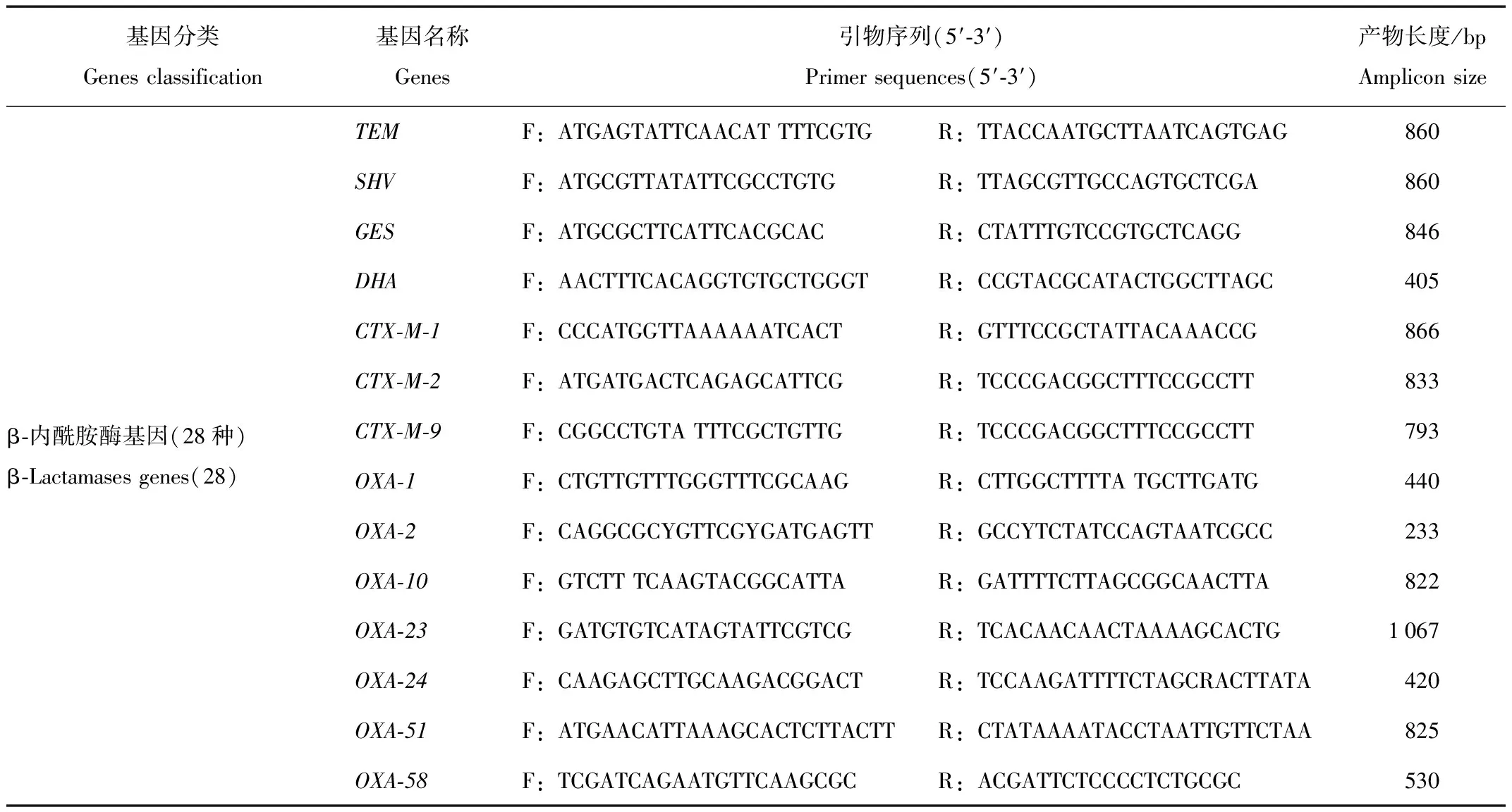
表1 40种耐药基因检测项目、PCR引物序列及产物长度

续表1
1.6 PCR扩增产物序列测定与分析
本研究PCR扩增阳性产物外送至公司进行DNA序列测定,所测序列采用GenBank中的BLAST程序进行同源性分析。
1.7 分离菌的毒力试验
将PA菌24 h肉汤培养液以0.1 mL的量分别腹腔接种SPF小鼠5只,另设阴性对照组小鼠5只,分别腹腔接种生理盐水0.1 mL。分别观察2组小鼠的死亡情况,死亡的小鼠解剖观察症状,切片观察病理组织变化,与发病小熊猫的相关资料进行比较,并做细菌培养与鉴定,72 h后未死亡的小鼠扑杀,取肝肺组织做细菌的培养与鉴定。
2 结果
2.1 细菌的分离培养及形态学观察结果
从发病死亡的小熊猫肝脏和肺脏组织分离获得1株细菌,该菌在血琼脂平板上形成1—2 mm、半透明/有光泽、表面湿润、边缘整齐、圆形凸起的菌落(图1)。挑取单个纯培养的菌落进行涂片,经革兰氏染色后镜检。革兰氏染色结果为革兰氏阴性杆菌,两端钝圆,散在或成对排列(图2)。
2.2 细菌分离株的药物敏感性试验结果
分离菌对抗生素敏感性试验结果见表2。该菌株对青霉素、阿莫西林、头孢氨苄、头孢克洛、头孢曲松、头孢克肟、头孢吡肟、丁胺卡那、链霉素、庆大霉素、阿奇霉素、利福平、甲硝唑、诺氟沙星、恩诺沙星、氧氟沙星、左氧氟沙星等耐药;对头孢哌酮舒巴坦中度敏感;对氯霉素敏感。

表2 分离菌对抗生素敏感性试验结果
2.3 分离株的PCR检测及序列分析结果
将细菌PCR阳性产物送至测序公司进行测序,得到序列,将序列上传至NCBI中进行BLAST比对分析,发现所扩增的细菌片段与NCBI上上传的铜绿假单胞菌序列MH378333.1、MH378332.1、KY962356.1等序列相似性达到100%。
2.4 耐药相关基因种类的分布
5种耐药基因TEM、aac(3)-Ⅱ、ant(3″)-Ⅰ、qacE△1-sul1、intⅠ1为阳性,其他35种为阴性。5种耐药基因PCR产物的电泳图见图4。
2.5 序列测定及分析
对PCR扩增为阳性产物的DNA测序分析,得到序列,发现 5种耐药基因TEM、aac(3)-Ⅱ、ant(3″)-Ⅰ、qacE△1-sul1、intⅠ1引物所扩增的DNA片段均与NCBI上上传的基因序列相似性达98.48%—99.88%(表3),确定此菌株含5种耐药基因TEM、aac(3)-Ⅱ、ant(3″)-Ⅰ、qacE△1-sul1、intⅠ1。

表3 DNA序列比对结果
2.6 小鼠的致病性实验
PA组的小鼠在48 h死亡5只,从死亡小鼠肝脏和肺脏分离到接种菌;对照组小鼠未见死亡,扑杀后从肝脏和肺脏分离不到致病菌。死亡小鼠主要表现为急性出血性败血症,与发病小熊猫的症状与病理变化一致。
3 讨论
PA是常见病原菌,近年来报道PA引起的人和动物的感染不断增加,常见于免疫力低下,接受抗菌药物治疗的病例,且耐药问题严重。本次研究的PA菌是从表现急性出血性败血症的小熊猫肺脏和肝脏分离培养所得,症状与余星明等[15]的研究报道基本一致,该小熊猫使用庆大霉素、头孢曲松钠、甲硝唑等药物治疗无效,最终死亡。以分离菌对小鼠进行致病性试验,小鼠表现与小熊猫相似的症状而死亡,说明分离菌具有较强的致病性,是小熊猫发病死亡的病原体。
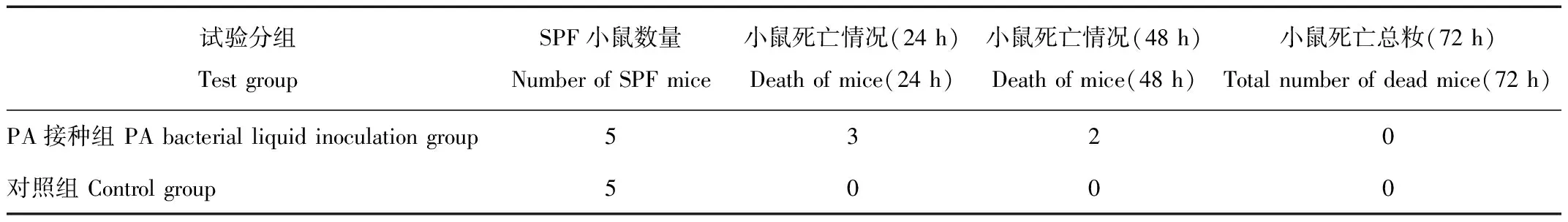
表4 分离菌对小鼠致病性的试验结果
本研究药敏试验结果表明此株PA对β-内酰胺类的青霉素和阿莫西林,头孢类的头孢氨苄、头孢克洛、头孢曲松、头孢克肟和头孢吡肟,氨基糖苷类的丁胺卡那、链霉素和庆大霉素,大环内酯类的阿奇霉素,硝基咪唑类的甲硝唑,喹诺酮类的诺氟沙星、恩诺沙星、氧氟沙星和左氧氟沙星以及利福霉素等均耐药,对头孢哌酮舒巴坦中度敏感,对氯霉素敏感。据周丽萍等[16]采集的不同来源的PA耐药性的分析表明,综合医院分离的PA的耐药率明显高于眼专科医院的病菌。可能原因是眼科细菌感染的治疗较少使用氨基糖苷类及碳青霉烯类药物,而综合性医院由于病程长,病情复杂严重而应用抗菌药物时间长,用药多的缘故。饲养小熊猫的机构,使用未经熟化处理的牛肉末、牛奶及竹叶饲喂小熊猫,之前2只小熊猫也发生因采食上述食物而发生大肠杆菌(Escherichiacoli)感染,而该机构长期使用庆大霉素等抗菌药物治疗小熊猫。可能是牛肉等饲料在加工过程中污染了铜绿假单胞菌,小熊猫采食而发病,而长期使用庆大霉素等抗菌药物,使PA菌的耐药性增加,导致治疗的失败。
PA包含细菌所有的6种类型的耐药机制,即产生抗菌药灭活酶、药物作用靶点结构变异、细胞壁外膜通透性降低、细胞膜表面形成主动外排泵系统、形成生物膜屏障、不良环境导致的适应性耐药等耐药机制[4]。PA对β-内酰胺类抗生素耐药的主要机制为产生β-内酰胺酶(青霉素酶、头孢菌素酶等)、外膜蛋白缺失和外排泵[17]。本株PA菌对青霉素、阿莫西林和头孢类抗生素具有耐药性,检出1种β-内酰胺酶基因TEM,表明本株菌对β-内酰胺类和头孢类抗生素耐药的主要机制是产生大量TEM型超广谱β-内酰胺酶与抗生素迅速、牢固结合,使其停留于胞膜外间隙中,因而不能进入靶位发生抗菌作用。
PA对氨基糖苷类抗生素耐药的主要机制为产生氨基糖苷类修饰酶(AMEs)或16S rRNA甲基化酶或细胞膜表面形成主动外排泵系统等[17]。编码AMEs的基因包括乙酰转移酶(aac)、核苷化酶(ant)、腺苷化酶(aad)和磷酸化酶(aph),修饰氨基糖苷类抗生素的特定基团,降低或丧失对靶位核糖体的亲和力[4]。本研究在PA中检出2种AMEs基因,aac(3)-Ⅱ、ant(3″)-Ⅰ,说明本株PA菌对氨基糖苷类抗生素的耐药机制与这2种AMEs基因有关。明德松等[12]也在1株全耐PA菌中检出aac(3)-Ⅱ基因,张凡[18]在猪、鸡体内分离的多株PA菌中检出aac(3)-Ⅱ、ant(3″)-Ⅰ等编码AMES基因。
整合子(int)是一段具有独特结构和独立功能的基因组序列,由5′保守端、3′保守端和二者之间的可变区组成,许多革兰氏阴性菌的耐药基因以基因盒的形式存在于整合子的可变区,主要包括Ⅰ、Ⅱ、Ⅲ类整合子[19]。PA基因组的Ⅰ类整合子可携带多种耐药基因盒,包括β-内酰胺类、喹诺酮类、甲氧苄啶类、氨基糖苷类、大环内酯类、氯霉素类和四环素类等抗菌药物的耐药基因盒,从而产生多药耐药性[4]。Ⅰ类整合子5′保守端有编码整合酶的intⅠ1基因及启动子,3′端为耐消毒剂和磺胺基因(qacE△1-sul1)。intⅠ1与qacE△1-sul1同为Ⅰ类整合子的遗传标记,qacE△1-sul1也是耐季铵盐化合物和磺胺的基因遗传标记[19]。整合酶2基因(intⅠ2)为Ⅱ类整合子的遗传标记,整合酶3基因(intⅠ3)为Ⅲ类整合子遗传标记。本株PA菌检出Ⅰ类整合子,未检出Ⅱ、Ⅲ类整合子,说明本株PA的耐药机制与Ⅰ类整合子有关,与Ⅱ、Ⅲ类整合子无关;同时本株PA的qacE△1-sul1基因为阳性,说明其耐药机制也与qacE△1-sul1基因有关。孙光明[19]对多株PA菌的检测也发现Ⅰ类整合子较普遍,Ⅱ类整合子比较少见,未发现Ⅲ类整合子。此外铜绿假单胞菌的Ⅰ类整合子可携带aac(3)-Ⅱ、aac(6′)-Ⅱ、aac(6′)-Ⅰb等耐药基因[20-21],本株菌携带的aac(3)-Ⅱ基因与intⅠ1和qacE△1-sul1基因同时阳性,表明本菌株携带的aac(3)-Ⅱ基因也很可能位于Ⅰ类整合子中。
PA作为人畜共患病原菌,对其防控具有非常重要的意义。新的耐药基因会在基因的变异过程中不断产生,且细菌的许多耐药基因可通过质粒、转座子、整合子、噬菌体等可移动遗传元件转移和传播,耐药菌株层出不穷,对感染性疾病的防治带来了极大的挑战。因此应根据药敏试验结果合理使用抗菌药物,此外还需开发疫苗、抗菌肽等新的生物治疗方法进行耐药菌的防治。

