响应面法优化巴氏醋杆菌的耐酸醇营养盐培养
严子云, 陈 雄, 李 欣
(发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,湖北工业大学生物工程与食品学院,湖北 武汉 430068)
国内白醋生产多采用液态深层发酵法[1]。该工艺有培养基成分简单(乙醇、营养盐和水),发酵周期短,醇酸转化率高,产酸率高等优点[2]。该工艺中,营养盐的组分非常关键。营养盐中含有醋酸菌生长所必需的生长因子,其品质高低直接影响到醋酸菌的发酵产酸水平和醋酸品质[3-5]。但现阶段中国市场上使用最广泛的醋酸菌培养基是进口的弗林斯醋酸菌发酵营养盐,国产营养盐与之相比还是存在着微弱的不足[6]。
醋酸菌是一种特殊的微生物[7],在醋酸发酵开始前就需要添加高浓度的初始乙醇,所以提高醋酸菌的乙醇耐受性对于工业生产时提高乙酸的产量至关重要[8-9]。醋酸菌的生长速率很大程度上取决于乙醇浓度[10-11],乙醇浓度过高会产生抑制作用,醋酸菌的生长速度会减缓,生长周期也会延长[12-13]。发酵过程中乙酸积累过多,会对醋酸菌产生毒性作用,严重影响发酵的结果[14-15]。醋酸发酵过程中,培养基中的自由氨基酸是醋酸菌很好的氮源[16-17]。研究发现,氨基酸对处于恶劣环境下的细胞生长和存活起着至关重要的作用[18-19]。目前关于氨基酸对醋酸菌的影响的研究仅仅停留在生物量和产酸率上,而且是进行的单一氨基酸的实验,没有进行多因素的复配实验,对于耐受性的研究更是寥寥无几。
基于以上分析,笔者采用响应面法优化营养盐培养基, 确定最佳微量元素的最适添加量, 使巴氏醋杆菌在乙醇胁迫和乙酸胁迫条件下的生物量和产酸量得到较大的提高。
1 材料与方法
1.1 菌株和原料
巴氏醋杆菌(Acetobacterpasteurianus)由功能酵母与酿造微生物实验室保藏; 营养盐AC001,由安琪酵母公司提供。
1.2 培养基
富集培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,115℃灭菌20 min; 种子培养基:葡萄糖10 g/L,酵母浸粉10 g/L,pH自然,115℃灭菌20 min; 初始发酵培养基:营养盐2.0 g/L,精氨酸0.10 g/L,赖氨酸0.10 g/L,胞嘧啶0.10 g/L,谷氨酰胺0.10 g/L,叶酸0.10 g/L,pH自然,115℃灭菌20 min。
1.3 菌种活化及培养方法
将平板保藏的巴氏醋杆菌单菌落勾一环接种到50 mL的液体富集培养基,于32℃、200 r/min的恒温培养振荡器中培养24 h,活化得到一级种子。再按10%的接种量将一级种子液接种至50 mL液体种子培养基,32℃、200 r/min活化48 h,得到二级种子。将二级种子按5%的接种量接种到液体营养盐培养基,置于32℃、200 r/min恒温培养振荡器进行摇瓶发酵。
1.4 分析方法
1.4.1 生物量的测定取发酵液2 mL,23℃、8000 r/min离心10 min,弃去上清,加入2 mL去离子水重悬菌体。以去离子水为对照,在紫外可见光分光光度计600 nm处进行比色测定。
1.4.2 总酸的测定取1 mL巴氏醋杆菌发酵液于100 mL锥形瓶中,加入1滴0.05%酚酞作指示剂,将标定的0.05 mol/L NaOH溶液加入碱式滴定管中,然后滴定样品至淡粉色,30 s内颜色不褪去,即达到滴定终点,总酸量计算公式如下:

式中:V为发酵液样品滴定所消耗的NaOH溶液的体积,mL;V0为以空白培养基为对照滴定所消耗NaOH溶液的体积,mL;CNaOH为NaOH溶液的浓度,mol/L;V样为样品的体积(mL),60为醋酸的分子质量(g/mol)。
1.4.3 乙醇的测定乙醇标样配置:吸取50 μL无水乙醇到100 mL容量瓶中,加入去离子水准确定容至100 mL。
待测样品处理:取1 mL发酵液加入4 mL去离子水中稀释5倍,然后取0.25 mL稀释后的样品加入4.75 mL去离子水中稀释至20倍。生物传感仪定标后,便可进样品测定乙醇含量。
1.4.4 巴氏醋杆菌半抑制浓度IC50的测定配置0.2%营养盐培养基2000 mL,按照0、3%、6%、9%、12%、15%的乙醇浓度梯度和0、1%、2%、3%、4%、5%的乙酸浓度梯度配置成50 mL的发酵培养基,取二级种子液5 mL接入50 mL培养基中,置于32℃、200 r/min恒温培养振荡器进行摇瓶发酵,取样时间点为0、12 h、24 h、36 h、48 h、60 h、72 h,分光光度计测出生物量。以0乙醇浓度和乙酸浓度的培养基作为空白对照组,比较其结果得出结论,确定乙醇IC50和乙酸IC50的浓度以及取样时间点。
1.4.5Plackett-Burman(PB)实验设计Plackett-Burman实验设计是一种多因素两水平的实验设计方案,能以最少的实验次数筛选出响应值影响最显著的变量。利用Design-Expert把每个因素设计成高(+1)、低(-1)2个水平,高水平为低水平的2倍,以巴氏醋杆菌的生物量作为响应值进行随机组合实验,用Expert 8.0.6对实验结果进行显著性分析。
1.4.6 最陡爬坡实验设计根据PB实验筛选出来的3个对巴氏醋杆菌生物量影响显著的因素及其正负效应,在合适的范围内取值设计最陡爬坡试验,以快速逼近最大响应区域。
1.4.7 响应面分析实验设计根据最陡爬坡试验确定的中心点,利用Design-Expert进行中心组合的实验设计,将最陡爬坡试验中的3个显著因素分别标记为X1、X2、X3,以发酵培养60 h后巴氏醋杆菌的生物量作为响应值,标记为Y。将3个显著因素分为5个不同水平,0对应对响应面中心点,1和-1分别对应高水平和低水平,1.68和-1.68对应更高值和更低值。以这5个不同水平进行随机组合实验,用Expert 8.0.6对实验结果进行响应面分析。
1.4.8 数据处理所有试验数据为至少三个平行试验的平均值,采用Origin 9.0和Expert 8.0.6对试验进行数据分析。
2 结果与分析
2.1 巴氏醋杆菌生长半抑制浓度IC50的确定
半抑制浓度指微生物在胁迫条件下与非胁迫条件下生物量之比等于50%时所对应的浓度,IC50值可以反映巴氏醋杆菌对乙酸或乙醇的耐受程度。
2.1.1 乙醇IC50的确定乙醇含量为0的对照组培养基中,巴氏醋杆菌在稳定期时的最大生物量为0.45 g/L,3%乙醇浓度对巴氏醋杆菌的生长有很明显的促进作用,在乙醇消耗完后进入稳定期,最大生物量为0.65 g/L。6%乙醇浓度在巴氏醋杆菌生长前期有微弱的抑制作用,在对照组进入稳定期之后,有缓慢生长的趋势,发酵终点最大生物量为0.48 g/L。9%乙醇浓度对巴氏醋杆菌有明显的抑制作用,在48 h进入稳定期时的生物量为0.25 g/L,约为对照组的一半。12%乙醇浓度的实验组在48 h的生物量为0.15 g/L,在60 h后有缓慢生长的趋势,但过于延长了巴氏醋杆菌的生长周期。乙醇浓度为15%时,巴氏醋杆菌会停止生长甚至凋亡。因此确定乙醇IC50的体积分数为9%,取样时间点为48 h,后续实验均加入9%乙醇。
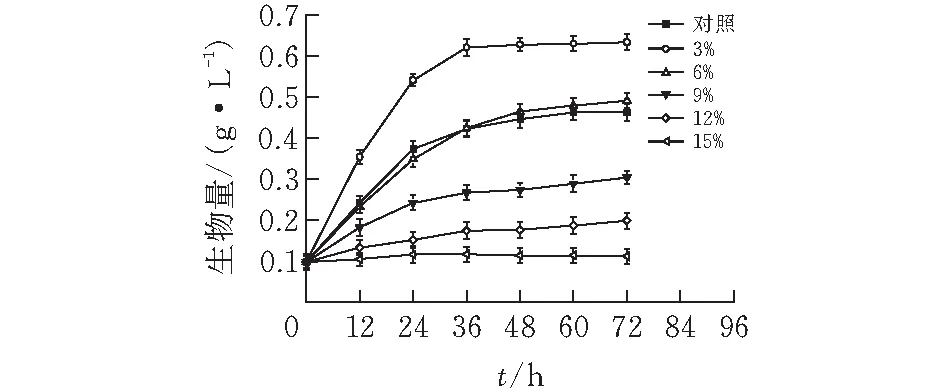
图 1 巴氏醋杆菌乙醇耐受IC50的确定
2.1.2 乙酸IC50的确定1%乙酸体积分数前期会抑制巴氏醋杆菌的生长,但在24 ~48 h之间巴氏醋杆菌有明显的生长迹象,在60 h的生物量为0.23 g/L,约为对照组生物量的一半,乙酸体积分数大于1%时对巴氏醋杆菌的生长有明显抑制作用,甚至导致凋亡。因此确定乙酸IC50的体积分数为1%,取样时间点为60 h,后续实验均加入体积分数为1%的乙酸。
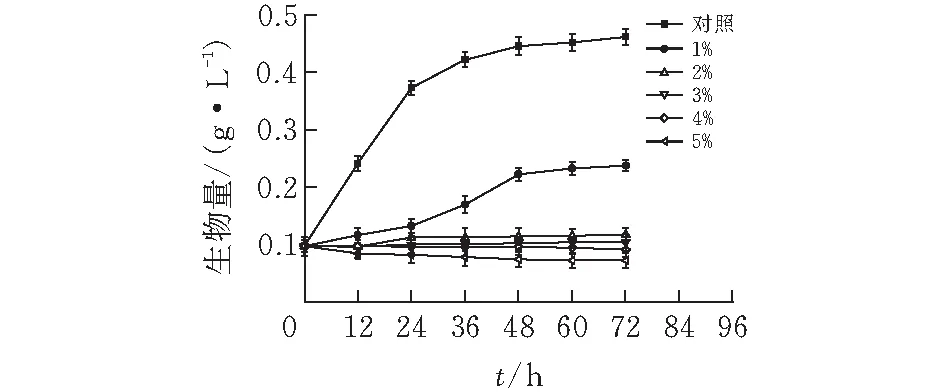
图 2 巴氏醋杆菌乙酸耐受IC50的确定
2.2 营养盐浓度优化
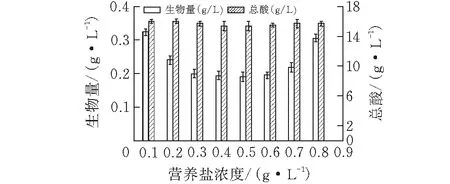
营养盐中含有巴氏醋杆菌生长所必需的碳源、氮源、盐类和生长因子,因此营养盐的添加浓度会直接影响到巴氏醋杆菌的生长水平和产酸水平。本实验用营养盐培养基代替传统葡萄糖、酵母浸粉培养基。浓度过低,不能满足巴氏醋杆菌的生长需求;浓度过高,则会增加生产的成本或者造成不必要的浪费。分别以0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%营养盐配置培养基,微量元素的添加量不变,115℃灭菌20 min后加入9%乙醇和1%乙酸。32℃、200 r/min摇床培养60 h,取样测定生物量和总酸含量(图3)。

图 3 营养盐浓度对巴氏醋杆菌在醇酸胁迫下的影响
营养盐浓度的增加对巴氏醋杆菌在醇酸胁迫下生长的影响较小,在1.0~4.0 g/L的浓度区间,随着浓度的加大,生物量和醋酸产量随之增加,在4.0 g/L浓度营养盐培养基中生物量最大为0.38 g/L。继续增大浓度发现,生物量和醋酸产量几乎保持不变,说明4.0 g/L浓度的营养盐已经能够满足巴氏醋杆菌的生长需求。因此选择4.0 g/L的营养盐浓度作为最佳浓度。
2.3 微量元素浓度的优化
本实验对精氨酸、赖氨酸、胞嘧啶、谷氨酰胺、叶酸这5个单因素进行优化,其添加量初步定为氨基酸0.50 g/L、嘧啶0.50 g/L、维生素0.10 g/L,复配时添加量均为0.10 g/L。32℃、200 r/min摇床培养60 h,取样测定生物量和总酸含量,选取促生长作用最明显,产酸量最高的添加量,其对巴氏醋杆菌生长和产酸的影响分别如图4所示。
(a)精氨酸
由图4a可知,精氨酸的添加对巴氏醋杆菌产酸能力无明显影响,但对巴氏醋杆菌的生长影响较大。添加量为0.10 g/L时,其生物量最大达到0.33 g/L,总酸量为16 g/L。随着添加量的增加,生物量反而减少,在0.30~0.60 g/L范围内,生物量基本保持在0.20 g/L左右不变。添加量增加至0.70 g/L时,生物量又开始增加,并在0.80 g/L浓度时生长到0.31 g/L左右。说明精氨酸的添加量并不是越大促生长作用就越明显,反而在0.30~0.60 g/L范围内时,有微弱的抑制作用,因此选择0.10 g/L的精氨酸浓度作为最佳浓度。
由图4b可知,赖氨酸浓度对巴氏醋杆菌生长和产酸的影响呈现出峰型分布趋势,在0.10~0.40 g/L时,随着赖氨酸浓度的增大其生物量和总酸量也随之增大,但是随着添加量的继续增大生物量和总酸却开始逐步下降。赖氨酸浓度在0.40 g/L时生物量最大为0.36 g/L,产酸量最大为16.3 g/L。因此选择0.40 g/L的赖氨酸浓度作为最佳浓度。
由图4c可知,胞嘧啶浓度在0.10~0.30 g/L之间时,巴氏醋杆菌的生物量在随着浓度的增大而减少,产酸量有少量增加。继续增大浓度后,生物量呈现出上升趋势,并在0.70 g/L时生物量达到最大为0.35 g/L,总酸也达到最大的16 g/L。在胞嘧啶浓度为0.80 g/L时,对生长有明显的抑制作用,产酸量也随之减少。因此选择0.70 g/L的胞嘧啶浓度作为最佳浓度。
由图4d可知,谷氨酰胺浓度为0.20 g/L时,生物量和总酸量达到最大为0.36 g/L和17 g/L。由图7可知,谷氨酰胺的添加对巴氏醋杆菌在胁迫条件下的促生长效果并不佳,但其对于巴氏醋杆菌产酸能力的影响较为显著,因此选择0.20 g/L的谷氨酰胺浓度作为最佳浓度。
由图4e可知,叶酸浓度对巴氏醋杆菌生长的影响呈现峰型分布趋势,随着叶酸浓度从0.06 g/L增加到0.14 g/L,生物量也随之增加,并在0.14 g/L时达到最大0.37 g/L,继续增大浓度后,生物量又逐渐减少。其对巴氏醋杆菌产酸量的影响在0.06 g/L到0.10 g/L之间随着浓度增加而减少,在0.10 g/L到0.14 g/L又增加,在0.14 g/L时最大产酸量为16.4 g/L,在0.16 g/L到0.20 g/L之间,产酸量维持在15.8 g/L左右。因此选择0.14 g/L的叶酸浓度作为最佳浓度。
综合考虑生物量水平和产酸水平,整合所有单因素浓度的优化结果,得到巴氏醋杆菌的初优培养基为4.0 g/L营养盐、0.10 g/L精氨酸、0.40 g/L赖氨酸、0.70 g/L胞嘧啶、0.20 g/L谷氨酰胺和0.14 g/L叶酸。在此基础上通过后续的PB实验和响应面实验对培养基进行进一步的优化。
2.4 Plackett-Burman实验结果
本次Plackett-Burman实验选择了4.0 g/L营养盐、0.10 g/L精氨酸、0.40 g/L赖氨酸、0.70 g/L胞嘧啶、0.20 g/L谷氨酰胺和0.14 g/L叶酸作为实验的高水平。
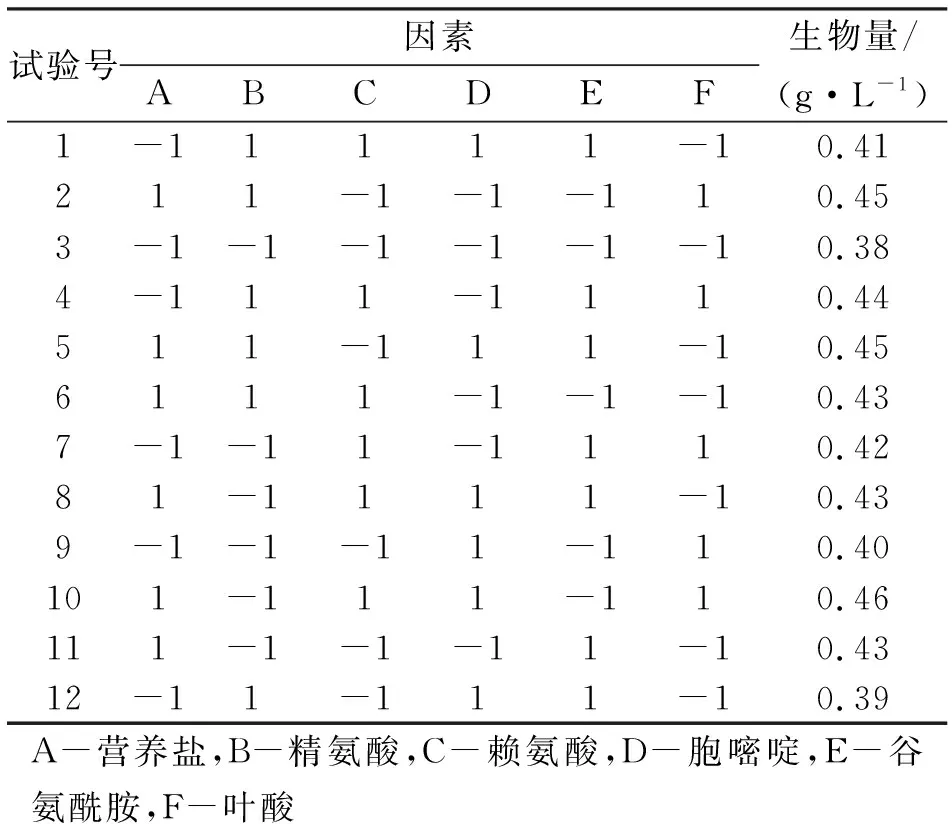
表1 N=12的Plackett-Burman实验设计及结果
由表2可知,营养盐、精氨酸、赖氨酸、胞嘧啶表现为正效应,谷氨酰胺、叶酸表现为负效应。贡献值排在前三位的分别为营养盐、赖氨酸和叶酸,其中可信度大于95%的因素为营养盐和叶酸,且表现较为显著,赖氨酸的可信度大于85%,可信度较高。因此确定选定营养盐、赖氨酸、叶酸为主要影响因素进行下一步最陡爬坡实验。
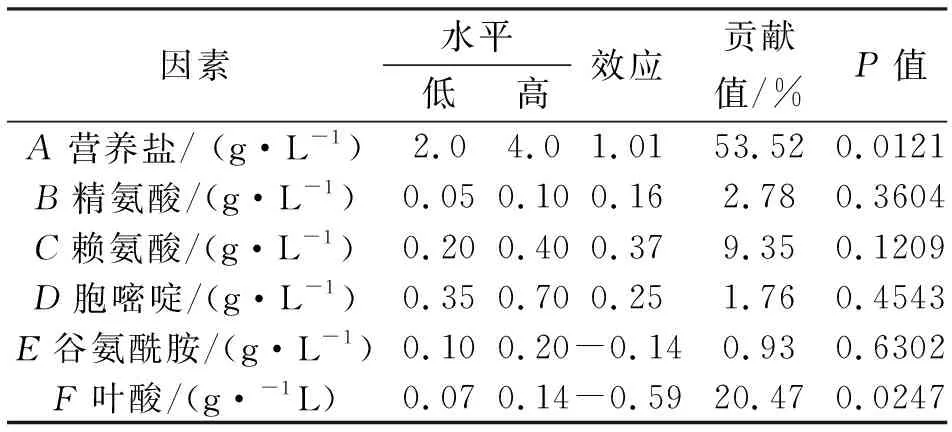
表2 各因素水平、效应值及显著性分析
2.5 最陡爬坡实验结果
根据表2 Plackett-Burman实验确定的显著影响因素为营养盐、赖氨酸和叶酸,其效应值分别为4.0 g/L、0.40 g/L和0.14 g/L,试验设计及结果见表3。
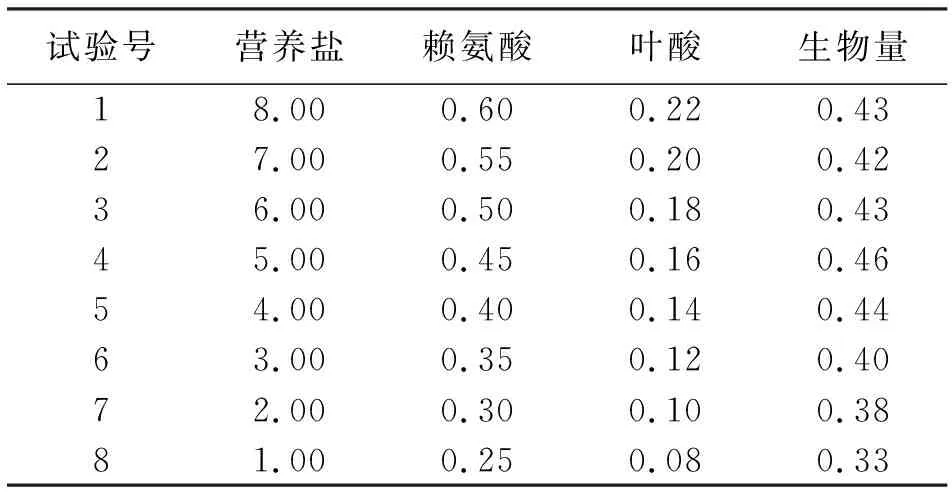
表3 最陡爬坡实验及结果 g/L
由表3可知,最高生物量对应的培养基配方出现在第4组,因此选择第4组作为响应面的中心点,即营养盐5.0 g/L,赖氨酸0.45 g/L,叶酸0.16 g/L。
2.6 响应面分析实验结果
中心组合试验因素及水平见表4,实验设计和结果见表5,方差分析见表6。
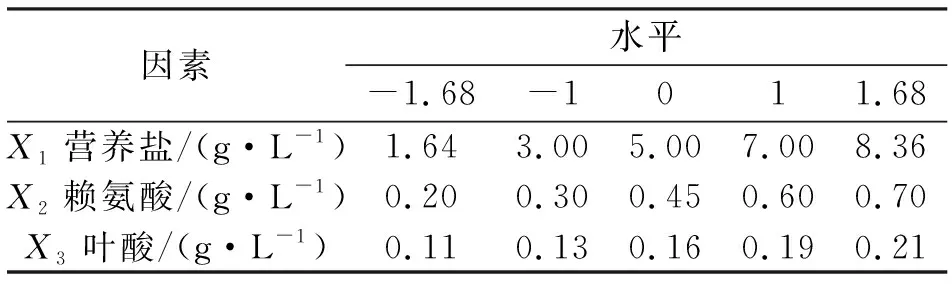
表4 中心组合实验因素及水平
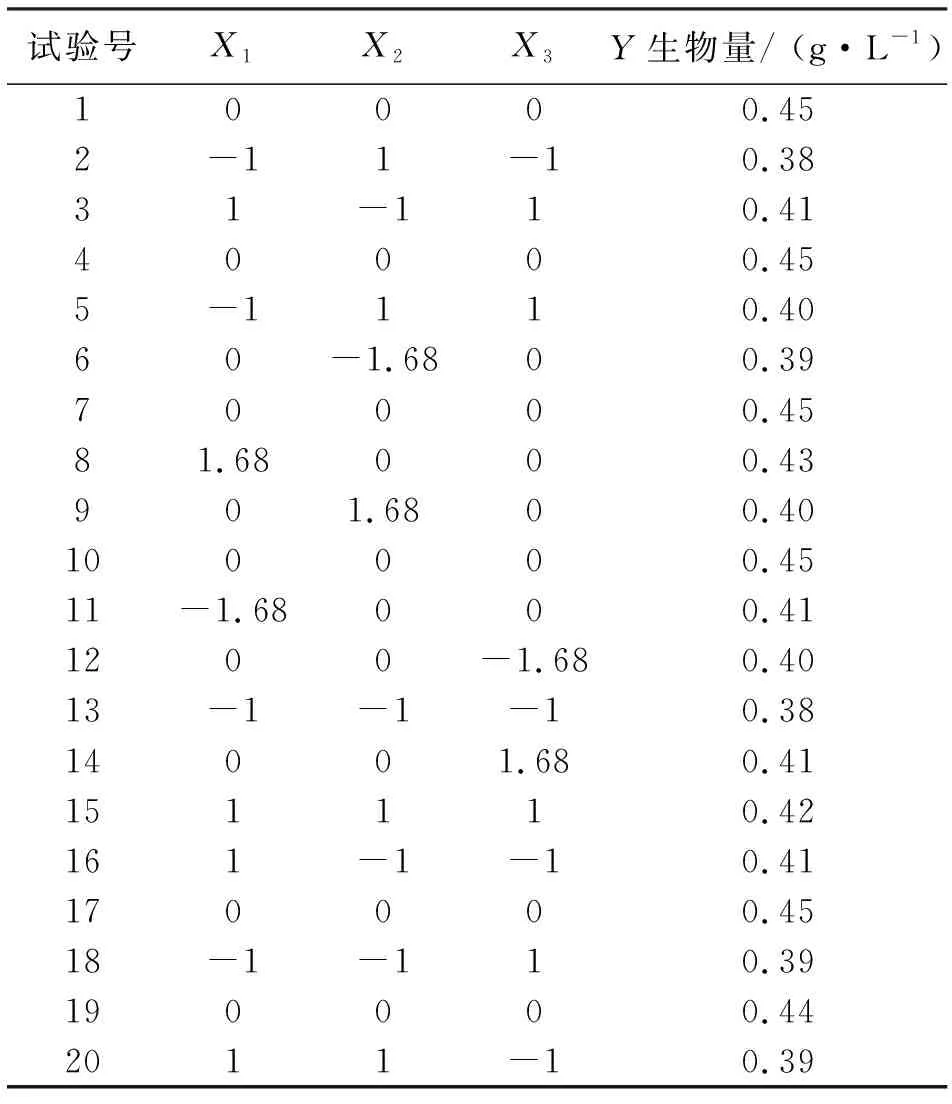
表5 中心组合实验设计及结果
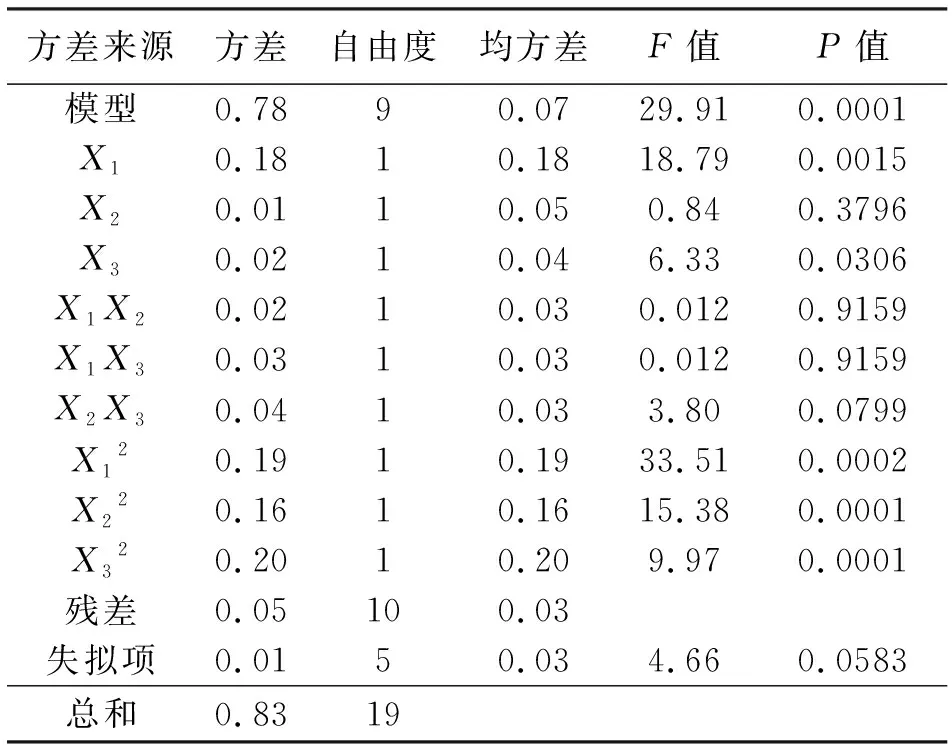
表6 方差分析表
根据表6实验结果通过Design-Expert进行响应面分析,建立多元二次回归方程:
Y=0.45+0.0077X1+0.0016X2+0.0044X3+
0.0025X1X2+0.0025X1X3+
0.0045X2X3-0.0099X12-
0.021X22-0.017X32
方程的方差分析结果见表6,模型P<0.01,失拟项不显著,表明回归方程拟合程度良好。决定系数R2为0.9642,说明因变量与考察的自变量之间的线性关系显著。因此,使用该模型可以较好地对巴氏醋杆菌的生物量进行分析和预测。
2.7 培养基最佳配方的确定及验证实验
根据2.6响应面分析实验得到的回归方程绘制出响应面分析图(图9)。该回归方程的抛物线图形开口均向下,说明回归方程存在最大值,即响应面覆盖了最大值所在的区域。由Design-Expert分析得到最适培养基中三个显著影响因素对应的实际值分别为:营养盐5.0 g/L、赖氨酸0.46 g/L、叶酸0.16 g/L。综上所述,最适培养基的组分为:营养盐5.0 g/L、精氨酸0.10 g/L、赖氨酸0.46 g/L、胞嘧啶0.70 g/L、谷氨酰胺0.20 g/L、叶酸0.16 g/L。将最适培养基成分带入上述回归模型方程,预测巴氏醋杆菌在9%(体积分数)乙醇和1%(体积分数)乙酸胁迫条件下最大生物量可达0.45 g/L。

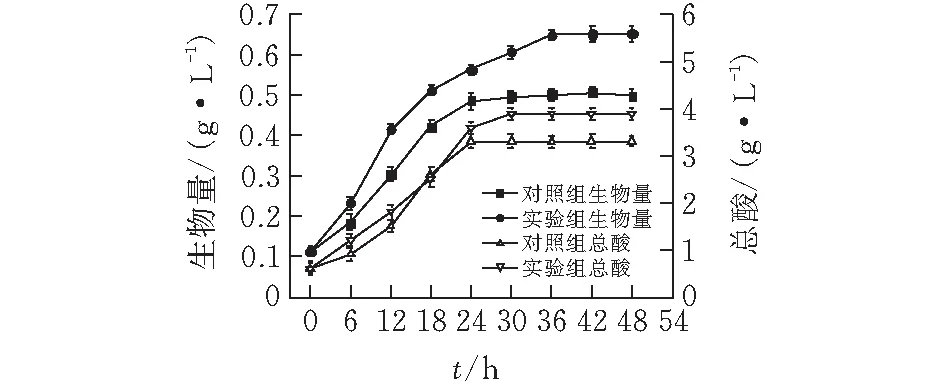
使用上述优化后的培养基进行摇瓶验证实验。实验分为两组,生长组设置对照组为5.0 g/L营养盐培养基,优化后的培养基为实验组,以此来验证对生长的影响;耐性组在接种前加入9%的乙醇和1%的乙酸,来验证对耐性的影响。两组实验的生物量及醋酸产量分别如图6所示。
(a)非醇酸胁迫条件下
由图6a可知,实验组发酵结束时的最大生物量为0.65 g/L,比对照组未添加微量元素的5.0 g/L营养盐培养基的最大生物量提高30%,醋酸产量提高18%,比未优化前的初始营养盐培养基提高54%。由图6b可知,实验组在发酵终点的生物量为0.45 g/L左右,比对照组提高了32%,与模型预测结果相吻合,醋酸产量比对照组提高了14%。
3 结论
对5种有促生长作用的微量元素进行单因素优化预试验,确定其最佳浓度分别为:营养盐4.0 g/L、精氨酸0.10 g/L、赖氨酸0.40 g/L、胞嘧啶0.70 g/L、谷氨酰胺0.20 g/L、叶酸0.14 g/L。在此基础上利用 Plackett-Burman实验,最陡爬坡实验和响应面分析实验对巴氏醋杆菌的发酵培养基进行优化,最终得到的最适发酵培养基组分为:营养盐5.0 g/L、精氨酸0.10 g/L、赖氨酸0.46 g/L、胞嘧啶0.70 g/L、谷氨酰胺0.20 g/L、叶酸0.16 g/L。对优化后的培养基进行摇床发酵验证,在此最优培养基中发酵60 h的最大生物量和最大产酸量,比5.0 g/L的纯营养盐培养基提高了30%和18%;在醇酸胁迫条件下的最大生物量和最大产酸量,比5.0 g/L的纯营养盐培养基提高了32%和14%。

