基于AGEs的糖尿病在牙周病发展过程的影响机制研究
徐孟丹 孙珍 陶庭亮 鲍利红 邹多宏
牙周病的引起原因有很多,主要包括菌斑、结石、不当刷牙等均可加速牙周病的形成,此外还受到遗传因素及基础病的影响,最新的研究表明患者的基础病如糖尿病等可能在牙周病的发展过程中其推进作用[1-2],临床报道显示糖尿病和牙周病相互作用并相互影响,糖尿病患者牙周病的发病率显着增加。牙周治疗后,可以适当控制和改善糖尿病的症状,晚期糖基化终末产物 (advanced glycationend products,AGEs) 水平可能与糖尿病牙周病患者有一定的关联,最新研究表明血浆AGEs水平与T2DM患病风险呈现负相关[3],但具体尚不明确。
基于以上研究背景,本研究拟通过构建大鼠牙周病模型及糖尿病模型,明确糖尿病在牙周病的诱导过程中起到的作用,并初步探索其作用机制[4]。
1 材料与方法
1.1 主要实验材料
水合氯醛、链脲佐菌素(Sigma 公司,美国);正畸结扎丝(长沙天天齿科器材有限公司); 葡萄糖检测试剂盒(上海碧云天);白介素6、肿瘤坏死因子、晚期糖基化终末产物ELISA检测试剂盒 (武汉service-bio); AGEs抗体(Abcam,英国); GAPHD抗体、BCA定量试剂盒、蛋白酶抑制剂、RIPA裂解液(北京康为世纪生物有限公司); 反转录及定量试剂盒(北京全式金生物试剂有限公司)。
1.2 主要仪器
台式离心机(ALLEGA X-12,贝克曼,美国); -80 ℃冰箱(902-ULTS)、酶标仪(Multiskan FC)(Thermo Scientific,美国)。
1.3 实验动物
60 只SPF级雄性SD大鼠,体重180~220 g(北京维通利华实验动物有限公司),并饲养于实验动物中心。饲养条件: 12 h循环黑白,温度20~24 ℃,相对湿度 50%~55%,每笼4 只,无菌条件饲养。
实验动物分组情况,60 只SD大鼠随机分为4 组,每组15 只,即正常组(C):正常饮食不干预;大鼠糖尿病模型组(T2DM):通过注射链脲佐菌素 (STZ) 的方式构建大鼠糖尿病模型;牙周病模型组(CP):正畸结扎丝加医用缝合线结扎下颌磨牙牙颈部构建牙周病模型;糖尿病结合牙周病模型组(T2DM & CP):大鼠糖尿病模型的基础上正畸结扎丝加医用缝合线结扎下颌磨牙牙颈部。
1.4 大鼠血糖测定
每周称取大鼠体重,造模后4、8 周抽取各组大鼠空腹血液,按照试剂盒方法检测各组大鼠血糖水平。
1.5 牙周探诊深度与菌斑指数
于模型4、8 周后,测量大鼠实验区牙周探诊深度(probing depth,PD) 和菌斑指数(mycelium index,MI),取大鼠血液用于检测血糖,
1.6 大鼠血清中IL-6、TNF-α、AGEs水平检测
取各组大鼠血清,用ELISA方法检测血清中IL-6,TNF-α、AGEs 水平。在酶标仪上,于450 nm处,以空白对照孔调零后测各孔A值。
1.7 Q-PCR
用Q-PCR法检测大鼠牙周组织中AGEs基因表达水平,TRIZO提取RNA,加入引物反转录采用反转录试剂盒,于42 ℃,30 min,85 ℃加热5 min后再降温至4 ℃反转录成cDNA, 保存至-20 ℃备用。实时定量PCR采用两步法进行第一步: 90 ℃ 5 s, 60 ℃ 30 s 约45 个循环,第二步: 95 ℃ 15 s。
1.8 Western-blot
用Western-blot法检测大鼠牙周组织中AGEs 蛋白表达水平,RIPA提取组织蛋白,用BCA法按照试剂盒说明书进行蛋白定量,并用PBS缓冲液调整浓度。配制凝胶,电泳采用70 V电压20 min,120 V至电泳结束。切胶,制作三明治后300 mA转膜1.5 h,将蛋白转移至0.45 μm的PVDF膜上。 5%的脱脂牛奶封闭1 h,TBST洗膜3 次每次5 min,加入一抗孵育4 ℃过夜,TBST洗膜3 次每次5 min,二抗孵育1 h,加入显影液,曝光。
2 结 果
2.1 各组大鼠基本情况及体重变化
对照组大鼠毛发、进食、精神状态均正常,T2DM及T2DM & CP在模型建立8 周时精神状态差、毛发沾染较多液体,饮水量增加明显,饲养垫料出现恶臭,大鼠行动明显减少。各组大鼠体重变化情况如图1所示,T2DM、T2DM & CP与正常组大鼠相比体重明显下降,其中T2DM在第8 周出现一只大鼠死亡,T2DM & CP在模型构建第8 周出现3 只死亡。

Fig 1 各组大鼠体重变化(与对照组比较,① P<0.05; 与CP组比较,② P<0.05)
2.2 各组大鼠血糖水平
如图2所示,与对照组相比,STZ给药4 周后,大鼠血糖明显高于正常组(P<0.05);给药STZ 8 周后,给药大鼠血糖继续升高(17.9 mmol/L),明显高于正常对照组(4.6 mmol/L)。
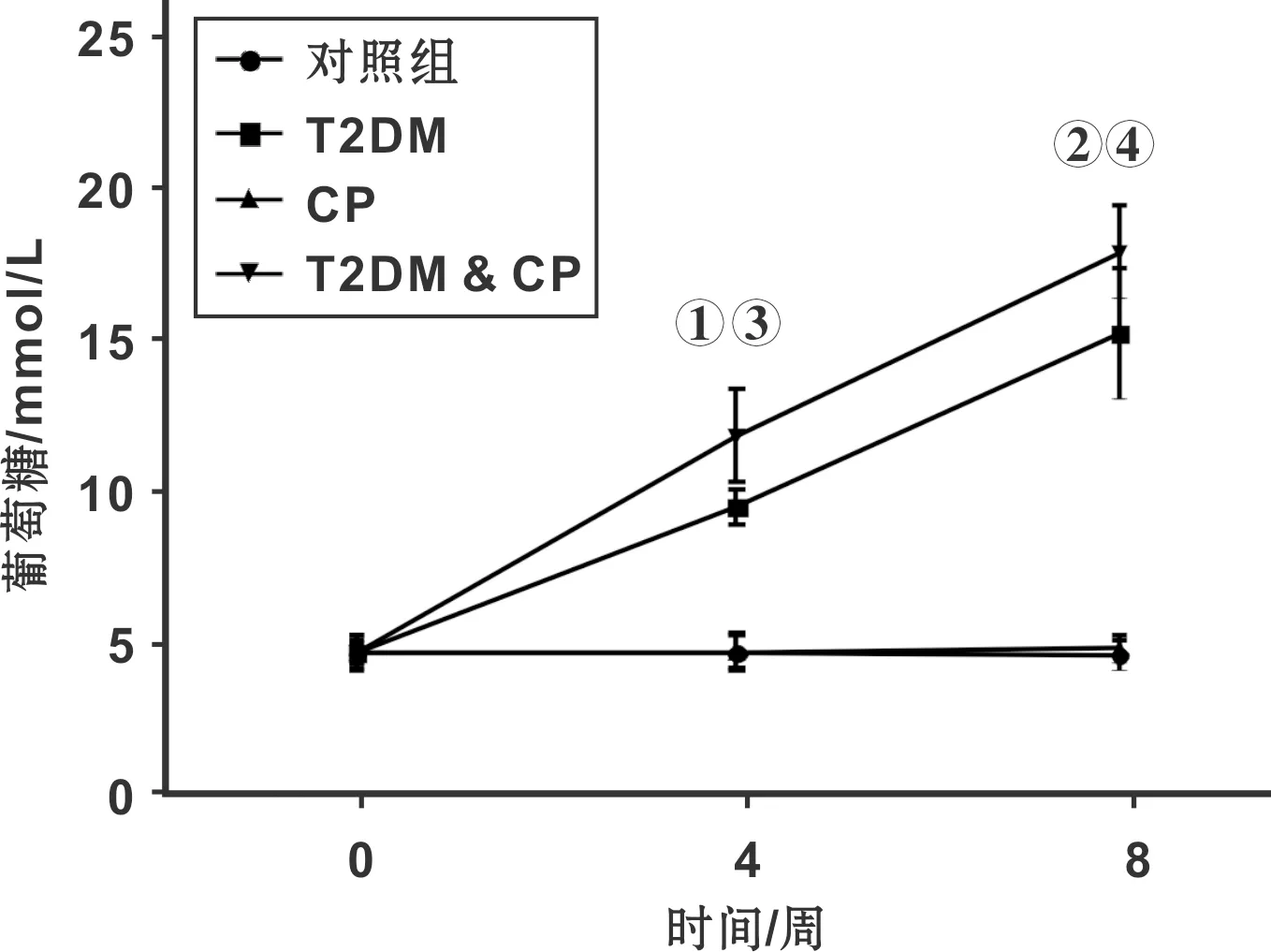
Fig 2 各组大鼠血糖变化(与对照组比较,① P<0.05,② P<0.01; 与CP组比较,③ P<0.05,④ P<0.01)
2.3 各组大鼠牙周探诊深度与菌斑指数
如表1所示,与对照组相比,STZ给药4 周后,大鼠牙周探诊深度明显高于正常组(P<0.01);给药STZ 8 周后,给药大鼠牙周探诊深度继续加深,明显高于正常对照组。且与CP组相比,T2DM & CP组大鼠牙周探诊深度明显加深,菌斑指数升高。
2.4 大鼠血清中IL-6、TNF-α、AGEs水平
如图3所示,与对照组相比,STZ给药4 周后,大鼠IL-6、TNF-α、AGEs水平明显高于正常组(P<0.05);给药STZ 8 周后,给药大鼠IL-6、TNF-α及AGEs水平水平继续升高,且与CP组相比,T2DM & CP组大鼠IL-6、TNF-α及AGEs水平更高(P<0.01,P<0.05,P<0.01)。
2.5 大鼠牙周组织中AGEs基因及蛋白表达水平
如图4所示,与对照组相比,STZ给药4 周后,大鼠AGEs基因与蛋白水平明显高于正常组(P<0.05); 给药STZ 8 周后,给药大鼠AGEs水平继续升高,且与CP组相比,T2DM & CP组大鼠AGEs水平显著高(P<0.01)。
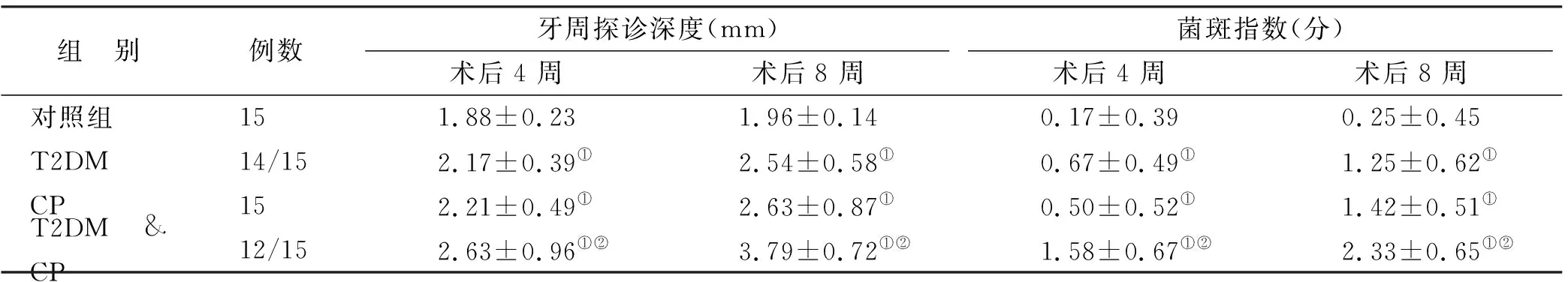
表1 各组大鼠牙周探诊深度与菌斑指数情况
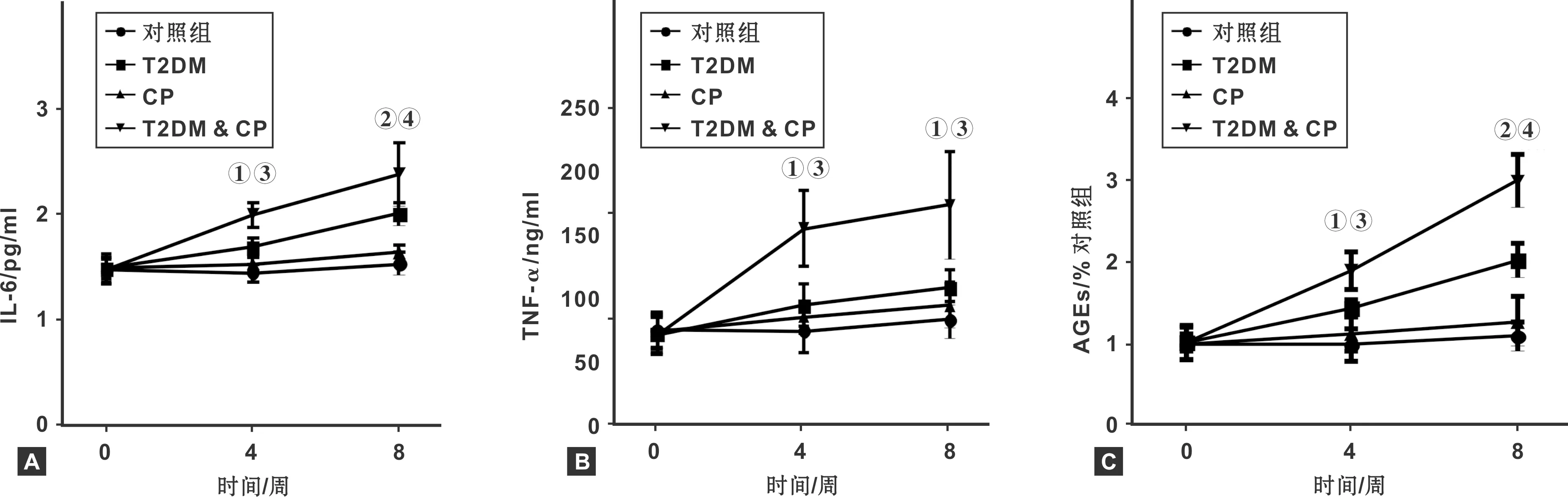
图3 各组大鼠血清中IL-6 (A)、TNF-α(B)和AGEs(C)水平变化(与对照组比较,① P<0.05,② P<0.01; 与CP组比较,③ P<0.05,④ P<0.01)
3 讨 论
虽然T2DM和CP的相关性已被广泛报道,但是CP与T2DM之间何种关联尚不清楚[5]。本研究中,模型组大鼠在STZ给药8 周时精神状态差、毛发沾染较多液体、饮水量增加明显,饲养垫料出现恶臭,大鼠行动明显减少等症状。牙周探诊深度和菌斑情况是牙周病发病过程中主要评价指标,通过检查牙周探诊深度和菌斑指数可以更直观的观察大鼠牙周情况,在给药STZ给药8 周后,大鼠牙周探诊深度继续加深,明显高于正常对照组。且与CP组相比,T2DM & CP组大鼠牙周探诊深度明显加深,菌斑指数升高(表1),显示糖尿病症状会加速牙周病的进展。
牙周病的发病过程常伴随机体全身反应,如炎性因子的变化等研究认为微生物刺激牙周发炎可引起促炎症因子IL-6和TNF-α发生变化[6],并进入体循环干扰胰岛素的功能进而扰乱胰岛素受体及胰岛素信号传导。其中,TNF-α作为第一个炎性因子参与肥胖诱导的胰岛素耐受。TNF-α在胰岛素功能受损后通过外周摄取葡萄糖增加丝氨酸胰岛素受体底物磷酸化 (IRS-1),从而抑制易位葡萄糖转运体进入细胞膜[7]。因此IL-6和TNF-α作为常用炎性因子可以反应出机体炎症变化水平,ELISA结果显示STZ加上结扎下颌磨牙手术后,大鼠体内的IL-6和TNF-α水平远高于单独STZ或结扎下颌磨牙手术组(图3),糖尿病可以加重结扎下颌磨牙手术引起的大鼠全身炎症反应症状。研究报道牙周治疗可以降低牙周炎患者伴高血糖患者血糖水平,反应出牙周病的进展与血糖水平的相关性。本次实验结果显示,大鼠单纯正畸线结扎并不会引起血糖发生明显变化,但是STZ给药结合正畸线结扎大鼠的血糖水平高于单纯STZ给药组(图2),说明单纯牙周病患者并不会出现血糖升高现象,但是糖尿病基础病患者在发生牙周炎症症状时可能会加重其血糖水平。但是其具体的机制仍不明确。晚期糖基化终末产物受体 (RAGE)[8-10]是一种多配体受体,研究报道称其可通过与相应的配体结合后信号,影响机体的免疫防御和创伤面的愈合,并参与多种炎症反应,可调控多条免疫相关通路[11-13]。在牙周组织中, 本次研究表明在AGEs在病理状态下 (模型) 的表达显著增加,且在糖尿病伴牙周病大鼠体内的表达量显著高于单纯牙周病大鼠,提示AGEs有可能参与糖尿病伴牙周病或牙周组织损伤过程,促进牙周炎的发生发展。
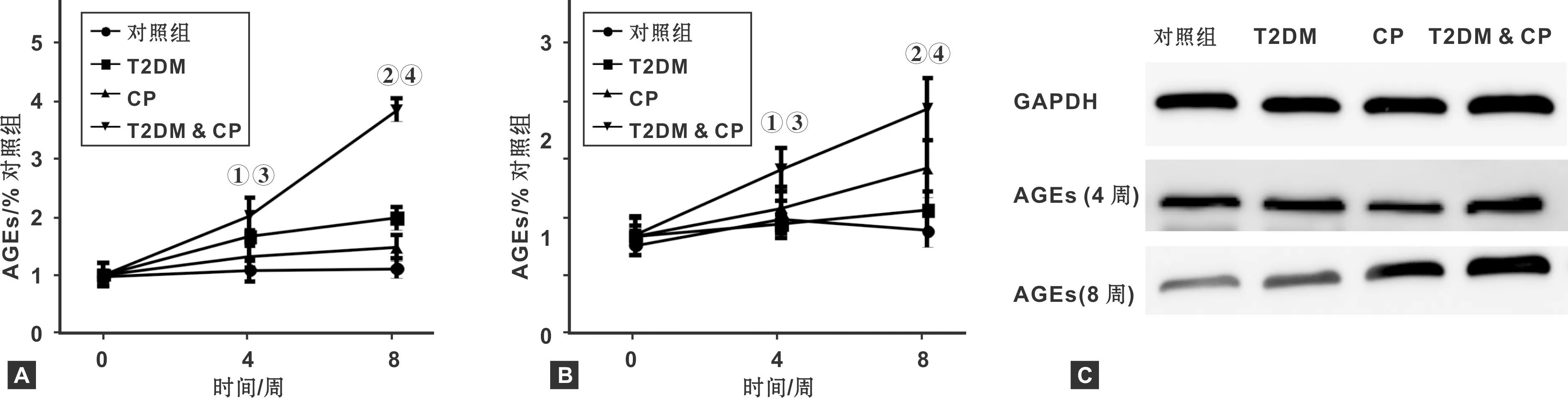
图4 各组大鼠组织中AGEs基因(A)与蛋白(B、C)水平变化情况(n=6)(与对照组比较,① P<0.05,② P<0.01; 与CP组比较,③ P<0.05,④ P<0.01)

