张应力对小鼠蝶枕软骨联合细胞增殖及低氧诱导因子-1α表达的影响
高国杰 夏艳 胡江天
软骨联合(synchondrosis)是颅底的生长中心,以软骨内成骨的方式实现颅底的纵向生长,进而影响着颌面部的形态[1-3]。认识颅底软骨联合生长发育的调控机制对深入理解颌面发育畸形的病因和矫治机制有重要意义。早期的观点认为颅底软骨联合的生长受基因主导,而近年来的研究显示适宜的牵张力刺激也能增强颅底软骨联合细胞(SOSCs)的增殖和基质合成,从而促进软骨组织的生长[4]。
通常情况下,氧为细胞生存和代谢活动所必需,而氧供给依赖于血液循环。颅底软骨联合因缺乏血管而处于低氧状态,软骨细胞适应低氧环境的机制尚不完全明了。近年来的研究显示,低氧诱导因子-1α(hypoxia-inducible factor-1α,Hif-1α)对软骨在低氧条件下的生长和表型维持具有重要意义[5]。Hif-1α是一种转录因子,低氧条件下广泛表达于包括软骨在内的多种组织[6],调控着细胞的代谢、生存和多种基因的转录[7]。
在软骨组织,Hif-1α能增强软骨细胞增殖、分化关键调控因子Sox9和II型胶原的表达[5,8];而适宜的牵张力刺激也能促进这两个因子在颅底软骨联合细胞的表达[9]。这些研究结果提示,HIF-1α可能处于软骨细胞增殖、分化调控信号链的上游位置,且与张应力具有相似的作用效果。但HIF-1α是否参与介导牵张力对颅底软骨联合细胞的生物学效应尚不清楚。本研究拟观察张应力作用下体外培养颅底软骨联合细胞增殖及HIF-1α表达的变化,为进一步探究该问题提供相关依据。
1 材料与方法
1.1 细胞培养
取1 d龄C57BL/6小鼠10只(昆明医科大学实验动物中心),按前期研究的方法获取SOSCs进行体外培养[10]。Hif-1α在常规培养条件下会因快速降解而难以检测。为了解Hif-1α在培养细胞的表达情况,本实验参照文献[11]报道的方法用含氯化钴(CoCl2·6H2O,Sigma公司,美国)的培养基对第二代细胞进行了模拟低氧培养和免疫组织化学染色。方法为;待细胞爬片生长至约60%满底时更换含100 μmol/L氯化钴的培养基; 3 h后用4%多聚甲醛固定细胞,按Hif-1α抗体(1 ∶100稀释,Abcam公司,美国)说明书进行免疫组织化学染色。
1.2 张应力加载
将第二代SOSCs以1×105/mL的密度等量接种于6 孔BioFlex加力培养板(Flexcell公司,美国)。待细胞生长至约80%满底时,按前述方法更换含100 μmol/L氯化钴的培养基模拟低氧培养。 3 h后,实验组细胞用计算机控制张力测试机(FX5K型,Flexcell公司,美国)对实验组细胞加载循环张应力,牵张形变率(elongation%)分别为3%、6%、9%,频率为1 Hz,持续时间为1 h;对照组细胞不加力,按相同条件培养。
1.3 流式细胞术检测
加力结束后收集各组细胞,依次用70%乙醇溶液4 ℃固定细胞12 h;用RNA酶(50 μg/mL)37 ℃消化RNA 30 min;用碘化丙啶(100 μg/mL)冰上避光反应30 min;随即用流式细胞仪(FACS,BD公司,美国)检测细胞周期,根据细胞周期计算增殖指数(proliferative index,PI),计算公式如下:
PI=(S+G2/M)/(G0/G1+S+G2/M)×100%
1.4 Western blotting检测
加力结束时即刻用含蛋白酶抑制剂PMSF的RIPA裂解液(上海碧云天公司)于冰上裂解细胞,提取细胞总蛋白。各样品取等量蛋白(50 μg)进行5% SDS-PAGE凝胶电泳;分离后的蛋白转至PVDF膜,用5% BSA封闭非特异性蛋白,洗膜后分别加入1 ∶1 000稀释的兔抗小鼠Hif-1α抗体(Abcam公司,美国)和兔抗小鼠β-actin抗体(Abcam公司,美国)4 ℃孵育过夜;洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG,室温反应2 h。采用ECL化学发光法获取蛋白印迹图像;用图像分析软件(IPP6.0,Media Cybernetics公司,美国)测量各印迹条带的灰度值,用于计算Hif-1α的相对表达量;检测重复3 次。
1.5 数据统计分析

2 结 果
2.1 体外培养小鼠SOSCs中Hif-1α的表达
用含100 μmol/L氯化钴的DMEM培养基培养3 h后,免疫组织化学染色检测到Hif-1α在培养细胞广泛表达,阳性着色见于胞浆和胞核,且胞核着色较胞浆深而密集(图1)。
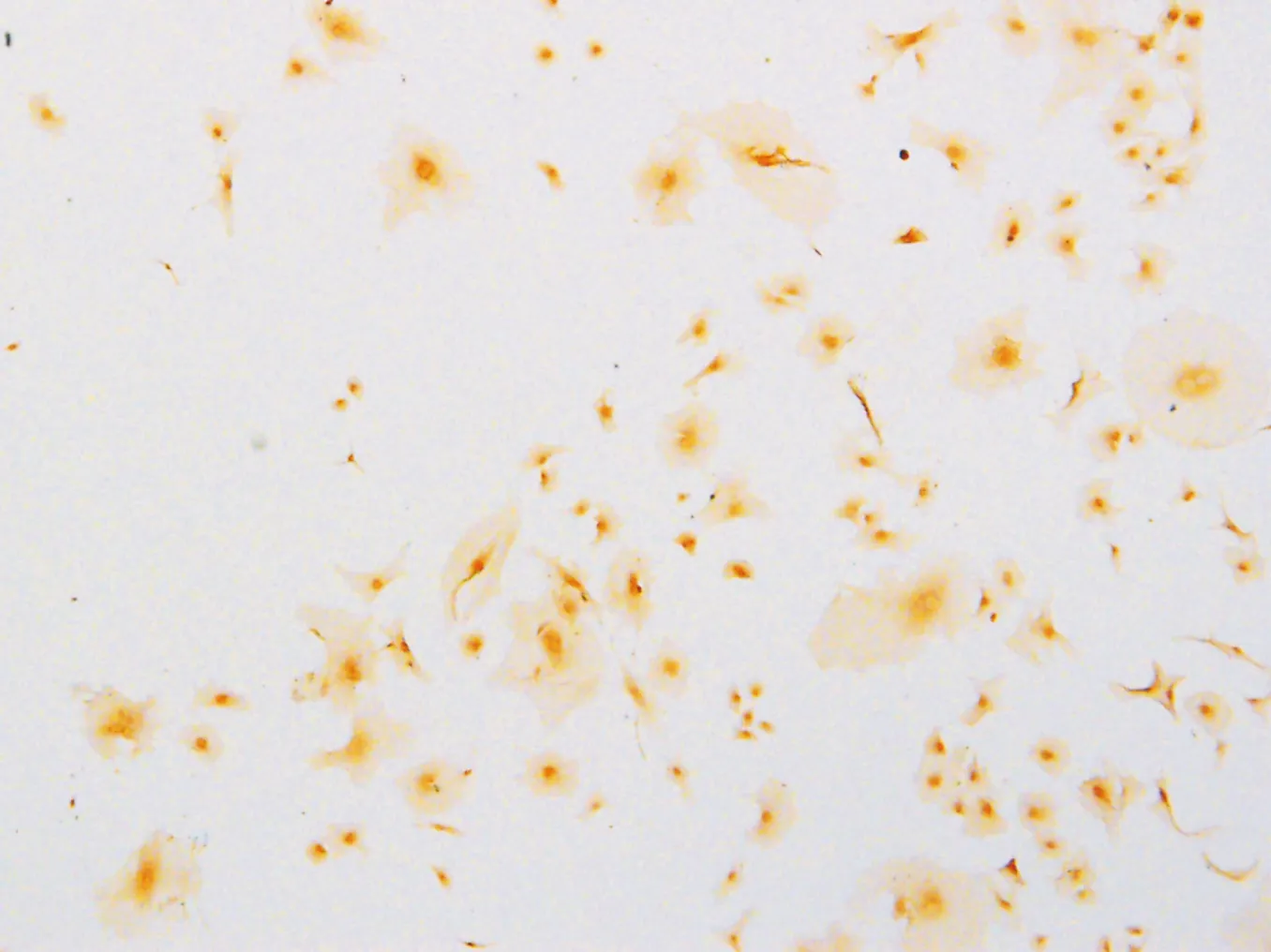
图1 小鼠SOSCs中Hif-1α的表达(ICH,DAB显色,×200)
2.2 牵张力对体外培养小鼠SOSCs增殖的影响
频率为1 Hz的循环张应力刺激1 h后,各实验组细胞的增殖指数都较对照组显著增加(P<0.01);其中,牵张形变率为6%时细胞增殖指数较对照组增加最多(14.1%),牵张形变率为3%和9%时增殖指数分别较对照组增加9.9%和8.7%(表1)。
2.3 牵张力对体外培养小鼠SOSCs中Hif-1α表达的影响
表1 循环张应力刺激后小鼠SOSCs的增殖指数
张应力刺激1 h后各组细胞Hif-1α的蛋白免疫印迹见图2A。 图像测量分析结果(图2B)显示:Hif-1α的相对表达量在牵张形变率为6%时最高(2.2),3%牵张形变率时为1.54,9%牵张形变率时为1.37; 各实验组Hif-1α的相对表达量都较对照组显著增强(P<0.05)。
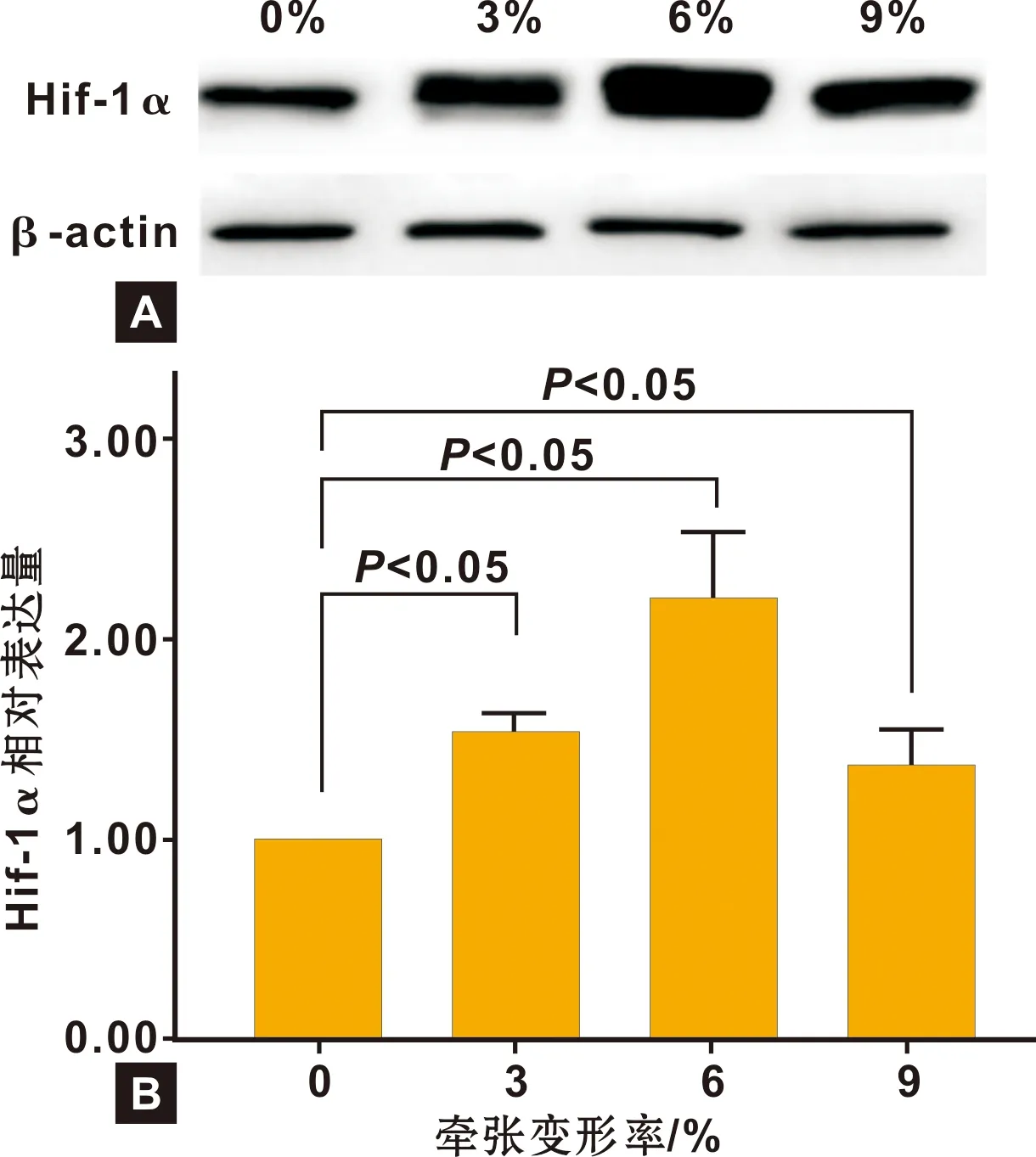
A: 蛋白免疫印迹; B: Hif-1α相对表达量
3 讨 论
颅底软骨联合因缺乏血管而处于低氧状态,软骨组织在低氧条件下维持表型和生长的机制尚不完全明确。近年来,随着低氧诱导因子的发现和研究的深入,对该问题的认识得到了推进。在已知的低氧诱导因子三个成员中,Hif-1α与软骨组织的关系密切。该因子包含α和β两个亚基,其中Hif-1α不仅能通过糖酵解途径为软骨细胞提供能量,还能通过与基因转录启动子结合促进软骨细胞增殖、分化关键调控因子Sox9的表达。Hif-1α蛋白在常氧条件下不稳定,原因在于其含有氧依赖的降解结构域(oxygen dependence degradation domain,ODDD),常氧条件下,脯氨酸羟化酶(prol-hydroxylas,PHD)使该结构域的脯氨酸羟基化,促进Hif-1α与肿瘤抑制因子VHL(von hippel-lindau)结合,继而通过pVHL介导的泛素化-蛋白酶途径在数分钟内快速降解[12]。在低氧条件下,PHD被抑制,Hif-1α得以稳定表达并与Hif-1β结合,在Hif-1β的辅助下进入细胞核发挥转录调控作用。
常规体外培养条件时的氧浓度通常高于体内软骨组织的生理水平,为防止Hif-1α因降解而难以被检测,需要对细胞进行低氧培养。氯化钴是一种细胞培养实验中常用的低氧模拟剂[13],其原理是钴离子能通过与PHD竞争结合Hif-1α分子的ODDD来抑制Hif-1α的降解,从而模拟低氧状态下细胞Hif-1α的表达[14]。氯化钴对培养细胞是否存在副作用尚不清楚,但有研究显示适当浓度的氯化钴对培养细胞的数量和功能无明显不利影响[15]。本研究参考相关研究,选择含100 μmol/L氯化钴的培养基对细胞进行培养,免疫组织化学染色显示Hif-1α在培养细胞广泛表达,表明所用实验方法可有效抑制体外培养小鼠蝶枕软骨联合细胞Hif-1α的降解,为在加载张应力后检测Hif-1α表达明确了实验条件。
力学刺激是颌面畸形矫形治疗的主要手段,牵张力对颌骨生长改建的积极作用已经得到较为深入的认知。随着颅底与颌面的形态联系日益受到重视,近年来有学者对软骨联合进行了牵张力加载实验。现有的研究表明,牵张力刺激可通过增强Sox9、Col2a1、Cbfa1、Vegf等多种因子的表达而促进颅底蝶枕软骨联合细胞的增殖、分化和基质合成[9,16-17]。这些研究成果显示了牵张力刺激对颅底软骨联合生长的积极影响,为颌面畸形力学矫治机制的相关研究带来了新的启示。但牵张力刺激对颅底软骨联合的生物学效应及其产生机制还未充分明确。本研究的结果显示,经不同牵张形变率(3%、6%、9%)的循环张应力刺激后细胞的增殖指数和Hif-1α表达水平都较对照组明显增加(P<0.05),表明循环张应力对体外培养小鼠蝶枕软骨联合细胞的增殖及Hif-1α表达具有促进作用;同时,两者的增加程度都在牵张形变率为6%时最多,提示张应力可能存在适宜的强度范围。综合以往的报道和本研究的结果,本研究推测增强Hif-1α的表达可能是张应力促进软骨细胞增殖的作用途径之一。
4 结 论
综合本研究的结果和相关研究的报道,一定强度的循环张应力对体外培养的小鼠颅底蝶枕软骨联合细胞的增殖和Hif-1α表达具有促进作用;循环张应力有可能通过上调Hif-1α的表达而促进软骨细胞的增殖,但其具体机制需要进一步研究。

