丁苯酞软胶囊联合艾司西酞普兰治疗卒中后抑郁的临床研究
赵新静 卢 梅 乌欣蔚 单培彦
山东大学齐鲁医院,山东 济南250012
脑血管疾病与心血管疾病、恶性肿瘤构成人类死亡的三大主要原因,脑卒中是急性脑血管病,具有较高的致残性和致死性,其分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中占70%~80%[1]。卒中后抑郁(poststroke depression,PSD)是脑卒中后常见的并发症之一,影响25%~33%的脑卒中患者[2-3]。研究显示卒中后抑郁患者肢体功能恢复差,认知功能减退明显[4],致残及致死率明显升高,严重影响脑卒中患者的康复锻炼效果[5]和预后[6],影响脑卒中患者的生存质量[7]。虽然PSD 这一概念早在100 年前即被提出[8],但系统的PSD 药物对照研究直到20 世纪70年代才逐渐开展起来[9]。1984年去甲阿米替林被随机-对照双盲试验证实治疗PSD有效,成为第一个被证实临床疗效的抗焦虑抑郁药[10]。目前国内外研究显示,早期使用5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRIs)类抗抑郁药可显著缓解卒中后抑郁,改善脑卒中预后[11],但具体的最佳用药选择、用药时机、用药人群尚存争议[12]。艾司西酞普兰是西酞普兰的对映异构体,属于SSRIs 类抗抑郁剂,可用于治疗焦虑症、抑郁症及惊恐发作等[13]。丁苯酞软胶囊有利于侧支循环建立,改善脑部供血,目前广泛应用于急性/亚急性缺血性脑卒中的治疗[14]。目前,国外虽暂无丁苯酞治疗PSD 的相关报道,但研究发现丁苯酞联合抗焦虑抑郁药物治疗PSD 疗效明显优于单用抗焦虑抑郁药物。本文探究丁苯酞软胶囊和艾司西酞普兰联合治疗卒中后抑郁的临床疗效及安全性。
1 资料与方法
1.1 一般资料 收集2018-06—2020-01 就诊于山东大学齐鲁医院神经内科及干部保健神经内科专业的急性缺血性脑卒中患者213 例,根据PSD 诊断标准,其中102例患者存在PSD。应用随机数字表法将PSD 患者随机分为研究组及对照组,每组51 例。研究组男27 例,女24 例,年龄(63.02±8.51)岁,予以丁苯酞软胶囊联合艾司西酞普兰治疗。对照组男28例,女23例,年龄(63.45±9.41)岁,单纯予以艾司西酞普兰治疗。采集所有纳入患者的病史,进行详细的神经系统体格检查,并进行相关量表评估。研究组与对照组年龄、性别比较差异均无统计学意义(P>0.05)(表1)。本次研究由山东大学齐鲁医院伦理委员会批准,入组患者均签署知情同意书。

表1 研究组和对照组一般资料比较Table 1 Comparsion of demographics features between the study group and control group
1.2 纳入和排除标准 (1)纳入标准:①符合2014年版中国急性缺血性脑卒中诊治指南诊断标准,且头颅MRI 证实急性缺血性脑卒中;②符合第3 版《中国精神障碍分类与诊断标准》抑郁症诊断标准,HAMD评分≥18分;③知情同意;④可在指导下完成量表的填写。(2)排除标准:①在缺血性脑卒中前有精神分裂症及其他神经症性障碍史者;②合并心、肝、肾脏等严重器质性病变者;③知情不同意者;④存在意识障碍、严重失语、认知功能障碍及其他无法完成量表者。
1.3 治疗方法 根据2014 年版中国急性缺血性脑卒中诊治指南诊断,研究组及对照组患者均接受急性缺血性脑卒中基础治疗,包括抗血小板聚集、调脂稳定斑块,如有高血压、糖尿病,予以合理的降压、降糖治疗。在此基础上,研究组采用丁苯酞软胶囊(石药集团恩必普药业有限公司,国药准字H20050299),3 次/d,每次2 粒(200 mg)及艾司西酞普兰(山东京卫制药有限公司,国药准字H20080599),1 次/d,每次1 粒(5 mg)。对照组在基础治疗上仅采用艾司西酞普兰口服,服用方法同观察组。2组均连续药物治疗8周。
1.4 疗效观察 使用美国国立卫生研究院卒中量表(NIHSS)评定患者神经功能缺损程度;日常生活能力使用Barthel 指数评定;应用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)和汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评定患者抑郁及焦虑程度。量表的评定由2 名经过正规培训的医师完成,分别在治疗前、治疗后8 周进行评定。使用HAMD评分下降率评价药物治疗的临床疗效,HAMD下降>75%为疗效显著,25%~75%为好转,<25%或评分增加为无效。统计2 组患者治疗期间出现的相关不良反应,评价药物安全性。
1.5 统计学分析 使用SPSS 19.0 进行统计学分析。计量资料以均数±标准差(±s)表示,计数资料使用百分率(%)表示。两独立样本计量资料先进行方差齐性检验,方差齐则采用t 检验;计数资料使用χ2检验,不符合χ2检验的条件时用Fisher 确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 2 组临床疗效比较 治疗后的第8 周末,研究组有效率92.16%,对照组有效率76.47%,观察组总有效率明显高于对照组(P<0.05)。见表2。
2.2 2 组治疗前后神经功能缺损程度比较 治疗前研究组与观察组NIHISS 评分差异无统计学意义(P>0.05);治疗后的第8周末,2组NIHISS评分均较治疗前显著下降,且研究组低于对照组,差异均有统计学意义(P<0.05)。见表3。
2.3 2组治疗前后日常生活能力评分比较 治疗前2 组Barthel 指数评分差异无统计学意义(P>0.05);治疗后的第8周末,2组Barthel指数评分均较治疗前显著上升(分别为t=17.605,P<0.001;t=18.047,P<0.001),且研究组显著高于对照组(t=2.230,P<0.05)。见表4。
2.4 2组治疗前后抑郁、焦虑情绪比较 治疗前2组患者HAMD 和HAMA 评分比较差异无统计学意义(P>0.05);治疗8 周后,2 组HAMD 和HAMA 评分均较治疗前显著下降,研究组患者抑郁及焦虑情绪较对照组明显减轻(P<0.001)。见表5。
表3 研究组与对照组治疗前后NIHISS评分比较 (分,±s)Table 3 Comparsion of NIHISS score between the study group and control group before and after treatment (scores,±s)

表3 研究组与对照组治疗前后NIHISS评分比较 (分,±s)Table 3 Comparsion of NIHISS score between the study group and control group before and after treatment (scores,±s)
组别研究组对照组t值P值n 51 51治疗前14.45±3.49 14.04±2.73 t值15.305 15.677 P值<0.001<0.001 0.663 0.509治疗后5.72±2.09 6.94±1.73 3.205 0.002
表4 研究组与对照组治疗前后Barthel指数比较 (分,±s)Table 4 Comparsion of Barthel index between the study group and control group before and after treatment (scores,±s)
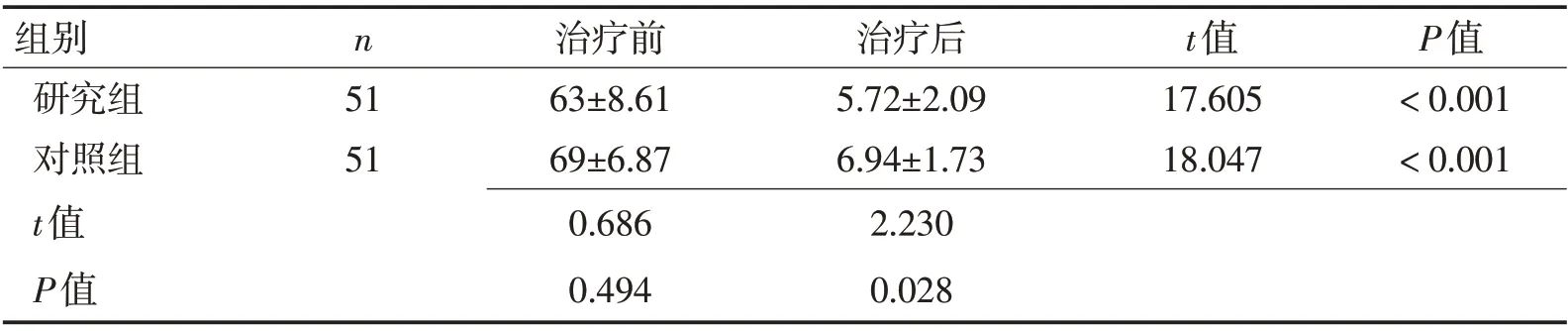
表4 研究组与对照组治疗前后Barthel指数比较 (分,±s)Table 4 Comparsion of Barthel index between the study group and control group before and after treatment (scores,±s)
组别研究组对照组t值P值n 51 51治疗前63±8.61 69±6.87 0.686 0.494治疗后5.72±2.09 6.94±1.73 2.230 0.028 t值17.605 18.047 P值<0.001<0.001
表5 研究组与对照组治疗前后HAMD及HAMA评分比较 (分,±s)Table 5 Comparsion of HAMD and HAMA scores between the study group and control group before and after treatment (scores,±s)

表5 研究组与对照组治疗前后HAMD及HAMA评分比较 (分,±s)Table 5 Comparsion of HAMD and HAMA scores between the study group and control group before and after treatment (scores,±s)
组别研究组对照组t值P值n HAMD评分HAMA评分51 51治疗前22.57±1.90 22.89±2.89 0.663 0.509治疗后10.06±2.31 13.78±2.35 8.070<0.001 t值29.868 17.777 P值<0.001<0.001治疗前18.54±3.14 18.10±2.22 0.837 0.405治疗后9.45±2.60 12.98±2.69 6.729<0.001 t值15.916 10.468 P值<0.001<0.001
2.5 不良反应 研究期间共11 例患者出现不良反应,其中研究组6 例,对照组5 例,2 组不良反应发生率无明显差异(χ2=0.102,P=0.750)。研究组最常见的不良反应为恶心,其次为嗜睡及肝功能异常(轻度转氨酶升高);对照组最常见的不良反应为头痛、恶心。不良反应均为轻中度,且停药后不良反应逐渐减轻至消退。
3 讨论
研究显示PSD可发生在卒中后的任何时间[15-16],一般在卒中发生后的1 a 内PSD 出现的概率较大,而后随着病程延长概率逐渐降低[17]。PSD严重影响脑卒中患者的预后,给患者及其家庭带来更多的身心痛苦。目前国内外对于PSD 的具体发病原因知之甚少,大多认为PSD 是社会心理学及生物学等多因素联合导致的[18]。研究显示PSD 与卒中后神经功能缺陷和认知功能损害密切相关,间接表明PSD可能是对这些生理缺陷的心理反应[19]。另外,PSD的发生与很多社会心理因素有关,如有精神疾病史、神经质性格、社交孤立的人群更易在卒中后出现PSD[20]。
治疗PSD 的总体原则是采用药物治疗、心理治疗及康复训练等综合性治疗。近年来,虽然PSD 的评价量表工具可靠,治疗药物也被证实有效,但临床上PSD的发病率未明显下降[15-16],原因之一可能是临床多认为在卒中早期用药没有必要,并考虑到药物的不良反应问题[21];另一个原因是抗焦虑抑郁药物种类繁多,临床医生很难做出最适合患者的个体化治疗。一项Meta 分析比较了西酞普兰、氟西汀、帕罗西汀、奈非西坦等对PSD患者的疗效,发现帕罗西汀可能是PSD 初始治疗的首选药物。SSRIs 类药物能选择性抑制突触前膜对5-HT 的再摄取,目前被广泛使用于焦虑、抑郁患者的临床治疗。随机、双盲、安慰剂对照试验(placebo-controlled,randomized double-blind,RCT)证实,SSRIs可有效降低PSD患者HAMD 评分及病死率[22-23]。艾司西酞普兰是SSRIs的一类,不良反应小,是临床治疗抑郁症及焦虑症的一线用药[24]。研究发现草酸艾司西酞普兰可显著改善PSD 患者的抑郁情绪[25]。一项RCT 结果显示,与安慰剂相比,接受艾司西酞普兰治疗的脑卒中患者发展为PSD的概率明显减少[26]。该试验中<65岁的患者予以20 mg/d艾司西酞普兰,而≥65岁的患者予以10 mg/d,艾司西酞普兰在两个人群中均有效,证明艾司西酞普兰在老年脑卒中患者中酌情减量仍有较好的临床效果。研究发现艾司西酞普兰可显著改善大鼠的抑郁情绪并减少大鼠海马细胞的凋亡,促进海马区神经再生[27]。艾司西酞普兰还能改善焦虑抑郁动物模型中海马、额叶部位神经递质的减少,如去甲肾上腺素、5-HT、多巴胺[28]。另外,艾司西酞普兰还可通过影响脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)起到神经保护作用[29]。
丁苯酞是l-丁苯酞(l-3-N-butylphthalide,1-NBP)和dl-丁苯酞(d-l-3-N-butylphthalide,dl-NBP)的混合物,是从芹菜籽中提取的。大量临床研究证实了丁苯酞在缺血性脑卒中治疗中的临床疗效及安全性[3,30-31]。丁苯酞改善缺血性脑卒中的机制较为复杂,已报道其可以减小脑梗死面积,减轻氧化应激损伤,抑制血小板聚集,促进脑部侧支循环建立,保护线粒体功能,减轻炎症相关反应等[32]。丁苯酞具有多途、多环节的神经保护作用,目前亦有学者将丁苯酞应用于神经变性疾病患者,如阿尔兹海默病、帕金森病[33]。目前国内外对丁苯酞在PSD中的作用报道罕见,有报道[34]显示丁苯酞软胶囊联合氟西汀治疗PSD 的临床疗效优于单用氟西汀,为丁苯酞软胶囊在PSD的临床应用提供了新的思路。丁苯酞缓解PSD 的病理生理机制可能与其降低PSD 发病过程中的某些炎性细胞因子有关[35];另外,丁苯酞可显著缓解患者神经功能缺损症状,减轻患者的痛苦,也从一定程度上改善了患者的心境障碍。本研究显示丁苯酞软胶囊与艾司西酞普兰联合治疗可显著改善PSD患者的神经功能缺损症状,并改善患者抑郁焦虑情绪,其疗效优于单用艾司西酞普兰。
本研究中使用的药物安全性良好,不良反应较少,研究组和对照组不良反应发生率无明显差异,且不良反应均为轻到中度,患者均可耐受。丁苯酞软胶囊较常见的不良反应为轻度肝功能异常[36],但本研究患者均未出现。
丁苯酞软胶囊和艾司西酞普兰联合治疗可有效改善PSD 患者神经功能缺损,显著降低PSD 患者HAMD 和HAMA 评分,改善PSD 患者焦虑、抑郁情绪,提高患者生存及生活质量。本研究尚存在一些不足,如为回顾性研究,样本量较小,观察疗程较短,尚需大样本、多中心的随机、双盲、对照试验进一步评估丁苯酞软胶囊联合艾司西酞普兰治疗PSD的有效性和安全性。

