脑小血管病患者运动障碍与血清IMA LP-PLA2 BDNF 水平的相关性研究
王天舒 景黎君 滕军放 牛瑞娜
郑州大学第一附属医院,河南 郑州450052
脑小血管疾病(cerebral small vessel disease,CSVD)是指脑小动脉、微动脉、毛细血管、小静脉等微小血管病变引起的脑部病变,病理改变表现为玻璃样变、纤维素样变坏死、小动脉硬化等,脑组织则可发生腔隙性梗死、脑微出血、脑白质疏松、血管周围间隙增宽等变化[1-3]。研究[4]表明CSVD 占所有脑部血管疾病的83.8%,因其发病隐匿,且进展缓慢,早期易被忽视,预后欠佳。运动障碍是CSVD预后不佳患者的常见症状,对患者工作、生活造成极大影响[5]。因此,通过了解影响CSVD 患者运动障碍的相关因素,对于CSVD的治疗指导、预后评价有重要意义。血液生化检查是临床常用的诊疗手段,在病变早期无影像学改变疾病的诊断、治疗及预后评估有重要意义[6]。研究[7-9]发现血清缺血修饰清蛋白(ischemia modified albumin,IMA)、脂蛋白磷脂酶A2(lipoprotein-associated phospho-lipase A2,Lp-PLA2)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是与心脑血管疾病发生密切相关的因子,参与脑血管疾病的发生发展。目前关于IMA、Lp-PLA2、BDNF的研究主要侧重于心脑血管疾病的诊断、预后方面,而与CSVD患者运动障碍的相关研究较少。本研究通过分析CSVD 患者运动障碍与其血清IMA、Lp-PLA2、BDNF水平的相关性,以期为CVSD的诊疗提供参考。
1 资料与方法
1.1 研究对象 选取2019-01—2020-01郑州大学第一附属医院神经内科住院的CSVD患者82例为脑血管疾病组,另从同期来院体检的健康者中选取80 例为对照组。脑血管疾病组男49例,女33例,年龄44~85(66.87±8.50)岁;疾病类型:腔隙性脑梗死30例,脑白质病变12 例,微出血23 例,血管周围间隙扩大17例。对照组男43 例,女37 例,年龄42~80(65.80±9.02)岁。纳入标准:(1)脑血管病组均经磁共振或脑部CT等影像学检查确诊,且符合国际血管改变神经影像标准报告小组提出的CSVD神经影像学标准[10];(2)无颅脑内外动脉重度狭窄史;(3)均接受溶栓、抗血小板等保守治疗手段。排除标准:(1)多发性硬化、中毒、严重的睡眠呼吸暂停综合征等特殊原因造成的脑部影像学改变;(2)大面积脑梗死;(3)恶性肿瘤、脑外伤史及颅内感染者。2 组性别、年龄资料比较差异无统计学意义(P>0.05),具有可比性。研究开始前已经医院伦理委员会批准,受检者对本次内容均知情同意,签署知情同意书。
1.2 研究方法
1.2.1 血清IMA、Lp-PLA2、BDNF 水平检测:抽取受检者入院48 h 内的空腹肘静脉血,肝素抗凝,30 min内以3 000 r/min离心15 min,离心半径10 cm,取上层血清保存于-80 ℃待检。以酶联免疫吸附法试剂盒(广东中山生物工程有限公司)检测IMA、Lp-PLA2、BDNF,严格按照试剂盒说明书步骤操作,将IMA、Lp-PLA2、BDNF和生物素标记的抗体同时温育,洗涤后加入亲和素标记过的过氧化物酶,再次温育洗涤,取出未结合的酶结合物,加入底物A、B,与酶结合物同时作用,于波长450 nm的酶标仪上读取吸光度值,根据标准曲线计算待检样本浓度。
1.2.2 CSVD 患者运动障碍诊断及分组:简式Fugl-Meyer(FM)为运动障碍诊断标准[11],FM 包括上肢部分和下肢部分,总评分0~100分,分数<100分表示存在功能障碍,且分数越低为运动功能障碍越严重,Cronbach’s α系数0.75~0.82。所有患者入院病情稳定后进行FM评估,将FM评分<100分纳入运动障碍组,否则纳入未运动障碍组。
1.2.3 收集CSVD 患者运动障碍影响因素:收集CSVD患者的相关资料,包括性别、年龄、入院时BMI、吸烟史、饮酒史、高血压、糖尿病、颈动脉粥样硬化、CSVD 类型、总胆固醇(total cholesterol,TC)、三酰甘油(triacylglyceride,TG)、低密度脂蛋白胆固醇(low density cipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(hight density cipoprotein-cholesterol,HDL-C)、血同型半胱氨酸(Hcy)、血尿酸(uric acid,UA)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、血红蛋白(hemoglobin,HGB)、红细胞比积(header convertor,HCV)、IMA、Lp-PLA2、BDNF。
1.3 统计学方法 采用SPSS 25.0 统计学软件分析数据,计量资料以均数±标准差(±s)表示,采用t 检验;计数资料以率(%)描述,数据比较采用校正χ2检验,相关性分析采用Pearson相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 2 组血清IMA、Lp-PLA2、BDNF 水平比较 脑血管疾病组血清IMA、Lp-PLA2 水平均高于对照组,血清BDNF 水平低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 2 组相关因素比较 CSVD 患者中34 例发生运动障碍为运动障碍组,其余纳入非运动障碍组。运动障碍组中颈动脉粥样硬化占比及血清IMA、Lp-PLA2、Hcy水平高于对非运动障碍组,血清BDNF水平低于非运动障碍组,差异有统计学意义(P<0.05)。2组性别分布、吸烟史、饮酒史、高血压、CSVD类型、糖尿病占比,以及年龄、入院时BMI、TC、TG、LDL-C、HDL-C、UA、ESR、HGB、HCV 比较差异均无统计学意义(P>0.05)。见表2。
2.3 Logistic 回归分析CVSD 患者发生运动障碍的独立危险因素 将可能影响CSVD 患者发生运动障碍的影响因素为自变量(X),是否发生运动障碍为因变量(Y),对经单因素分析差异有统计学意义的因素进行赋值,发生运动障碍计为1,未发生计为0,赋值结果见表3。Logsitic 回归分析显示,颈动脉粥样硬化、血清IMA、Lp-PLA2、BDNF、Hcy 水平是导致CSVD变患者发生运动障碍的独立危险因素(P<0.05)。见表4。
表1 2组血清IMA、Lp-PLA2、BDNF水平比较(±s)Table 1 Comparison of serum IMA,Lp-PLA2 and BDNF levels in two groups(±s)

表1 2组血清IMA、Lp-PLA2、BDNF水平比较(±s)Table 1 Comparison of serum IMA,Lp-PLA2 and BDNF levels in two groups(±s)
组别脑血管疾病组对照组t值P值n 82 80 IMA(μg/mL)50.32±10.33 80.37±15.25 14.716<0.001 Lp-PLA2(mg/L)212.30±35.33 138.52±20.58 16.189<0.001 BDNF(μg/L)10.02±2.28 13.58±3.20 8.137<0.001

表2 2组相关因素比较Table 2 Comparison of related factors between two groups

表3 Logistic回归分析赋值Table 3 Assignment of Logistic regression analysis

表4 Logistic回归分析运动障碍的独立危险因素Table 4 Independent influencing factors of exercise disorder by Logistic regression analysis
2.4 CSVD 患者运动障碍与血清IMA、Lp-PLA2、BDNF水平的相关性分析 CSVD运动障碍患者的FM评分为(90.23±2.31)分。Pearson 相关性分析显示CSVD 患运动障碍患者的FM 评分与血清IMA、Lp-PLA2水平呈负相关(r= 0.756、0.670,P<0.05),与血清BDNF水平呈正相关(r=0.602,P<0.05)。见表5。
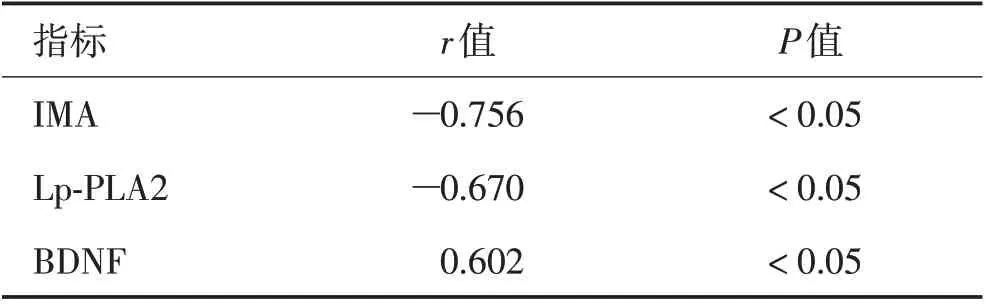
表5 CSVD患者运动障碍与血清IMA、Lp-PLA2、BDNF水平的相关性分析Table 5 Correlation analysis of dyskinesia and serum IMA,Lp-PLA2,BDNF levels in CSVD patients
3 讨论
随着中国人口老龄化的加剧及生活方式的改变,脑血管疾病的危险因素增多,CVSD 的发病率逐渐上升[12-13]。CVSD 进展缓慢,临床症状无特异性,多数患者因病情进展到一定阶段急性发作而就诊,急性发作以腔隙性脑梗死和脑实质出血最为常见,可使患者出现肌张力障碍、行走困难、震颤等运动障碍表现,对生活质量造成极大影响[14-15]。因CVSD的病变较轻,可自行缓解,但仍有部分患者预后较差,且自行缓解患者在早期仍会对工作、生活及家人造成负担[16]。因此,了解CVSD患者运动障碍的影响因素,及时做好预防准备对减轻患者负担有重要意义。
本研究显示脑血管疾病组血清IMA、Lp-PLA2水平均高于对照组,BDNF水平低于对照组,说明CVSD患者存在血清IMA、Lp-PLA2、BDNF水平异常。IMA最早以心肌缺血标志物受到灌注,机体发生缺血/再灌注时生成大量的氧自由基破坏血清白蛋白的氨基酸序列,血清白蛋白与过渡金属结合能力改变,更易被生物化学因素降解而破坏,这种因缺血缺氧而被降解修饰的血清白蛋白即IMA[17-19]。CVSD患者中因脑血管病变可造成脑组织能量代谢障碍,导致自由基过度生成,可引起IMA水平升高[20]。MENON等[21]研究发现脑卒中患者血清IMA 明显高于对照组,可作为早期缺血性卒中筛查的一个敏感和快速的生物标志物。Lp-PLA2是由血管内膜细胞中巨噬细胞、T细胞和肥大细胞分泌的促进氧化磷脂水解的磷脂酶,能氧化水解低密度脂蛋白(ox-LDL)中的氧化磷脂,生成脂类促炎物质,导致血管内皮细胞死亡及功能异常,参与心血管病变[22-23]。研究[24]证实Lp-PLA2是氧化应激和炎症反应的生物标志物,其水平的升高可增加心血管疾病发生风险。BDNF是具有神经营养作用的蛋白质,在神经系统中广泛表达[25]。研究[26]发现脑血管疾病患者因存在脑部能量供应障碍,发生炎症反应、氧化应激等一系列病理改变,神经功能受损,BDNF 被过度消耗,血清水平下降。上述研究证实IMA、Lp-PLA2、BDNF参与CVSD的发生。
本研究中运动障碍组中颈动脉粥样硬化占比及血清IMA、Lp-PLA2、Hcy 水平高于对非运动障碍组,血清BDNF 水平低于非运动障碍组;Logistic 回归分析显示颈动脉粥样硬化、血清IMA、Lp-PLA2、Hcy、BDNF 水平均是CVSD 患者发生运动障碍的独立影响因素,说明血清IMA、Lp-PLA2、BDNF 水平的异常可增加CVSD 患者运动障碍风险。IMA 的产生与缺血缺氧造成的能量代谢障碍有关,其水平越高提示缺血缺氧造成的能量代谢障碍越严重,对神经细胞、脑皮质及锥体束等影响机体运动功能的组织损伤越严重,因此是导致CVSD 患者运动障碍的危险因素[27-28]。Lp-PLA2 造成的血管内皮功能损伤可刺激黏附因子和细胞因子的生成,通过趋化炎症细胞进一步产生自我强化的循环,加重促炎因子的分泌,形成恶性循环[29-31]。因此Lp-PLA2可加重CVSD损伤,增加运动障碍风险。脑损伤发生后BDNF是促进神经元存活和分化的关键,其水平下降能导致神经细胞的凋亡,引起神经功能障碍,增加运动障碍风险。研究认为BDNF修饰的神经干细胞移植可影响脊髓损伤大鼠的轴突再生与后肢运动功能,说明BDNF水平异常参与运动障碍的发生[32-40]。此外,本研究中Pearson相关性分析证实CVSD发生运动障碍患者的FM评分与血清IMA、Lp-PLA2呈负相关,与BDNF水平呈正相关,与上述研究观点一致,证实血清IMA、Lp-PLA2、BDNF水平参与CVSD患者运动障碍的发生。
CVSD 患者存在血清IMA、Lp-PLA2、BDNF 水平异常,且血清IMA、Lp-PLA2、BDNF 水平是其运动障碍的影响因素,而FM评分与血清IMA、Lp-PLA2水平呈负相关,与血清BDNF水平呈正相关。因此可考虑将IMA、Lp-PLA2、BDNF 作为CVSD 的诊断及预后预测标志物。

