复方青香胶囊微生物限度检查方法的建立和验证
郝媛,姚敏娜,王昱锦
空军军医大学西京医院,陕西 西安 710032
复方青香胶囊为西京医院自制制剂,处方由枳壳、川芎、石菖蒲、甘草等11 味中药组成,具有调经止痛、消积化滞作用,用于治疗乳腺增生、乳腺肿痛及乳腺腺瘤等症。中药复方制剂,主要成分复杂多样、成分间易于产生相互作用等特性,使研究者很难直接从药名或处方组成判断制剂是否有抑菌作用[1],而微生物限度检查的核心关键点就是去除药品的抑菌性干扰[2]。考虑中药复方制剂上述特点,按照 2015 版《中国药典》四部要求,建立并验证了复方青香胶囊的微生物限度检查方法。
1 仪器材料与试药
1.1 仪器
SPX-150 生化培养箱(上海扬州慧科电子有限公司);BMJ-250C 霉菌培养箱(上海迅博实业有限公司);LRH-250A 生化培养箱(韶关市宏泰医疗器械有限公司);BHC1300IIA2 生物安全柜(苏州安泰空气技术有限公司);BSP-250 生化培养箱(上海迅博实业有限公司)。
1.2 试剂、试药及培养基
复方青香胶囊(第四军医大学西京医院,批号:160706、160803、160830;规格:0.38 g)。胰酪大豆胨液体培养基,批号:160316;肠道菌增菌液体培养基,批号:160114;胰酪大豆胨琼脂培养基,批号:160106;麦康凯琼脂培养基,批号:160405;沙氏葡萄糖液体培养基,批号:160316;木糖赖氨酸脱氧胆酸盐琼脂培养基,批号:160215;沙氏葡萄糖琼脂培养基,批号:160129;紫红胆盐葡萄糖琼脂培养基,批号:160314;RV 沙门菌增菌液体培养基,批号:160318;三糖 铁琼脂培养基,批号:160106;麦康凯液体培养基,批号:160229。上述培养基均源自北京陆桥技术有限责任公司。氯化钠,天津科密欧化学试剂有限公司。
1.3 工作菌株
金黄色葡萄球菌[CMCC(B)26003];白色念珠菌[CMCC(F)98001];铜绿假单胞菌[CMCC(B)10104];大肠埃希菌[CMCC(B)44102];枯草芽孢杆菌[CMCC(B)63501];黑曲霉[CMCC(F)98003];乙型副伤寒沙门菌[CMCC(B)50094]。上述标准菌株为第3 代,皆由中国食品药品检定研究院提供。
2 方法与结果
2.1 需氧菌总数、霉菌和酵母菌总数测定方法的建立及验证
2.1.1 菌悬液的制备按照2015 版《中国药典》四部通则1105 项下规定的菌液制备方法,以0.9%无菌氯化钠溶液为稀释液,制备100~10 000 cfu/mL 的金黄色葡萄球菌菌悬液、白色念珠菌菌悬液、铜绿假单胞菌菌悬液、黑曲霉孢子悬液和枯草芽孢杆菌菌悬液[3]。
2.1.2 供试液的制备取复方青香胶囊10 g,加入到胰酪大豆胨液体培养基中,至100 mL,45 ℃水浴并加以震荡,制成1∶10 的供试液。后以胰酪大豆胨液体培养基为稀释液,制备1∶20、1∶50、1∶100稀释级别的供试液,备用。
2.1.3 平皿法回收率试验组:分别加入0.1 mL“2.1.1”项下菌悬液至 9.9 mL“2.1.2”项下供试液及各稀释级别供试液,充分摇匀,使1 mL 供试品溶液中含菌数≤100 cfu,注皿,1 mL/皿(直径90 mm);每一种稀释级别供试液的试验组平行制备2 皿,按照表1 和表2 的要求进行。
菌液对照组:分别加入0.1 mL“2.1.1”项下菌悬液至9.9 mL 胰酪大豆胨液体培养基,充分摇匀,注皿,1 mL/皿(直径90 mm);菌液对照组平行制备2 皿,按照表1 和表2 的要求进行。
供试品对照组:分别加入0.1 mL 稀释液至9.9 mL“2.1.2”项下供试液及各稀释级别供试液,充分摇匀,注皿,1 mL/皿(直径90 mm);每一种稀释级别供试液的供试品对照组平行制备2 皿,按照表1 和表2 的要求进行。
上述注皿完成后,采用胰酪大豆胨琼脂培养基浇注需氧菌总数平皿,摇匀,置于生化培养箱中,35 ℃培养3 d。采用沙氏葡萄糖琼脂培养基浇注霉菌和酵母菌总数平皿,摇匀,置于生化培养箱中,25 ℃培养5 d。按照2015 版《中国药典》要求进行计数。

当0.5 ≤R ≤2,该方法可行[4-5]。
2.1.4 计数方法适用性试验研究需氧菌总数以金黄色葡萄球菌进行计数加菌预试验;霉菌和酵母菌总数以白色念珠菌进行计数加菌预试验,结果见表1~2。
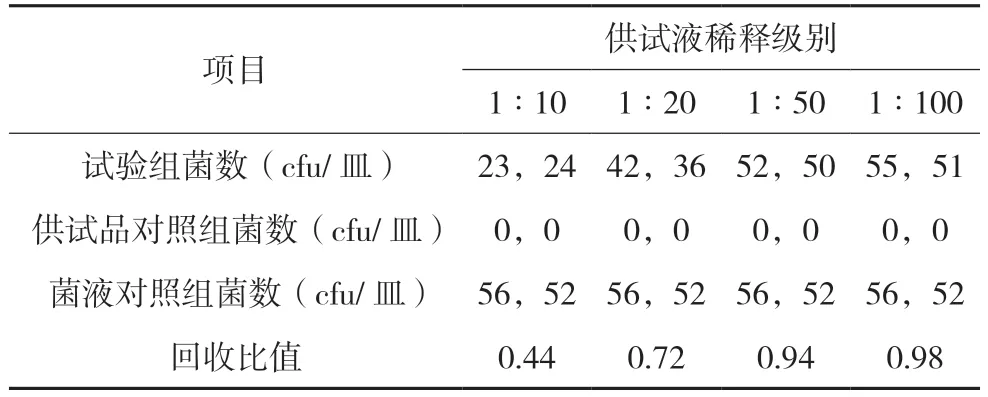
表1 需氧菌总数预试验结果(金黄色葡萄球菌)
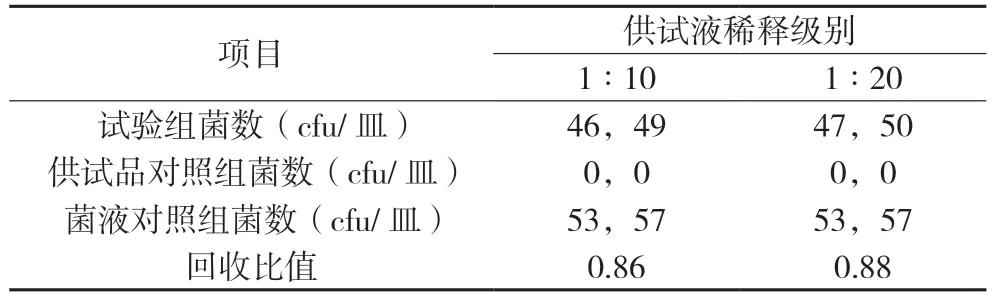
表2 霉菌和酵母菌总数预试验结果(白色念珠菌)
表1 结果表明:常规法复方青香胶囊抑制金黄色葡萄球菌生长,供试液浓度为1∶20 时,可使回收比值R 符合0.5 ≤R ≤2,消除其抑菌性;预计该稀释方法可以消除本品对需氧菌的抑制作用。
表2 结果表明:1∶10 供试液组回收比值R 为0.86,符合0.5 ≤R ≤2,预计采用常规方法可进行本品霉菌和酵母菌总数测定。
2.1.5 需氧菌总数、霉菌和酵母菌总数计数方法的验证取复方青香胶囊,以1∶20 供试液进行需氧菌总数5 种菌加菌回收试验;用常规法进行霉菌及酵母菌总数2 种菌加菌回收试验,进行3 次独立试验,结果见表3。
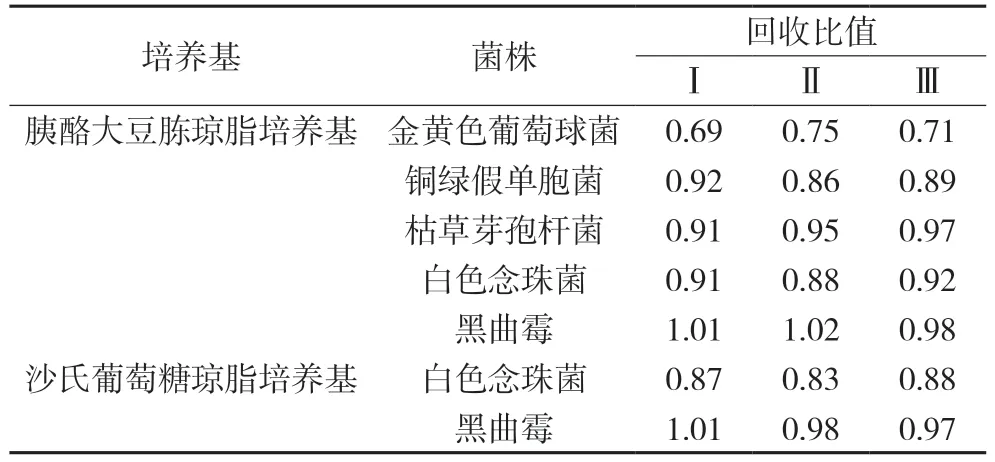
表3 复方青香胶囊回收比值试验结果
三次独立加菌回收试验结果表明:(1)复方青香胶囊需氧菌总数测定采用供试品溶液稀释法(1∶20),规定的五种试验菌回收比值R 符合0.5 ≤R ≤2,可用此法。(2)复方青香胶囊霉菌及酵母菌总数的测定采用常规法,规定的两种试验菌回收比值R 符合0.5 ≤R ≤2,可用此法。
2.2 控制菌检查方法的建立及验证
2.2.1 检查依据制备工艺中“枳壳、川芎烘干,粉碎过100 目筛”“细粉和余下药材水提浓缩后清膏混匀、粉碎、分装”可知,复方青香胶囊为非无菌含药材原粉的中药制剂,按2015 年版《中国药典》四部微生物限度要求,控制菌应查大肠埃希菌、耐胆盐革兰阴性菌及沙门菌[6]。
2.2.2 菌液制备按2015 年版《中国药典》四部通则1106 项下规定的菌液制备方法,以0.9%无菌氯化钠溶液为稀释液,制备不大于100 cfu/mL 的大肠埃希菌菌悬液、铜绿假单胞菌菌悬液和乙型副伤寒沙门菌菌悬液[3]。
2.2.3 大肠埃希菌检查法试验组取2.1.2 项下1∶10供试液10 mL 加入至胰酪大豆胨液体培养基100 mL中,并加入≤100 cfu(菌液体积<1 mL)的大肠埃希菌,混匀;供试液组:取2.1.2 项下1∶10 供试液10 mL 加入至胰酪大豆胨液体培养基100 mL 中;阴性对照组:取稀释液10 mL,加入至胰酪大豆胨液体培养基100 mL 中。按照药典要求,完成大肠埃希菌的选择和分离培养、结果判断。进行2 次独立试验,结果见表4。试验结果表明:可用常规法进行本品大肠埃希菌检查。
2.2.4 耐胆盐革兰阴性菌检查法供试液预培养:取2.1.2 项下1∶10 供试液23 ℃培养2 h。试验组:取上述预培养液10 mL,加入至100 mL 肠道菌增菌液体培养基中,平行制备2 份,一份加入≤100 cfu 的大肠埃希菌液(菌液体积<1 mL),混匀,另一份加入≤100 cfu 的铜绿假单胞菌(菌液体积<1 mL),混匀;供试液组:取上述预培养液10 mL,加入至100 mL 肠道菌增菌液体培养基中,混匀;阴性对照组:取稀释液10 mL 加入至100 mL 肠道菌增菌液体培养基中,混匀。按照药典要求,完成耐胆盐革兰阴性菌的定性试验、结果判断。进行2 次独立试验,结果见表4。试验结果表明:可用常规法进行本品耐胆盐革兰阴性菌检查。
2.2.5 沙门菌检查法试验组:供试品10 g 加入胰酪大豆胨液体培养基中,至100 mL,45℃水浴振荡15 min,同时加入≤100 cfu 的沙门菌(菌液体积<1 mL),混匀;供试液组:供试品10 g 加入胰酪大豆胨液体培养基中,至100 mL,45 ℃水浴振荡15 min;阴性对照组:加胰酪大豆胨液体培养基100 mL;按照药典要求,完成沙门菌的选择和分离培养、结果判断。进行2 次独立试验,结果见表4。试验结果表明:可用常规法进行本品沙门菌检查。
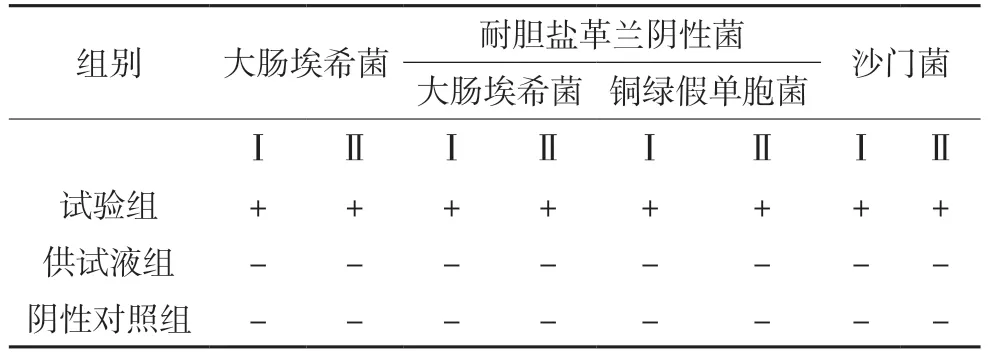
表4 控制菌检查方法适用性试验结果
结果表明:可采用常规法进行复方青香胶囊控制菌检查。
3 讨论
中药复方制剂,主要成分复杂多样、成分间易于产生相互作用等特性,很难直接从药名或处方组成判断制剂是否有抑菌作用,必须通过试验逐步验证微生物限度检查方法的适用性[1]。查阅文献,梁卉等[7]证实枳壳和麸炒枳壳挥发油对金黄色葡萄球菌有较强抑菌活性,对大肠杆菌和表皮葡萄菌有中等抑菌活性,对白色念珠菌有较弱抑菌活性。何晓利[8]发现四种川芎提取液都有抑菌效果。现代药理研究表明石菖蒲具有抑菌抗炎作用[9]。文献资料提示复方青香胶囊可能有抑菌活性,为去除可能存在的抑菌性干扰。2015 药典提示可采用下述方法消除供试品的抑菌性:(1)增加稀释液或培养基体积;(2)加入中和剂或灭菌剂;(3)薄膜过滤法;(4)上述方法联用[3]。实际操作中,中和法的特点在于,虽药典中提供了常见中和剂用于消除干扰物的抑菌活性,但中药复方制剂处方工艺较为复杂,干扰成分较易产生且不易从药名或处方组成直接推出干扰物及干扰物分类,使得中和剂的选择不像单一化药成分的中和剂选择那样简单。薄膜过滤法特点在于,虽其对抑菌作用的消除效果最好且计数更加准确,但大多数中成药固体制剂,处方中不溶性成分较多,操作中容易出现药渣堵膜现象[1]。苏润萍[10]也提供了消除抑菌性干扰的方法优先排序:常规法—稀释法—中和法—薄膜过滤法—几种方法联合使用。实际操作中,应通过循序渐进的方法逐步去验证检查方法的适用性。
查阅文献了解试药各主要成分的抑菌作用,发现金黄色葡萄球菌为需氧菌中相对敏感菌株,白色念珠菌为霉菌和酵母菌中相对敏感菌株,方法适用性试验中,分别以金黄色葡萄球和白色念珠菌进行需氧菌总数和霉菌、酵母菌总数计数加菌预试验,初步确定供试液稀释级别,再进行7 种菌加菌回收试验,简化了操作步骤,减少工作量,优化了检查方法[11]。
复方青香胶囊中枳壳、川芎等药材为中药原粉入药,药典规定控制菌需检查耐胆盐革兰阴性菌。此时,选择胰酪大豆胨液体培养基为稀释液,菌落计数及控制菌检查可共用1 份供试品溶液,提高实验效率[12]。
加菌方式方面,在样品环节加菌,吸取9.9 mL适宜稀释度的供试液,加入0.1 mL 菌悬液,混匀,再注皿。优于在培养基环节加菌[13-14]。
在对试验数据进行分析时,发现表1、表2 中,供试液不同稀释级别下,供试品对照组测定值相同,但并不能因此简化只做一次培养计数。实验过程中,同一试验菌供试液不同稀释级别下,需要分设供试品对照组,进行培养及菌落计数。原因如下:高浓度时,当供试品本身有抑菌性且被微生物污染时,本身的抑菌性可能控制了污染微生物的生长,使供试品对照组菌落计数值为某低值,低浓度时,供试品内污染微生物的生存环境产生巨大变化,可能引起自身复苏繁殖,使此浓度下供试品对照组菌落计数值发生改变为某高值。最终供试液不同稀释级别下,供试品对照组测定值不同,需要分别进行培养及菌落计数。而菌液对照组不存在这种干扰,供试液不同稀释级别下,菌液组只需进行一次培养、菌落计数(平行制备2 皿取均值)。
文章定稿时,2020 版《中国药典》出版不久,笔者做了详细比对,本文所建立的该试药的微生物限度检查方法完全符合2020 版要求[15]。2020 年12 月新版药典实施,可用此法进行复方青香胶囊的微生物限度检查。

