基于7-异戊二烯色氨酸合成酶催化合成C-7异戊烯化的吲哚二酮哌嗪生物碱
刘 瑞,张弘弛,李 慧,周 凤
(山西大同大学 生命科学学院,山西大同 037009;山西大同大学 应用生物技术研究所,山西大同 037009)
异戊烯化的吲哚天然产物是存在于多种生物体(包括植物、真菌和海洋生物)中的一大类天然产物,真菌是这类天然产物的最大生产者[1-2]。目前的研究已经证实,异戊二烯基团可以通过与膜相关蛋白质的相互作用,改善生物膜的亲和力[2],进而提高异戊烯化的吲哚天然产物的生物活性。其中,这类天然产物中由异戊二烯基二磷酸的异戊二烯部分和色氨酸的吲哚环组成的异戊烯基吲哚二酮哌嗪生物碱[3],其生物活性最特别,发现具有多种生物学和药理活性,如抗真菌、抗细菌、抗病毒、抗寄生虫、抗炎、抗肿瘤、化学预防、雌激素和抗雌激素活性等[4-5]。
在真菌细胞内,异戊烯基吲哚二酮哌嗪生物碱是经异戊二烯色氨酸合成酶催化而代谢合成。异戊二烯色氨酸合成酶(Dimethylallyl tryptophan synthase,DMATS)仅接受必需的二甲基烯丙基二磷酸酯(Dimethylallyl diphosphate,DMAPP)作为异戊烯基团的供体,对芳香族底物表现出广泛的底物特异性,例如简单的色氨酸衍生物或含色氨酸的环状二肽,进而选择性催化吲哚环不同位置的区域异戊烯化,可以产生具有不同生物学活性且结构多样化的异戊烯基化吲哚二酮哌嗪生物碱,例如,FtmPT1催化了所有测试的含色氨酸的环状二肽的C2-异戊烯化作用[6],而AnaPT则将这些化合物在吲哚环的C3位置异戊烯化作用[7]。
因此,本研究以多种含色氨酸的环二肽为酶反应底物,催化合成C-7异戊烯化的吲哚二酮哌嗪生物碱,考察7-异戊二烯色氨酸合成酶(7-dimethylallyl tryptophan synthase,7-DMATS)对不同底物的转化率影响,并通过分析环二肽底物与7-DMATS的分子对接关系,进一步分析C-7异戊烯化的吲哚二酮哌嗪生物碱的酶催化底物特异性机理。测定合成的C-7异戊烯化的吲哚二酮哌嗪生物碱的细胞毒性,验证异戊烯化的吲哚二酮哌嗪生物碱可以大大提高其生物活性,并对活性最高的化合物(7b)进行7-DMATS催化反应条件的优化研究,为进一步深入研究异戊烯化的吲哚二酮哌嗪生物碱的生物合成奠定基础。
1 材料与方法
1.1 材 料
试剂及生化材料:各种氨基酸(国药集团),Ni-NTA琼脂糖树脂(德国Qiagen公司),HPLC用色谱纯试剂(上海星可生化有限公司);大肠杆菌XL1-Blue MRF’,pGEM-T和pQE60 (德国Qiagen公司);烟曲霉AspergillusfumigatusB5233(ATCC 13073)的UniZAP XR预制文库(美国Stratagene公司)。
仪器:ESI-MS质谱仪JEOL SX102A(日本电子株式会社),核磁共振仪Bruker ADVANCE 500 MHz(德国布鲁克公司),高效液相色谱Agilent 1200型(美国惠普公司),自动旋光仪WZZ-3型(上海仪电物理光学仪器有限公司)。
癌细胞株:人源性宫颈癌细胞(Human cervical carcinoma cells,HeLa)由第四军医大学提供;人源性肺癌细胞(Human lung cancer cells,A549)和人源性乳腺癌细胞(Human breast cancer cells,MCF-7)购自中科院上海生命科学研究院细胞资源中心。
1.2 方 法
1.2.1 DMAPP和吲哚二酮哌嗪的合成 按照文献[8]的方法,合成供体DMAPP,经HPLC测定,产物纯度为96%;按照文献[9-10]的方法合成二酮哌嗪底物(环二肽),经HPLC测定,环二肽纯度为81%~92%。
1.2.2 DNA的分离、PCR扩增和载体克隆 依据文献[11]的方法,AspergillusfumigatusB5233的UniZAP XR预制文库导入受体细胞后,进行7-DMATS的DNA分离,PCR扩增,片段长度为1 425 bp,包含Afu3g12930的整个编码序列,引物为7-dmats-1(5′-CACCATGGCCATCGGAGCCGAGAT-3′),和7-dmats-2(5′-TGCAGATCTGCTGTACACCCGGAG-3′)。其中粗体字母表示插入的突变,带下划线字母表示限制性位点,NcoI位于7-dmats-1的起始密码子,BglII位于7-dmats-2的预期终止密码子。然后将PCR片段克隆到pGEM-T中,得到质粒pLW39,其序列通过遗传分析仪经过测序得到验证。创建表达载体pLW40,用限制酶NcoI和BglII消化pLW39之后,将得到的1 418 bp的NcoI-BglII片段直接连接到pQE60中,pQE60提前已用NcoI和BglII消化过。获得含有7-DMATS基因的质粒pLW40,用于蛋白质表达和纯化。
1.2.3 蛋白质的表达、纯化和鉴定 将pLW40转化至大肠杆菌XL1 Blue MRF’中,重组子形成后,接种于含液态Luria-Bertani(LB)培养基的锥形瓶中,补充羧苄青霉素(终浓度50 μg·mL-1),37 ℃下生长至OD600达0.6。加异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为0.8 mmol·L-1,37 ℃将细胞再培养16 h。离心收集菌体,沉淀以2~5 g·mL-1(g湿重)的浓度重悬浮于裂解缓冲液(10 mmol·L-1咪唑,50 mmol·L-1NaH2PO4和300 mmol·L-1NaCl,pH 8.0)中,加溶菌酶(终浓度1 mg·mL-1),冰上孵育30 min,以200 W的频率超声处理6次,每次10 s,裂解液在4 ℃以14 000 g离心30 min。用Ni-NTA琼脂糖树脂(Qiagen)进行亲和层析,纯化重组融合蛋白,用洗脱液(50 mmol·L-1NaH2PO4,300 mmol·L-1NaCl,250 mmol·L-1咪唑,pH 8.0)洗脱收集,经NAP-5柱(50 mmol·L-1Tris-HCl,15%甘油,pH 7.5,平衡)交换缓冲液,SDS-PAGE 鉴定收集得目的蛋白。
1.2.4 酶催化合成反应、产物分析、分离和结构鉴定 酶催化合成反应总体积10 mL,包含50 mol·L-1Tris-HCl,5 mmol·L-1CaCl2、1 mmol·L-1DMAPP,1 mmol·L-1底物和50 μg(0.9 mmol·L-1)7-DMATS,pH 7.5,温度 37 ℃,反应16 h,加10 μL三氯乙酸(1.5 mmol·L-1)终止反应,离心(15 000 g,10 min,4 ℃)除去蛋白质。通过HPLC(Agilent 1200,RP18-column,10 mm×250 mm,5 μm,1.0 mL·min-1)分析酶促产物,含0.1%三氟乙酸(溶剂A)和甲醇(溶剂B)作为溶剂,从50%到100%的溶剂B进行梯度洗脱10 min,100%溶剂B洗涤10 min后,50%溶剂B平衡色谱柱10 min,紫外检测器设置波长277 nm。分离酶产物,使用酶产物分析相同的HPLC条件,流速为2.5 mL·min-1,检测到的产物的峰面积与产物和底物的总和之比来计算酶反应的转化率。收集后真空除去溶剂,冻干除水,得产物。核磁共振法(1H-NMR,500 MHz)鉴定其结构,电喷雾离子化质谱(ESI-MS)鉴定其分子量。
1.2.5 分子对接 使用结构相似的蛋白FgaPT2(PDB ID:3I4X)作为同源模板,建立 7-DMATS的同源性模型。为了考虑底物结合袋中的氢键网络,在模型构建过程中还包括了底物分子。采用Ledock软件完成对接,对接成功后,按照对接能量排序,选取最优构象,采用Pymol 1.5分析对接结果,并绘制分子对接图。
1.2.6 细胞毒性测定 MTT法[12]测定异戊烯化的吲哚二酮哌嗪生物碱对3种癌细胞生长的抑制作用。将待测物溶于5%的DMSO,配成浓度为2 mg·mL-1的母液,用培养基将其稀释成6个不同的浓度。将4.0×103mL-1的细胞悬液接种于96孔细胞培养板,每孔150 μL,设3个平行。24 h后,弃掉原培养液,将不同浓度含待测物的培养液加入培养板内,每孔150 μL,同时设空白对照。48 h后,弃掉原来的培养基,并向每孔加入20 μL MTT溶液和150 μL新鲜培养基,培养4 h检测。波长490 nm下测定吸光值(A),计算抑制率,公式如下,运用SPSS 19计算半数抑制浓度(IC50)。
IC50=[(Acontrol-Atest)/Acontrol]× 100% 其中:Acontrol为对照组的吸光度,Atest为样品组的吸光度。
1.2.7 酶催化条件优化 为了研究活性最高的产物cyclo-L-7-dimethylallyl-Trp-L-Pro(7b)的7-DMATS的酶催化合成最佳反应条件,分别考察反应时间、pH、温度、二价离子。优化反应时间为8~24 h;优化pH,设置各种反应缓冲液中进行酶促反应,反应缓冲液pH为4.0~6.0(柠檬酸-柠檬酸钠缓冲液)、6.0~8.0(Na2HPO4-NaH2PO4缓冲液)、7.0~9.0(Tris-HCl缓冲液)和10.0~11.0(Na2CO3-NaHCO3缓冲液);优化反应温度,在不同温度(5~50 ℃)下进行酶促反应;测试二价离子对酶活性的影响,分别添加最终浓度为5 mmol·L-1的不同阳离子Mg2+、Ca2+、Mn2+、Fe2+、Ba2+、Zn2+、Cu2+。所有酶促反应均以DMAPP为供体,cyclo-L-Trp-L-Pro(7a)为底物进行,试验重复3次,并对酶混合物进行HPLC分析。
2 结果与分析
2.1 7-DMATS蛋白的表达和纯化
37 ℃下,0.8 mmol·L-1IPTG诱导携带pLW40的大肠杆菌细胞。通过SDS-PAGE判断,用Ni-NTA琼脂糖将His6-7-DMATS纯化至表观均匀性(图1),每升培养物获得5 mg纯化的His6-tagged 7-DMATS的蛋白。观察到的分子质量为50 ku,这与His6-7-DMATS的54 ku的计算值非常吻合。
2.2 C-7异戊烯取代的吲哚二酮哌嗪的结构 鉴定
经7-DMATS酶催化,合成了7个C-7异戊烯取代的吲哚二酮哌嗪,以合成产率为指标,经HPLC分析(图2)发现7-DMATS酶对底物有一定的选择性,以cyclo-L-Trp-L-Leu(3a)为底物,转化率最高(30.2%),其次是以cyclo-L-Trp-L-Trp(6a)和cyclo-L-Trp-L-Tyr(5a)和cyclo-L-Trp-L-Pro(7a)为底物,转化率分别为(28.5%、28.1%和25.4%),以cyclo-L-Trp-L-Phe(4a)为底物,转化率最低(11.8%)。ESI-MS数据分析,分离到的所有产物的分子量均比各自底物的分子量大68,与单异戊烯基的分子量吻合,表明其结构中存在单异戊烯基。将产物1b-7b与底物1a-7a的1H-NMR的比较,证明芳香族质子H-7的双峰信号消失,而增加异戊烯基的化学位移信号δH3.41-3.54(1H,d,H-1′),5.24-5.43(1H,t,H-2′),1.58-1.79(3H,s,H-4′)和1.49-1.75(3H,s,H-5′),同时H-1′的化学位移H-1′ (δH3.49-3.54)也证明其与芳香族C原子连接[13]。
与已发表的文献的核磁数据比较,1b和2b的1H-NMR中异戊烯化的吲哚环部分数据与Fan等[14]催化合成的异戊烯化的色氨酸衍生物类似。3b、5b和7b的1H-NMR数据与Wunsch等[15]采用His6-CdpC7PT催化合成的异戊烯化的吲哚二酮哌嗪数据一致。4b和6b的1H-NMR数据与Zou等[16]采用His6-CTrpPT催化合成的异戊烯化的吲哚二酮哌嗪结果基本吻合。这些数据也验证本研究酶催化产物结构的正确性,合成的化合物经ESI-MS和1H-NMR表征分析,详细数据如下。




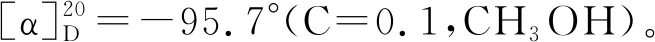

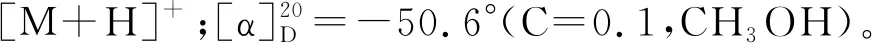
2.3 分子对接结果分析
图3为1a-7a进行的多组构象中能量最低的构象与受体蛋白(7-DMATS)的对接3D图,7种目标化合物均很好地结合到蛋白受体中,色氨酸的吲哚环的H原子是共同的活性位点,分别与蛋白受体的GLU89、LEU81等氨基酸残基形成氢键,使受体蛋白与目标底物结合更加牢固,其他氢键如表2所示,这也是7-DMATS可以催化底物异戊烯化的原因所在。
分子力学泊松-波尔兹曼表面积(Molecular mechanics Poisson-Boltzmann surface area,MM-PBSA)法是一种常用于受体与配体分子对接后计算结合自由能值(binding free energy,ΔGbind)的方法[17],通过4个组分计算结合自由能:范德华力贡献(ΔGvdw),静电贡献(ΔGele),去溶剂化极性部分(ΔGpolar)和非极性贡献(ΔGnonpolar),ΔGbind值越低说明受体与配体之间的亲和力越高[18]。吲哚二酮哌嗪1a-7a和 7-DMATS进行分子对接和优化后,结合情况见图3,对接复合物的计算结合自由能见表1,通过pymol统计1a-7a和7-DMATS相互作用的疏水氨基酸残基见表1。

表1 配体与7-DMATS靶点残基作用情况Table 1 Relations between ligands and residues of 7-DMATS
遵循对接能量ΔGbind低,结合键的数量和类型的原则,可以得出7-DMATS对目标底物的催化效果为3a>6a>5a>7a>1a>2a>4a,而合成试验中1b-7b的产率排序为3b(30.2%)>6b(28.5%)>5b(28.1%)>7b(25.4%)>1b (23.6%)>2b(20.2%)>4b(11.8%)。试验数据和分子对接模型分析的吻合性,也证实这一对接模型的准确性,为进一步7-DMATS的酶催化反应提供一定的预测模型。此外,从结构来看,组成底物二酮哌嗪的除色氨酸的另一个氨基酸取代基为异丙基(3a),其分子对接效果最佳,这可能由于其空间位阻小,易于进攻受体蛋白的原因,取代基为苯基(4a)时,分子对接效果最差,这与分子间存在较大的空间位阻有关。
2.4 抗肿瘤活性分析
抗肿瘤活性结果表明(表2),吲哚环上的异戊二烯基明显导致细胞毒性的增加,非异戊烯化的吲哚二酮哌嗪对3种癌细胞(人源性宫颈癌细胞HeLa,人源性肺癌细胞A549,人源性乳腺癌细胞 MCF-7)的IC50值>100 μmol·L-1(试验设置的最高浓度),而所有测试的异戊烯化的酶产物对3种细胞系的毒性都比原底物高。对 MCF-7的IC50值在中低微摩尔范围内,而对HeLa和A549细胞的IC50则在较高微摩尔范围内,特别是化合物cyclo-L-7-dimethylallyl-Trp-L-Pro(7b)对给定的细胞系均显示出最高的细胞活性,表明7b中的脯氨酸部分组成的吡咯环有助于提高肿瘤细胞的抑制活性。
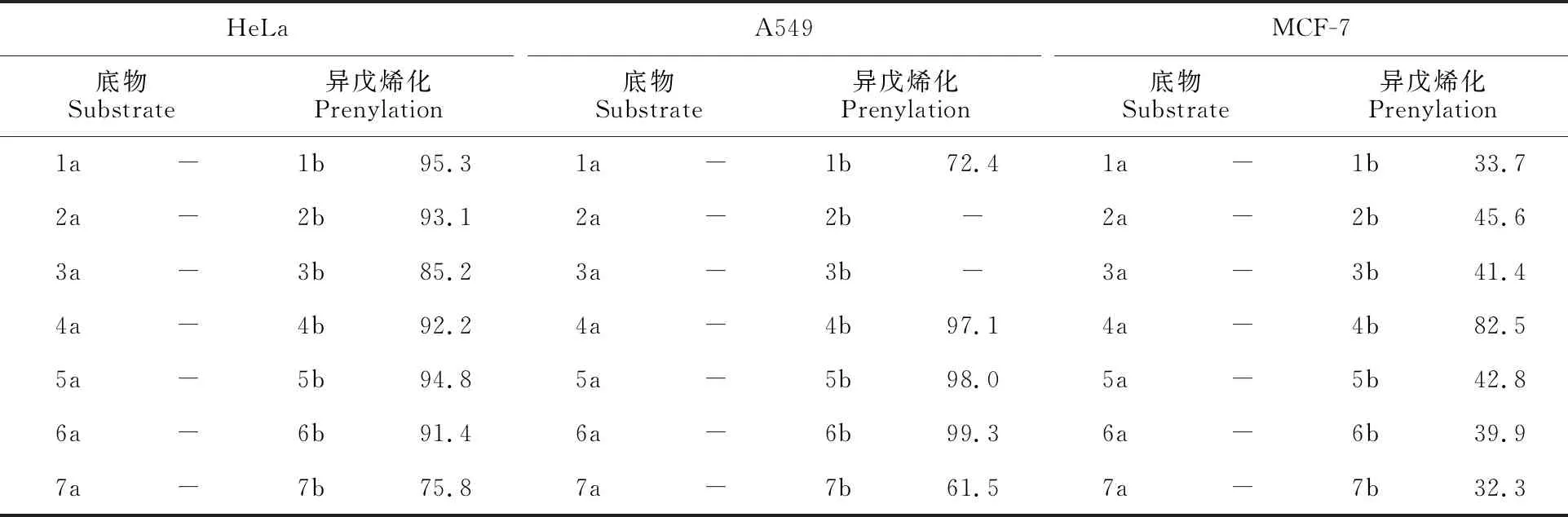
表2 吲哚二酮哌嗪(1a-7a)以及异戊烯化吲哚二酮哌嗪(1b-7b)的抗癌细胞增殖活性IC50值Table 2 IC50 values of non-prenylated and prenylated tryptophan-containing cyclic dipeptides against HeLa,A549,and MCF-7 cell lines μmol·L-1
2.5 最优酶催化条件分析
对活性最高的产物cyclo-L-7-dimethylallyl-Trp-L-Pro(7b)的7-DMATS的酶催化合成最佳反应条件进行优化(图4),为了更准确反应出影响酶反应的因素,首先确定酶促反应最佳时间为16~18 h,积累反应时间达到18 h以上,时间积累量对转化率影响不大,确定后续反应时间采用18 h。酶反应的影响因素试验结果反应出 7-DMATS的酶活性受温度和pH的强烈影响,最佳反应温度为35 ℃左右,在高于40 ℃时,活性迅速下降,最佳pH控制在8.0左右(Tris-HCl缓冲液)。而7-DMATS活性对二价金属离子呈现出强依赖性,测试的不同的二价阳离子对于终产物的转化率偏差很大,影响顺序为Mg2+>Ca2+>Mn2+>Fe2+>Ba2+>Zn2+,而在Cu2+存在条件下未检测到产物,这一结果与已报道的异戊烯化的黄酮的反应类似[19]。
3 结 论
本研究以L-色氨酸系的7个二酮哌嗪为底物(1a-7a),经7-DMATS催化合成7个异戊烯化的吲哚二酮哌嗪(1b-7b),通过合成率和HPLC分析,可以发现7-DMATS对底物有一定的选择性,利用分子对接分析7-DMATS对底物选择性催化的原因,也验证酶催化效率的差异性;采用MTT法测定1b-7b对3种肿瘤细胞(HeLa、A549、MCF-7)的抑制活性,7个异戊烯基化的吲哚二酮哌嗪表现出一定的抑制肿瘤细胞的活性,其中确定7b的活性最高,单因素法得出其最佳酶催化条件为:反应时间18 h,温度为35 ℃,pH为8.0(Tris-HCl缓冲液),添加5 mmol·L-1的MgCl2。这些结果为后续酶催化合成更多位点的异戊烯基化的吲哚二酮哌嗪提供基础数据。
近年来,利用芳香族异戊烯基转移酶的酶催化合成法获得一系列异戊烯基化的吲哚类生物碱,此途径可作为化合物修饰的新策略。但是,酶催化合成法对于底物的特异性以及酶促反应条件都有着严格的要求。目前,很多学者普遍采用增加酶量,延长反应时间,达到有效合成化合物的目的,笔者的研究证实,这些条件都有着一定的局限性。提升产率的更精确方案,应该建立多因素试验统计模型[20]去进一步探索,这也是笔者进一步研究的方向。

