UCP3 基因调控C2C12 细胞增殖的研究
何志强,黑伟,张万锋,张燕伟,吴怡琦,蔡春波,杨阳,高鹏飞,李步高,郭晓红
(山西农业大学 动物科学学院,山西 太谷030801)
骨骼肌是哺乳动物机体的重要组成部分,与哺乳动物的运动能力、代谢能力具有密切的联系[1]。骨骼肌细胞生长发育是一个复杂的生理过程,主要包括骨骼肌干细胞增殖、迁移和分化,成肌细胞的增殖、分化和肌管融合等环节[2]。其中,骨骼肌成肌细胞的增殖是维持骨骼肌功能的基础。当骨骼肌受到损伤时,机体可以通过成肌细胞的增殖和分化进行损伤修复,维持骨骼肌的功能。骨骼肌急性损伤后,可以激活骨骼肌中的MAPK/MEK 信号通路,诱导骨骼肌卫星细胞的增殖,并促进成肌分化,完成骨骼肌的损伤修复[3]。电刺激可以促进肌萎缩大鼠的骨骼肌中胰岛素样生长因子1(IGF-1)表达,抑制Myostatin基因表达,促进骨骼肌卫星细胞增殖,缓解骨骼肌的萎缩程度[4]。C2C12 细胞是小鼠骨骼肌的成肌细胞系,具有很强的增殖和成肌分化能力,是研究骨骼肌发育的模式细胞系。
解偶联蛋白3(Uncoupling protein 3,UCP3)主要在骨骼肌和棕色脂肪(BAT)中表达,是一种位于线粒体内膜上的载体蛋白[5]。UCP3 可以通过质子漏的方式,消散线粒体内膜两侧的质子电化学梯度差,解偶联线粒体的氧化与磷酸化过程,使能量以热能的方式消耗。目前,关于UCP3 的研究主要集中在脂质氧化代谢与产热调节等方面,寒冷条件刺激下,猪可以通过上调UCP3 基因的表达,促进皮下白色脂肪棕色化,增加脂肪产热,维持体温平衡[6]。UCP3 还可以增强脂质的氧化代谢作用[7~9],减少线粒体中活性氧(reactive oxygen specices,ROS)的产生[10],使线粒体免受氧化应激造成的损伤[11]。Lin 等[12]发现,90 日龄的莆田黑猪骨骼肌中UCP3 的表达量显著高于其它日龄(P<0.01)。目前,关于UCP3 对骨骼肌的调控作用的报道较少,功能仍不清楚。本研究以C2C12细胞为研究对象,在有效转染UCP3 过表达与干扰慢病毒载体的基础上,收集不同处理组细胞的RNA 及蛋白,利用qRT-PCR 技术检测增殖相关基因PCNA、Ki67 与凋亡相关基因Bax、caspase3 mRNA 表达量的变化,运用Western Blot 技术检测PCNA 蛋白表达量的变化;通 过CCK-8、EDU 染色探究过表达与干扰UCP3 基因对C2C12 细胞增殖速率的影响,阐明UCP3 基因对C2C12 成肌细胞增殖的调控作用,为骨骼肌中UCP3 的功能研究提供基础数据。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂
C2C12 细胞购自上海盖宁生物有限公司;胎牛血清(FBS)、高糖DMEM、0.25%胰酶购自Gibco 公司;青链霉素混合液、PBS 缓冲液、4%多聚甲醛、Triton X-100、DAPI 染 液 购 自Solaibio 公 司;SDS-PAGE 快速凝胶制备试剂盒、彩虹预染蛋白marker 购自武汉博士得生物工程有限公司;TRNzol Universal RNA Reagent、总RNA 提 取 试 剂 盒购自北京天根生化科技有限公司;Prime Script RT reagent Kit with gDNA Eraser 和SYBR Premix Ex Taq II 购 自TaKaRa 公 司;CCK-8 试 剂盒、PCNA 单 克隆抗体 购 自Abcam 公 司;β-actin 单克隆抗体购自武汉三鹰生物技术有限公司;荧光二抗购自美国LI-COR 公司;EDU 增殖检测试剂盒购自广州锐博生物技术有限公司;qRT-PCR 引物由上海生工生物工程有限公司合成;慢病毒载体由上海吉玛公司构建并包装。
1.1.2 主要仪器
多功能酶标(BioTekSynergy-2,美国);核酸蛋白测定仪(ND-1 000 Nanodrop,美国);倒置荧光显微镜(DMi8 Leica,德国);CO2细胞培养箱(STE-CYCLE Thermo,美国);实时荧光定量PCR 仪(ABI 7 500,美国);电泳仪和转膜仪(PowePac BIO-RAD,美国);远红外光扫描系统(Odyssey CLX LI-COR,美国)。
1.2 试验方法
1.2.1 C2C12 细胞培养
从液氮罐中取出C2C12 细胞,37 ℃水浴锅快速融化,离心弃上清后用完全培养基(10%FBS+1%青链霉素+高糖DMEM)重悬细胞,接种于培养皿中。待细胞汇合度达到80%~90%时,进行传代,每2 d 更换细胞培养液一次。
1.2.2 C2C12 细胞转染及效率检测
取生长状态良好的C2C12 细胞接种到6 孔板中,待细胞汇合度达到50%左右时加入适量慢病毒载体进行转染。本试验分为4 个组,分别为:慢病毒包被过表达对照载体组(OE-NC)、慢病毒包被UCP3 过表达载体组(OE-UCP3)、慢病毒包被干扰对照载体组(Sh-NC)和慢病毒包被UCP3 干扰载体组(Sh-UCP3),每组设置3 个重复。转染72 h 后收集各组细胞,提取总RNA 并反转录成cDNA,运用qRT-PCR 方法检测各组细胞UCP3基因转染效率。qRT-PCR 引物序列如表1 所示。
1.2.3 EDU 检测细胞增殖
将成功转染不同慢病毒载体的细胞每孔5 000个细胞的密度接种于24 孔板中,每组3 个重复。细胞培养12 h 后,更换为50 μmol·L-1的EDU 培养基,CO2培养箱中孵育2 h;倒掉EDU 培养基,加入4%多聚甲醛固定30 min,然后加入200 μL 2 mg·mL-1甘氨酸,室温摇床孵育5 min,PBS 清洗3 次,每次5 min;加入300 μL 0.5% Triton X-100,室温孵育30 min;加入200 μL Apollo 染色液,室温避光孵育30 min;加入0.5% Triton X-100 清洗3 次,每次10 min;加入DAPI 染色液,进行细胞核染色。荧光显微镜下观察染色结果,并使用ImageJ 软件统计EDU 阳性细胞数。
1.2.4 CCK-8 检测细胞增殖
将不同处理组的细胞接种到5 个96 孔板中,每个处理组设置3 个孔重复,每孔大约1 000 个细胞。分别在0 h、12 h、24 h、36 h 和48 h 时加入10 μL CCK-8 溶液,混匀,37 ℃的CO2培养箱中孵育2 h,使用酶标仪检测450 nm 处的OD 值,并绘制细胞增殖曲线。
1.2.5 细胞总RNA 提取和cDNA 合成
将不同处理组的细胞接种于12 孔板中,每个处理组设置3 个孔重复,待细胞汇合度达到90%左右时,收集细胞并提取总RNA,然后利用TaKa-Ra 公司的反转录试剂盒合成cDNA。反转录程序按照试剂盒说明书进行,合成的cDNA 放入−20℃冰箱保存备用。
1.2.6 qRT-PCR
将合成的cDNA 原液稀释10 倍用于qRTPCR 检测。qRT-PCR 反应的总体积为20 μL:上下游引物各0.35 μL,cDNA2 μL,2×SYBR Premix Ex Taq Ⅱ10 μL,RNAase Free ddH2O 补齐至20 μL。反应程序依照SYBR Premix Ex Taq Ⅱ说明书进行:95 ℃预变性30 s;95 ℃变性5 s,59 ℃退火30 s,72 ℃延伸30 s,45 个循环;95 ℃15 s,65 ℃30 s,95 ℃30 s 制作熔解曲线。内参基因为18S rRNA。qRT-PCR 反应的引物序列见表1。

表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequences
1.2.7 Western Blot
收集不同处理组细胞,充分裂解后提取总蛋白,使用核酸蛋白测定仪测定蛋白浓度。将蛋白样品与上样缓冲液充分混合,100 ℃变性10 min,进行SDS-PAGE 凝胶电泳,程序为:80 V 30 min;100 V 80 min。进行转膜,转膜程序为:100 V 90 min;转膜后放入5%脱脂奶粉中,室温摇床封闭1 h;分别加入β-actin 抗体(1∶2 000)和PCNA 抗体(1∶1 000),4 ℃过夜;加入二抗(1∶20 000),室温孵育1 h;洗膜后利用远红外光扫描系统观察试验结果并拍照。
1.3 数据分析
采用IBM SPSS Statistics 22 软件进行统计学分析,采用独立样本t检验进行差异显著性检验,运用GraphPad Prism 5 软件绘制柱状图。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 UCP3 过表达与干扰转染效率检测
通过慢病毒转染UCP3 过表达与干扰载体到C2C12 细胞中,培养72 h 后采用qRT-PCR 技术检测UCP3 基因表达量的变化,结果显示,过表达与干扰UCP3 组较对照组均有极显著差异(P<0.01)(图1A 和1B)。转染后细胞可用于后续试验。
2.2 过表达UCP3 抑制C2C12 细胞的增殖
通过慢病毒转染UCP3 过表达载体到C2C12细胞中,通过EDU 染色和CCK-8 试验检测细胞的增殖效果。EDU 染色结果发现,与OE-NC 组相比,OE-UCP3 组中EDU 阳性细胞的数量明显减少(图2A 和图2B)。CCK-8 试验结果发现,细胞培 养12 h 和24 h 时,OE-NC 和OE-UCP3 组 的 细胞数目并没有明显的差异;当细胞培养36 h 和48 h时,OE-UCP3 组的细胞数目明显低于OE-NC 组(图2C)。EDU 染色和CCK-8 试验结果说明,过表达UCP3 可以显著抑制C2C12 细胞的增殖。
2.3 过表达UCP3 对细胞增殖及凋亡相关基因表达量的影响

图1 UCP3 过表达与干扰效率检测Fig.1 The relative expression of UCP3 gene in different groups
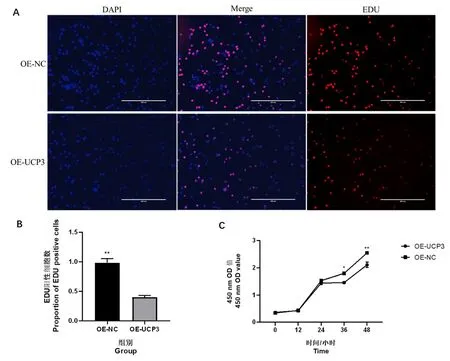
图2 OE-UCP3 和OE-NC 组C2C12 细胞的增殖速率Fig.2 Proliferation rate of C2C12 cells in OE-UCP3 and OE-NC groups
通过慢病毒转染UCP3 过表达载体到C2C12细胞中,细胞培养36 h 后通过qRT-PCR 检测增殖和凋亡基因的表达量变化。结果发现,与OE-NC组相比,OE-UCP3 组细胞的增殖基因PCNA和Ki67 的表达量极显著降低,而凋亡基因caspase3 和Bax的表达量极显著升高(P<0.01)(图3A)。Western Blot 的 试 验 结 果 也 发 现,OE-UCP3 组 细胞中PCNA 蛋白的含量也极显著低于OE-NC 组(P<0.01)(图3B 和3C)。qRT-PCR 和Western Blot 的试验结果说明,过表达UCP3 可以抑制增殖基因PCNA和Ki67 的表达,促进凋亡基因cas-pase3 和Bax的表达,从而抑制细胞增殖。
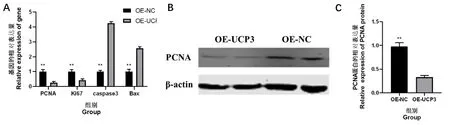
图3 OE-UCP3 和OE-NC 组细胞中增殖和凋亡基因的表达量Fig.3 The expression of proliferation and apoptosis genes in OE-UCP3 and OE-NC groups
2.4 干扰UCP3 促进C2C12 细胞增殖
通过慢病毒转染UCP3 干扰载体到C2C12 细胞中,然后分别通过EDU 染色和CCK-8 试验检测细胞的增殖效果。EDU 染色试验结果发现,与Sh-NC 组 相 比,Sh-UCP3 组 中EDU 阳 性 细 胞 的数量明显增多(图4A 和4B)。CCK-8 试验结果发现,细 胞 培 养12 h 时,Sh-NC 和Sh-UCP3 组的细胞数目并没有明显的差异;当细胞培养24 h、36 h和48 h 时,Sh-UCP3 组的细胞数目明显高于Sh-NC 组(图4C)。EDU 染色和CCK-8 试验结果均说明干扰UCP3 可以显著促进C2C12 细胞增殖。
2.5 干扰UCP3 对细胞增殖及凋亡相关基因表达量的影响
通过慢病毒转染UCP3 干扰载体到C2C12 细胞中,细胞培养36 h 后通过qRT-PCR 试验检测增殖和凋亡基因的表达量变化。结果发现,与Sh-NC 组相比,Sh-UCP3 组细胞的增殖基因PCNA和Ki67 的表达量极显著升高(P<0.01),而凋亡基因caspase3 和Bax的表达量显著降低(P<0.05)(图5A)。Western Blot 的试验结果也发现,Sh-UCP3 组细胞中PCNA 蛋白的含量也显著高于Sh-NC 组(P<0.05)(图5B 和图5C)。qRT-PCR和Western Blot 的试验结果说明,干扰UCP3 可以促进增殖基因PCNA和Ki67 的表达,抑制凋亡基因caspase3 和Bax的表达,从而促进细胞增殖。
3 讨论
解偶联蛋白(UCP)家族包含5 个成员,分别是UCP1、UCP2、UCP3、UCP4 和UCP5。UCP 家族成员调控细胞增殖的研究报道较少,而且在不同细胞中的结果并不一致。Elorza 等[13]研究发现,UCP2 可以降低小鼠红细胞线粒体中ROS 的含量,进而激活MAPK/ERK 信号通路,促进红细胞的增殖。Pauline 等[14]研 究发现,UCP2 可以通过降低己糖激酶2(HK2)的活性,抑制小鼠黑色素瘤细胞(B16F10)的糖酵解水平,抑制细胞的增殖。刘颖[15]等研究发现,干扰UCP2 基因表达后,G1/S期的细胞数目明显增加,下咽癌细胞系(FADU)的增殖能力显著降低。安建多等[16,17]研究发现,在大鼠肝脏再生过程中,UCP2 可以通过促进星形细胞的增殖,加速肝脏组织的再生。然而,Zhang等[18]研究发现,敲除UCP2 可以促进人类主动脉平滑肌细胞系(HA-SMC)增殖,而过表达UCP2可以抑制HA-SMC 增殖。张敏等[19]研究发现,过表达UCP4 后,处于S 期的3T3-L1 细胞数目明显增多,促进细胞增殖。Zhang 等[20]研究发现,过表达UCP4 可以促进大鼠网膜组织前体脂肪细胞的增殖,并抑制其凋亡。目前,关于UCP3 对细胞增殖的研究还未见报道。本研究发现,UCP3 可以通过抑制增殖基因PCNA和Ki67 的表达,促进凋亡基因Caspase3 与Bax的表达,进而抑制C2C12 细胞的增殖。
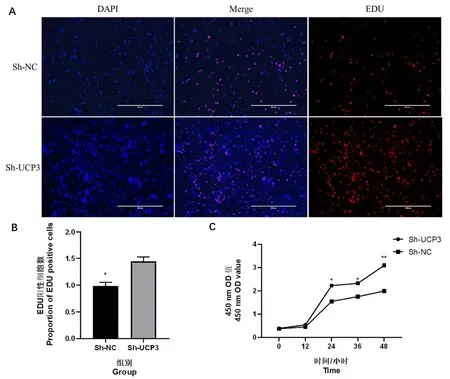
图4 Sh-UCP3 和Sh-NC 组C2C12 细胞的增殖速率Fig.4 Proliferation rate of C2C12 cells in Sh-UCP3 and Sh-NC groups
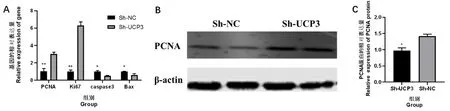
图5 Sh-UCP3 和Sh-NC 组细胞中增殖和凋亡基因的表达量Fig.5 The expression of proliferation and apoptosis genes in Sh-UCP3 and Sh-NC group
细胞的增殖过程非常复杂,有很多基因参与调控细胞的增殖和凋亡。增殖细胞核抗原(PCNA)在DNA 的复制过程中发挥着重要的作用,可以促进细胞增殖[21,22]。Kong 等[23]研究发现,抑制lncLUCAT1 的表达,可以降低PCNA的表达量,从而抑制人类口腔鳞状细胞癌(OSCC)的增殖。He 等[24]研 究 发 现,lncAK027294 可 以 通 过 促 进PCNA的表达而促进人胃癌细胞(GC)的增殖。Lee 等[25]研究发现,在大鼠肝脏再生过程中,松针提取物可以通过促进PCNA和Ki67 的表达,从而促进肝脏细胞的增殖,加速肝脏再生。本研究也发现,过表达UCP3 基因,可以通过降低PCNA的表达量抑制C2C12 细胞的增殖。Caspase3 与Bax是重要的凋亡基因,其表达量与细胞增殖具有明显的负相关。抑制人类泛素化因子E4B(UCE4B)的表达,可以促进caspase3 的表达,进而抑制人鼻咽癌细胞的增殖[26]。Wang 等[27]研究发现,百合提取物通过上调caspase3 的表达,明显增加G2/M 期的细胞数量,抑制人胃癌细胞系SGC-7901 的增殖,并促进其凋亡。熊去氧胆酸(UDCA)可以通过抑制P53/Bax 信号通路降低Bax 蛋白的含量,进而抑制大鼠肝细胞凋亡[28]。Pan 等[29]研究发现,培养基中添加氟化物,可以促进C2C12 细胞中Bax的表达,抑制细胞增殖,加速细胞凋亡。韩宇等[30]研究发现,miR-19b 可以通过抑制Bax的表达,促进P19CL6 细胞的增殖,抑制其凋亡。本研究也发现,UCP3 可以促进caspase3 与Bax基因的表达,进而抑制C2C12 细胞的增殖。
4 结论
本研究发现过表达UCP3 基因可以显著降低C2C12 细胞增殖速率并显著减少EDU 阳性细胞数,通过抑制细胞增殖基因PCNA和Ki67 的表达,促进细胞凋亡基因Bax和caspase3 的表达进而抑制C2C12 细胞的增殖。干扰UCP3 基因可以提高降低C2C12 细胞增殖速率并显著增加EDU 阳性细胞数,通过促进细胞增殖基因PCNA和Ki67的表达,抑制细胞凋亡基因Bax和caspase3 的表达进而促进C2C12 细胞的增殖。

