外源乙酰化糖对碱胁迫下大豆幼苗的影响
殷丛丛,陈锦芳,郝统,胡晓芳,王敏,岳爱琴,杜维俊*,赵晋忠*
(1.山西农业大学 基础部,山西 太谷030800;2.山西农业大学 农学院,山西太谷030800)
土壤盐碱化是普遍存在的环境问题,也是制约农业生产的重要因素,应对盐碱胁迫是确保农业可持续发展的全球性问题。盐碱胁迫影响全球20%的土地和50%以上的灌溉农业用地[1]。当盐碱土壤中含有CO32−和(或)HCO3−,从而导致土壤pH 值升高时,植物会遭受盐和碱双重效应的胁迫[2]。研究证明碱胁迫的危害比盐胁迫更加复杂,具有更大的破坏力[3]。碱胁迫对植物的危害除了具有盐胁迫引发的渗透胁迫、离子毒害和氧化胁迫外,还有附加的高pH 胁迫。植物根系周围的高pH 环境会引起Ca2+、Mg2+等金属离子和磷的沉淀,严重影响植物对无机离子和磷的吸收,从而破坏细胞内的离子平衡和酸碱稳定[4],处于碱胁迫环境中的植物需要应对同时存在的多种胁迫干扰。如何提高植物对盐碱胁迫环境的适应性已成为备受关注的研究热点[5]。
利用外源物质提高植物的盐碱耐受能力是使其适应逆境的有效途径。外源化合物通常可提高植物的生理机能,增强光合能力,维持细胞膜完整性和离子平衡,从而提高植物对盐碱胁迫的抗逆性。任艳芳等[6]发现外源H2O2可促进小白菜种子萌发,明显缓解了NaCl 胁迫对小白菜种子和幼苗的伤害。黄放等[7]发现1.5~3.0 mmol·L−1水杨酸浸种24 h 可提高侧柏种子发芽率和幼苗SOD、CAT 活性,并促进幼苗地下部分生长。赖晶等[8]发现外源ATP 可使NaCl 胁迫下油菜幼苗ROS 含量、死细胞数量、MDA 含量等降低,提高叶片中叶绿素、渗透调节物质含量,增强其体内抗氧化酶活性。郑州元等[9]发现外源硫化氢可提高盐胁迫下加工番茄幼苗叶片的光合色素量和光合电子传递速率,有效缓解NaCl 对其叶片PSⅡ的伤害。已有报道多见于盐胁迫下外源物对植物生长及生理特性等的影响,关于外源物对碱胁迫下植物生长及生理特性影响的研究少有报道。
本课题组研发的化合物乙酰化糖作为一种新型改良剂,可降低土壤pH 值,改善土壤理化性质,促进玉米的生长[10],有效缓解碱胁迫对小麦幼苗生长的抑制,具有提高幼苗的光合作用和抗氧化酶活性等作用,从而显著促进其生长及生物量的积累[11]。浓度适宜的乙酰化糖还可提高大豆种子的发芽率、发芽指数、活力指数、发芽势和胚根长度[12]。但是,目前乙酰化糖对碱胁迫下大豆幼苗生长的影响尚未见报道。本文以碱胁迫下添加不同量乙酰化糖对大豆幼苗根系、生长指标及生理特性的影响为主要研究内容,以期为乙酰化糖提高植物抗逆性和盐碱地种植大豆提供理论基础。
1 材料与方法
1.1 试验材料
供试大豆品种为武乡小黑豆,山西农业大学大豆课题组提供;外源乙酰化糖(C16H22O11)由山西农业大学盐碱地治理研究课题组合成;Na2CO3和NaHCO3均为分析纯。
1.2 试验设计
设置7 个处理组,采用1/2 霍格兰营养液培养作为空白组W,空白组基础上加入碱性盐Na2CO3和NaHCO3(摩尔比1∶1,20 mmol·L−1)配制的碱胁迫溶液作为对照组CK,碱胁迫溶液基础上添加乙酰化糖作为处理溶液(表1)。

表1 不同处理溶液组成Table 1 Composition of different treatment solutions
1.3 大豆幼苗的培养
取大小均匀、颗粒饱满且无病害的武乡小黑豆,经1% NaClO 溶液消毒10 min、无菌水漂洗后,置于发芽盒中发芽,芽长3~4 cm 时移栽,在25 ℃、光暗周期为12 h/12 h 的条件下进行培养,每个处理3 次重复,3 d 更换一次培养液,胁迫7 d 后取样测定大豆幼苗根系形态指标、生长指标及根系生理特性指标。
1.4 测定指标与方法
切取1 cm 大豆幼苗根尖组织制备电镜样品,然后分别用KYKY-1000B 扫描电镜和DXB2-12型透射电子显微镜观察并拍照。用Win RHIZO PRO 2007 根系分析系统软件(Regent Instruments Inc8,Canada)分析根系形态学参数。用直尺测量培养7 d 后大豆子叶节至主茎顶端生长点的长度为株高。干、鲜质量测定参照宋松泉等[13]的方法。根系活力、渗透调节物质(可溶性蛋白、可溶性糖)含量和抗氧化物酶(SOD、POD、CAT)活性测定参照李合生的方法[14]。
1.5 数据处理
数据处理采用Microsoft Excel 2010,数据作图采用Origin 2017,利用SPSS 22 软件进行差异显著性分析。
2 结果与分析
2.1 乙酰化糖对碱胁迫下大豆幼苗根系的影响
2.1.1 大豆幼苗根系形态
由图1 可见,碱胁迫下(CK)大豆幼苗的主根短小,侧根极短且数量极少,根系颜色发黄,地上部分生长矮小,加入乙酰化糖后,大豆幼苗的主根变长,侧根数量增多、长度增加,地上部分增高明显。T3 处理下,幼苗根系发育最佳。
2.1.2 大豆幼苗根系生长指标
如表2 所示,碱胁迫处理(CK)7 d 后,大豆幼苗的总根长、总根系表面积、根系体积与空白组(W)相比分别降低了82.5%、65.2%、33.3%,且差异显著(P<0.05),根平均直径显著高于空白组。随着乙酰化糖浓度的增加,总根长、总根系表面积和根系体积的变化趋势为先增加后降低,T1~T5 处理的总根长、总根系表面积均高于CK,根平均直径显著低于CK。T3处理时,总根长、总根系表面积和根系体积达最大值,比CK处理分别增加了406.1%、184.4%、70.0%,且差异显著(P<0.05)。
2.1.3 大豆幼苗根尖表面特征

图1 不同处理下大豆幼苗根系形态Fig.1 Root morphology of soybean seedlings under different treatments

表2 不同处理下大豆幼苗根系指标Table 2 Root indexes of soybean seedlings under different treatments
扫描电镜下观察大豆幼苗根尖(图2),空白组(W)的大豆幼苗根尖细胞排列紧密,根尖光滑无损伤(图2A、图2B)。CK 处理下的大豆幼苗根尖结构被严重破坏,根尖表层凸起,组织排列疏松,甚至破裂掉落(图2C、图2D);T3 处理下,大豆根尖结构与空白组(W)无明显差异(图2E、图2F),说明添加乙酰化糖3 mmol·L-1时能够有效缓解碱胁迫对大豆幼苗根尖组织结构的伤害。
2.1.4 大豆幼苗根尖细胞壁超微结构
当植物遭受盐碱胁迫时,根尖细胞壁起着重要的保障作用,防止细胞在渗透胁迫作用下吸水过量涨破。透射电镜下观察大豆幼苗根尖超微结构(图3),CK 处理下,原生质体失水,细胞发生一定程度的收缩,细胞膜和细胞壁间间隙变大,原生质体中有的细胞器发生移动,图中可以看到线粒体结构等。T3 处理下,大豆根尖细胞的细胞壁结构排列紧密,各部位中原生质体由椭球形变成球形且内含物增多,细胞膜逐渐扩大向外延伸,有恢复到空白组(W)水平的倾向,与空白组根尖细胞壁结构无明显差异。

图2 不同处理下大豆幼苗根尖扫描电子显微照片Fig.2 Scanning electron micrograph of root tips of soybean seedlings under different treatments
2.1.5 大豆幼苗根系活力
由图4 可见,与空白组(W)相比,CK 处理下大豆幼苗的根系活力显著下降(P<0.05)。随乙酰化糖浓度的增加,根系活力呈逐渐上升的趋势,T3、T4、T5 处理时与CK 处理组差异达显著水平(P<0.05),且在T5 处理时达最大值290.28 mg·g−1·h−1。表明碱胁迫下添加改良剂乙酰化糖能显著提高大豆幼苗根系活力。
2.2 乙酰化糖对碱胁迫下大豆幼苗生长指标影响
2.2.1 大豆幼苗株高
如图5 所示,CK 处理显著降低了大豆幼苗株高(P<0.05)。添加乙酰化糖后,株高首先随其浓度的增加而逐渐增加,并在T3 处理时达最大值,比CK 处理增加了105.3%,说明乙酰化糖可有效缓解碱胁迫对大豆幼苗生长的抑制。株高并未随乙酰化糖浓度的增加而持续增加,T4 和T5 处理下,幼苗株高与CK 处理差异均不显著(P>0.05),说明过量的乙酰化糖反而使幼苗的生长反受到抑制,其影响机制有待于进一步研究。
2.2.2 大豆幼苗干、鲜重
由表3 可见,CK 处理降低了大豆幼苗地上部鲜重、地下部鲜重、地下部干重,分别为31.1%,52.7%,35.2%,与空白组差异显著(P<0.05)。添加乙酰化糖后,地上部鲜重、地下部鲜重、地下部干重与CK 处理相比差异显著(P<0.05),地上部干重与CK 处理相比差异不显著(P>0.05)。在T5 处理时,地上部鲜重达最大值,比CK 处理增加27.1%。在T4 处理时,地下部鲜、干重达最大值,分别比CK 处理增加84.3%、29.4%。这说明乙酰化糖有效促进了大豆幼苗地下部生长。
2.3 乙酰化糖对碱胁迫下大豆幼苗根系生理特性的影响
2.3.1 幼苗根系抗氧化酶活性
与空白组(W)相比,CK 处理下大豆幼苗根系的SOD、POD、CAT 活性显著升高(P<0.05)(图6A~图6C)。添加乙酰化糖后,SOD、POD 活性显著增强,且均在T2 处理时达到峰值,分别比CK 处理提高了98.0%、227.9%。CAT 活性显著低于空白组和CK 处理组,随着乙酰化糖浓度的增加而逐渐降低,并且各处理组之间差异显著(P<0.05)。说明碱胁迫激活了抗氧化酶的活性,添加适宜剂量的乙酰化糖可使SOD、POD 的活性增强,过量添加则会产生抑制作用。

图3 不同处理下大豆幼苗根尖不同部位细胞壁透射电镜图Fig.3 TEM images of cell walls at different root tips of soybean seedlings under different treatments

图4 不同处理下大豆幼苗根系活力Fig.4 Root vigor activity of soybean seedlings under different treatments

图5 不同处理下大豆幼苗株高Fig.5 Plant height of soybean seedlings under different treatments
2.3.2 幼苗根系渗透调节物质
由图7A 可以看出,CK 处理下大豆幼苗根系中的可溶性糖含量与空白组(W)相比显著增加。随着乙酰化糖浓度的增加,可溶性糖含量呈先升高后下降的变化趋势,在T3 处理时达最大值,较CK 处理提高了25.6%,差异达显著水平(P<0.05)。其余添加量条件下,可溶性糖含量均低于CK 处理组,说明乙酰化糖浓度为3 mmol·L-1时可通过增加可溶性糖含量进而提高大豆幼苗的渗透调节能力。
由图7B 可以看出,碱胁迫使大豆幼苗根系中的可溶性蛋白含量急剧下降,较空白组(W)下降了79.3%。添加乙酰化糖后,可溶性蛋白含量随其浓度的增加急剧上升,T2 处理时已增至CK 处理的3.94 倍,之后缓慢增加,T4 处理时达到最大值,为CK 处理的5.04 倍,并且T4、T5 处理组可溶性蛋白含量略高于空白组(W),说明乙酰化糖有利于幼苗中可溶性蛋白含量恢复至正常水平。
3 讨论
植物根系直接与土壤接触,是吸收营养和水分的重要器官,也是对环境胁迫最敏感的器官。碱胁迫条件下根系会产生相应的形态及生理变化,进而抑制植物的茎、叶等其它器官的生长发育,因此植物根系的生长发育状况和活力是评价植物抗逆性的重要指标。与地上部相比,根系生长更加消耗植物本身的能量,植物幼苗可自身减缓根系的生长来抵抗碱胁迫的伤害。已有研究表明,盐碱胁迫对海岛棉、黄瓜、番茄等的根系总长度、总表面积、体积以及根尖数有显著的抑制作用[15~17]。本试验中,碱胁迫下幼苗根系各项指标与对照组相比显著降低,根尖表层细胞凸起甚至破裂掉落、原生质体失水,说明碱胁迫已对大豆幼苗根系造成了不可逆伤害。添加乙酰化糖后,幼苗根系总根长、总根系表面积、根系体积等显著增加,根尖结构细胞排列紧密,组织结构损伤明显缓解。并且,根系活力随乙酰化糖浓度的增加呈逐渐增强的趋势,表明乙酰化糖促进了碱胁迫下大豆幼苗的根系发育,增强了根系吸收水分和运输营养的功能。
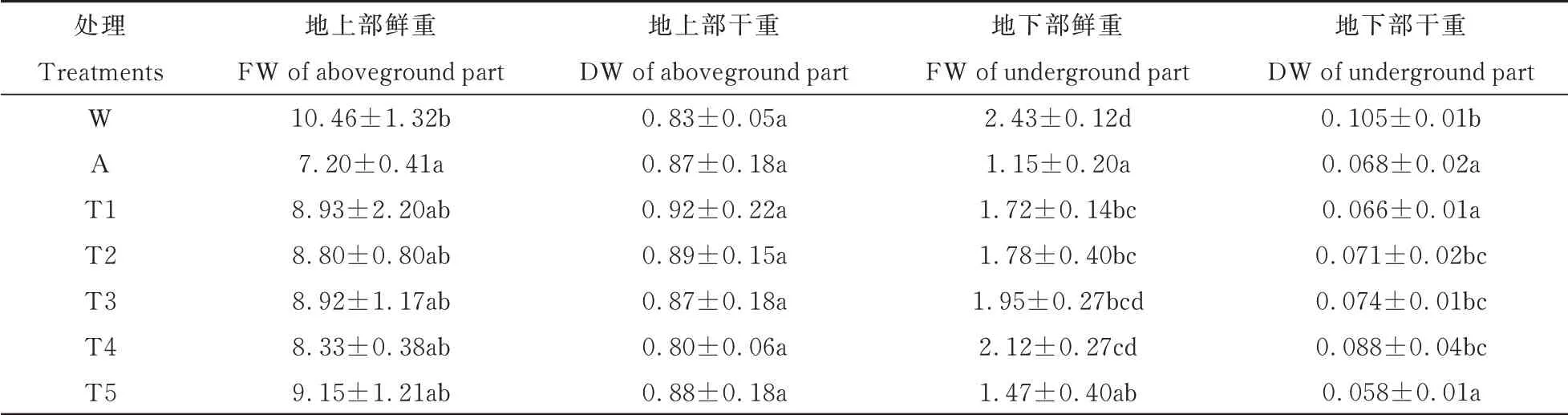
表3 不同处理下大豆幼苗干、鲜重的变化Table 3 Changes of dry and fresh weight of soybean seedlings under different treatments 单位:g·10 plant-1

图6 不同处理下大豆幼苗根系的抗氧化酶活性Fig.6 Antioxidant enzyme activities of soybean seedling roots under different treatments

图7 不同处理下大豆幼苗根系的渗透调节物含量Fig.7 Osmotic regulator content of soybean seedling roots under different treatments
幼苗阶段是植物对盐碱胁迫较敏感的时期,生长受到抑制是最为直观的表现。由于植物需消耗更多的能量和有机物质来应对盐碱胁迫引发的胁迫渗透和离子毒害,因此,生物量的积累和株高会受到不同程度的抑制[18~20]。生物量的积累反应植物维持生命活力的能力,本研究结果表明,碱胁迫对大豆幼苗生物量的积累和株高均造成了不利影响。但是,碱胁迫下适量乙酰化糖的添加可使大豆幼苗地下部生物量的积累显著增加,从而提高了根冠比,说明在乙酰化糖作用下,大豆幼苗增加了生物量在根系上的分配来抵抗碱胁迫的破坏作用。株高的显著增加,一方面反映了乙酰化糖对幼苗根系起到了修护作用,增强了其吸收营养和水分的功能;另一方面可能乙酰化糖本身作为养分被幼苗吸收,促进了幼苗生长。
盐碱胁迫会导致植物细胞内产生大量的活性氧自由基,损坏膜系统的完整性。植物体内存在抗氧化系统来抵抗逆境胁迫,且效果依赖于抗氧化酶间的协调配合,SOD、POD、CAT 是植物抗氧化系统的重要组成,可有效清除活性氧自由基。SOD 可以将O2−催化成H2O2,构成清除活性氧自由基的第一道防线,而H2O2同时又是SOD 的抑制剂,需要被POD 与CAT 进一步分解。本研究中,碱胁迫下大豆幼苗的SOD、POD、CAT 活性较空白组显著增加,说明碱胁迫已将抗氧化系统激活。加入乙酰化糖后,SOD、POD 活性较空白组及碱胁迫处理组显著增高;而CAT 活性则较对照组及碱胁迫处理组显著降低,且随其浓度的增加而逐渐降低。表明乙酰化糖显著增强了SOD、POD 活性,二者相互配合足以对幼苗进行膜系统修复,并维持膜系统的稳定,因此CAT 活性显著降低,究其原因可能是CAT 对H2O2的亲和力较低,只有在H2O2较高浓度时才能与之高效结合,在SOD、POD 活性被乙酰化糖显著增强的情况下,无需CAT 参与清除反应。但在较高浓度乙酰化糖作用下,SOD、POD 活性反而有所降低,说明高浓度的乙酰化糖可能对二者活性有抑制作用。
渗透调节是植物应对盐碱胁迫逆境的主动调节机制。可溶性蛋白和可溶性糖作为植物体内重要的渗透调节物质,可缓冲植物细胞内高浓度无机离子,帮助植物适应逆境。已有报道,不同植物体内渗透调节物质含量随盐浓度变化的呈现不同的变化规律。可溶性糖含量在盐、碱胁迫下碱地肤[21]、野大麦[22]中随盐浓度的升高而升高,而在马齿苋[23]、大果白刺叶片[24]中则呈先升高后下降的趋势。可溶性蛋白含量在盐碱胁迫下羊草[25]中随盐分含量的增加而逐渐升高,而在冬油菜[26]中含量则逐渐降低,芦笋在不同浓度盐、碱、混合盐胁迫下的变化规律不同[27]。本研究中,与空白组相比,碱胁迫下可溶性糖含量显著升高,而可溶性蛋白含量显著降低,说明在大豆幼苗的渗透调节方面,可溶性糖比可溶性蛋白占据更重要的地位。碱胁迫下添加乙酰化糖后,可溶性糖含量3 mmol·L−1时显著高于碱胁迫处理组;可溶性蛋白含量则随乙酰化糖浓度的增加而逐渐增加,直至与空白组含量接近,表明乙酰化糖的加入不但可以帮助大豆幼苗积累可溶性糖来调节体内的渗透式以及缓解离子毒害作用,而且有助于缓解可溶性蛋白的氧化损伤,使之恢复到正常水平。
4 结论
乙酰化糖降低了碱胁迫溶液的pH 值,提高了碱胁迫下大豆幼苗的抗氧化酶活性、渗透调节物质含量及根系活力,促进了大豆幼苗的生长发育,说明乙酰化糖不仅可以有效缓解碱胁迫对大豆幼苗的损伤、增强其抗逆性及根系的生理功能,并且绿色环保无污染,不会产生其它有害化合物。但其作用机制是复杂的过程,尤其对植物各生理过程的调控机制及作用原理尚需深入研究。综合考虑株高、生物量、根系等各项指标,乙酰化糖较适宜的浓度为3 mmol·L−1,浓度过高会抑制大豆幼苗的生长。本研究结果为盐碱地种植大豆提供了一定的理论基础。

