宫颈胃型腺癌2例报告
董 喆 夏 伟 韩肖彤 王 静 杨文兰 李天英 张恩龙 熊光武
(北京大学国际医院妇产科,北京 102206)
宫颈胃型腺癌是宫颈黏液腺癌的一种亚型,2014年WHO女性生殖器官肿瘤分类中将其定义为具有胃型分化的黏液腺癌,目前的研究表明其发病与HPV感染不相关,因其症状不典型,筛查及活检阳性率低,早期发现并诊断较困难。与普通型宫颈腺癌(usual type endocervical adenocarcinoma,UEA)相比,胃型腺癌具有较高的侵袭性,且对辅助治疗敏感性差,多数预后欠佳。随着HPV疫苗的应用普及,HPV相关性宫颈癌发病率逐年下降,因此,对于非HPV相关性宫颈癌的识别及诊治对临床工作提出新的挑战。本文对我院近期2例胃型宫颈腺癌的临床病理特征进行分析,探讨可行的诊疗方案。
1 临床资料
病例1:57岁,孕3产1,因绝经9年,阴道流血1次于2020年4月22日入院。患者绝经后无激素补充治疗史,2周前无明显诱因出现阴道少量流血1次,量少,色淡红,无腹痛、腰痛,无阴道流液等不适。妇科检查提示:宫颈质硬、增粗,约3 cm,9点处紫黑色囊肿,直径约1 cm,右附件区触及直径约5 cm囊性包块,余未见异常。初步诊断:宫颈微偏腺癌(minimal deviation adenocarcinoma,MDA)ⅠB2期可能。即行宫颈多点活检、TCT、HPV、阴道超声、盆腔MRI、腹盆腔CT、女肿瘤标志物等检查。宫颈活检病理示腺癌,倾向于宫颈来源非HPV相关腺癌,免疫组化PAX8(部分+),CK7(+),CEA(+)。TCT示非典型鳞状细胞,不除外高级别鳞状上皮内病变,HPV阴性。阴道超声:宫颈大小3.4 cm×3.3 cm×2.9 cm,回声不均,右侧卵巢囊性包块5.6 cm×5.3 cm×5.7 cm,内见分隔。盆腔MRI(图1A):子宫颈增厚,可见较均匀性强化,宫颈筋膜环增厚,增强扫描中度强化,最厚处直径约1.4 cm,上下径约2.9 cm,呈等T1稍长T2信号影,DWI呈稍高信号;右侧附件区可见厚壁囊性肿块,大小约4.8 cm×5.7 cm,内壁不光滑,伴多发小囊状厚壁结节,增强扫描囊壁、壁结节可见明显强化,盆腔淋巴结未见肿大。腹盆腔CT:盆腹腔及腹膜后未见肿大淋巴结,余未见异常。CA19-9 148.8 U/ml,CA125、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCA)、CEA等均正常。门诊以“宫颈腺癌ⅠB2期,右卵巢转移?”收入院。患者既往体健,因本人与父母为收养关系,故家族史不详。入院查体:全身查体无明显异常。妇科检查:宫颈表面呈活检后改变,宫颈增粗质硬,直径约3 cm大小,子宫前位,活动可,宫旁无增厚,右附件区触及直径约5 cm囊性肿物,活动尚可,三合诊主骶韧带无增厚。入院诊断:宫颈腺癌ⅠB2期,右卵巢转移?常规术前准备后于2020年4月24日在全麻下行腹腔镜广泛子宫+双附件+盆腔及腹主动脉旁淋巴结切除术。术中见子宫约7 cm×5 cm×3 cm大小,活动良好,双侧主骶韧带无明显缩短,右侧卵巢增大约5 cm,表面光滑,与周围组织无粘连,其余盆腹腔脏器未见异常。手术过程顺利,经阴道切断阴道壁,完整取出各标本(图1B),剖视标本见右卵巢内黏液样液体,内壁可见乳头凸起,直径约1 cm,冰冻病理示卵巢黏液性肿瘤,结合病史不除外转移。故决定行大网膜及阑尾切除术,标本经阴道取出。手术过程顺利,手术时间221 min,术中出血约100 ml。术后病理(图1C、D):宫颈胃型黏液腺癌,大小约3.5 cm×3 cm×2.5 cm,浸润宫颈壁全层,侵及左宫旁内中1/3组织及右宫旁中1/3组织,可见脉管内癌栓及神经侵犯,右侧卵巢黏液腺癌,符合宫颈胃型黏液腺癌转移;右侧输卵管黏膜见癌转移,左侧输卵管、卵巢见癌侵及,阴道壁断端局灶见癌侵及。免疫组化:CK7(+),Calretion(+),CD31(血管+),S-100(神经+),MSH6(+),MSH2(+),MLH1(+),PMS2(大部分+),P53(野生型),PAX8(部分+)。左侧盆腔淋巴结可见癌转移(2/22),右侧盆腔淋巴结未见癌转移(0/16),腹主动脉旁淋巴结未见癌转移(0/15);大网膜可见腺癌浸润;慢性阑尾炎。根据FIGO 2018宫颈癌分期,术后诊断:宫颈胃型腺癌ⅣB期。术后决定化疗+放疗序贯治疗(夹心疗法)。术后第5天CA19-9降至57.6 U/ml。术后第6天行TP方案化疗1个疗程,术后7 d出院。肿瘤基因检测,未发现胚系变异,发现体细胞变异6个(SMAD4、ERBB2、TGFBR2、ARID2 2个位点变异、RNF43),未发现有效靶向药物,肿瘤细胞微卫星稳定、突变负荷低(TMB-L),PD-L1 TPS<1%,CPS<1。现已完成术后第4疗程化疗及盆腔外照射、后桩放疗,末次随访时间2020年11月20日,肿瘤标记物均正常,影像学及查体无复发证据。
病例2:39岁,孕1产1,因阴道排液4个月,接触性出血1次于2020年4月26日入院。患者月经规律,3年前查体发现宫颈息肉,未治疗。近4个月自觉阴道排液增多,1个月前因接触性出血1次,当地医院检查,TCT未见上皮内瘤变,HPV阴性;分段诊刮+宫颈活检病理示宫颈黏液腺癌。妇科检查:外阴阴道未见异常,宫颈表面光滑,宫颈管内可见直径约0.5 cm息肉样赘生物(图2A),宫颈质硬、膨大增粗,约5 cm,子宫、附件及宫旁组织均未扪及异常。门诊以“宫颈腺癌ⅠB3期”收入院。既往患者因阑尾炎行阑尾切除术,因乳腺癌于2016年行乳腺癌根治术,术后足量放疗后口服他莫昔芬治疗,3个月前停药。否认家族性乳腺癌、卵巢癌等肿瘤病史。入院后全身查体未见异常,妇科检查同前。盆腔MR(图2B):宫颈正常结构消失,局部见呈等T1、混杂稍长T2信号团块影,DWI呈高信号,病变范围约5.8 cm×3.3 cm×3.7cm,边界不清,病变向上累及子宫体,阴道壁未见增厚,双侧宫旁脂肪间隙模糊。腹盆腔CT:盆腹腔及腹膜后未见肿大淋巴结,余未见异常。CA19-9 1902 U/ml,其余肿瘤标记物正常。宫颈活检我院病理会诊示宫颈黏液腺癌。诊断:宫颈腺癌ⅠB3期,乳腺癌术后放疗后内分泌治疗后,阑尾切除术后。常规术前准备后于2020年4月28日在全麻下行腹腔镜广泛全子宫+双侧附件+盆腔、腹主动脉旁及骶前淋巴结切除术。术中见子宫增大约10 cm×6 cm×4 cm大小,子宫下段增粗,约5 cm,双侧主骶韧带未见缩短,左侧卵巢增大直径约4 cm,左侧输卵管增粗迂曲包绕左侧卵巢粘连于子宫后壁,右侧卵巢及输卵管未见异常,阑尾缺如、盆腹腔其他脏器未见异常。右髂外动脉近段可及一肿大淋巴结约1.5 cm×0.5 cm大小。手术过程顺利,经阴道切断阴道壁,完整取出各标本(图2C)。手术时间179 min,术中出血约50 ml。术后病理:宫颈胃型黏液腺癌,肿瘤大小约6 cm×5 cm×2 cm,侵及颈管壁全层,侵出外膜周围少量肌组织中;可见脉管内癌栓,左侧输卵管、右侧卵巢、左、右宫旁组织、左、右盆腔、腹主动脉旁淋巴结可见癌转移(图2D)。左输卵管多发滤泡囊肿。免疫组化CK7(+),PAX8(少数+),ER(-),PR(-),P16(少数+),Ki-67(热区30%+),P53(野生型+); EMA(+),MUC5ac(-)。根据FIGO 2018宫颈癌分期标准,诊断宫颈胃型腺癌ⅢC2p期。术后决定化疗+放疗序贯治疗(夹心疗法)。术后第4天CA19-9降至251 U/ml。术后第6天行TP方案化疗1个疗程,术后7 d出院。患者回当地医院继续治疗,末次随访时间2020年10月29日,已完成术后2疗程化疗,盆腔外照射及后桩放疗,因肾功能异常,化疗暂缓。
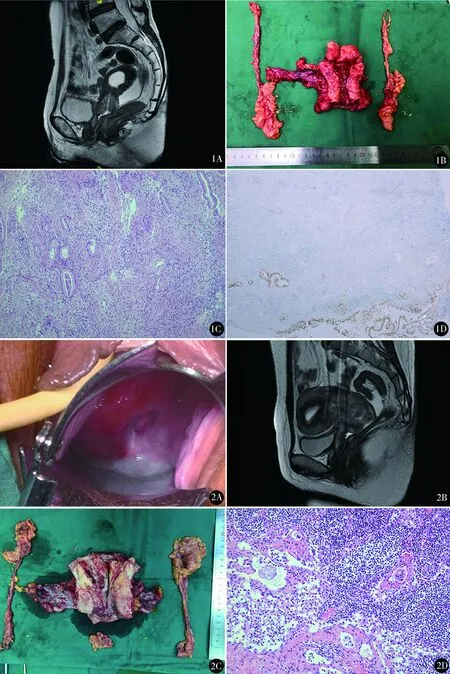
图1 A.盆腔增强MR,矢状位T2W1显示:子宫腔扩张,宫颈管增粗,局部减T2W1稍高信号肿块,边界不清,病变内见多发类圆形T2W1高信号,宫颈浆膜面光滑,未累及阴道;B.大体标本;C.宫颈组织内见分化良好的腺癌浸润(HE染色 ×200);D.免疫组化PAX8部分阳性(×40) 图2 A.宫颈表面光滑,宫颈管内见息肉样赘生物直径约0.5 cm;B.盆腔增强MR矢状位T2W1显示宫颈管明显增粗,局部见T2W1稍高信号肿块影,边界不清,肿瘤未累及阴道;C.大体标本;D.腹主动脉旁淋巴结见腺癌细胞浸润(HE染色 ×200)
2 讨论
宫颈癌为女性常见的恶性肿瘤,发病率及癌症相关死亡率均居于第4位,2018年全球新发病例约570 000例,死亡病例约311 000例[1]。宫颈鳞癌多见,占宫颈癌75%~80%。宫颈腺癌根据是否与HPV相关可分为HPV相关型和非HPV相关型,前者包括普通型宫颈腺癌、绒毛管状腺癌、HPV相关型黏液腺癌、浸润性黏液生成癌;后者包括胃型腺癌、中肾管癌、透明细胞癌、浆液性癌、子宫内膜样腺癌等[2]。宫颈胃型腺癌的分类最初由日本学者在2007年提出,Kajima等[3]检测53例宫颈黏液腺癌,HIK1083表达阳性的部分病例具有胃型分化特征,且与其他宫颈腺癌相比有显著的疾病复发风险(HR=4.5,95%CI:1.42~14.2,P=0.001),与5年疾病特异性生存率下降有关(38% vs. 74%,P<0.005),因此,首次将这部分特征的黏液腺癌分类为宫颈胃型腺癌。2014年WHO女性生殖系统肿瘤分类中采纳这一标准[4],将其归类为宫颈腺癌其中一个亚型,也是非HPV相关性宫颈腺癌中最为常见的亚型,占宫颈腺癌比例在美国及欧洲国家约为10%,日本高达20%~25%[5,6],其中高分化宫颈胃型腺癌亦称作MDA,病因及发病机制尚不清楚,可能与叶状宫颈腺体内膜增生(lobular endocervical glandular hyperplasia,LEGH)和P-J(Peutz-Jeghers)综合征有关[7,8]。
2.1 临床特点及诊断
宫颈胃型腺癌可表现为阴道水样或黏液样分泌物增多,可有阴道不规则流血、接触性出血等。因病灶多位于宫颈管内,查体可见宫颈表面光滑,部分可合并息肉样赘生物或宫颈囊肿,宫颈增粗呈桶状,质地较硬,有沿腹膜扩散累及卵巢、大网膜倾向[9,10]。不同于宫颈鳞癌患者SCCA升高,宫颈胃型腺癌肿瘤标记物以CA19-9升高多见,但缺乏特异性,CA125、CA153、CEA多正常或轻度升高[11]。对CA19-9的监测可作为评估治疗效果和复发的参考。
宫颈细胞学检查可发现异常腺细胞、宫颈腺癌细胞,但也有报道中显示TCT正常,HPV检测在宫颈胃型腺癌患者中多为阴性。阴道镜下宫颈质硬部位活检联合宫颈管搔刮可能获得更高的诊断阳性率。盆腔增强MR对判断病灶大小及宫旁累及有一定意义,Kido等[12]报道宫颈胃型腺癌影像学特征为位于宫颈管上段的内生型浸润性生长的边界不清肿块(93.3%),可向上生长侵及子宫内膜及肌层,并伴有微小囊肿或囊性空洞形成(80%)。肿块呈结节状或不规则生长破坏宫颈筋膜环是宫旁转移的标志[13],但影像学往往会低估宫旁浸润的程度。
病例2有明确的阴道排液病史,查体宫颈表面光滑,宫颈管内仅见到息肉样赘生物,极易发生漏诊。但2例MRI均表现为宫颈管内生型占位伴囊性空洞形成。通过宫颈活检及宫颈管搔刮得以明确诊断。
2.2 治疗及预后
多数指南对宫颈癌的治疗是基于宫颈鳞癌及UEA的数据,非HPV相关性宫颈腺癌具有不同于前两者的特点及转归,由于其发病率较低,尚缺乏大样本随机对照试验证据,治疗尚无标准化建议。
目前,治疗方案仍以手术为主,术后辅以铂类为基础的同步放化疗或放疗,或放疗+化疗。手术方式建议行广泛性子宫切除+双侧附件切除+盆腔+腹主动脉旁淋巴结切除。Karamurzin等[5]分析40例宫颈黏液性腺癌的临床特点,宫颈胃型腺癌诊断时59%为晚期(FIGO Ⅱ~Ⅳ期),50%存在淋巴结转移,35%存在卵巢受累,20%伴有腹部脏器受累或转移;39%的患者初次手术时至少有1个部位转移灶,包括淋巴结、附件、大网膜、肠管、腹膜、膈下、腹壁、膀胱、阴道、阑尾、大脑等。宫颈胃型腺癌患者5年疾病特异性生存率明显低于UEA(42% vs. 91%)。孙睿等[14]报道5例ⅠB期宫颈胃型腺癌,其中2例(40%)术后病理证实卵巢转移。鉴于宫颈胃型腺癌早期即可能出现卵巢、大网膜转移,术中应全面探查盆腹腔,建议切除阑尾及大网膜,晚期患者需要行肿瘤细胞减灭术,尽量切除一切肉眼可见病灶。
病例1因右侧卵巢术中冰冻病理提示黏液性肿瘤,遂行大网膜切除,术后病理证实大网膜转移。病例2虽然卵巢外观正常,术后病理亦提示卵巢、输卵管转移,大网膜未切除,有无转移不得而知。虽然卵巢转移并不改变宫颈癌分期,但与不良预后明显相关。因此,即使年轻早期患者仍不建议保留生育功能和卵巢,术后可口服莉芙敏治疗以改善低雌激素症状,也可考虑低剂量雌激素治疗,不仅可以改善低雌激素症状,还有助于减轻或降低低雌激素所致心脑血管疾病和骨质破坏等,剂型上可考虑尽力避免单一雌激素。宫颈腺癌术后应用替勃龙治疗对PFS、OS均无影响,且会改善患者因手术绝经导致的潮热、出汗等不适,明显改善生活质量[15]。
目前,对于晚期宫颈癌及术后存在高危因素者,仍推荐行同步放化疗(concurrent chemoradiotherapy, CCRT),但CCRT在宫颈腺癌的治疗一直存有争议。Hu等[16]回顾分析815例 ⅠB~ⅣA 期宫颈癌行CCRT,其中鳞癌744例,腺癌71例,结果显示腺癌与鳞癌相比,无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS)、盆腔及远处控制率均有明显统计学差异,提示腺癌对CCRT有效性低于鳞癌,且需要更长时间才能达到CR,经治疗后远处复发风险也高于鳞癌。对宫颈腺癌不同组织学类型与预后关系的研究显示,与UEA比较,宫颈胃型腺癌对放化疗敏感性更差。一项由Sankai妇科肿瘤组发起的多西他赛+卡铂新辅助化疗Ⅱ期临床试验,纳入肿瘤直径>4 cm ⅠB2~ⅡB期UEA 20例,宫颈胃型腺癌13例,宫颈胃型腺癌对化疗的反应率明显低于UEA(42.6% vs. 85%),8例Ⅱ期宫颈胃型腺癌对新辅助化疗均无反应,其中1例在化疗过程中肿瘤进展[17]。因此,是否术前新辅助化疗降低分期仍存争议,多数学者仍主张术后行以铂为基础的同步放化疗加或不加联合化疗。
因宫颈胃型腺癌盆腔脏器累及、远处转移复发的特点,我们建议术后行紫杉醇静脉+顺铂腹腔联合化疗+盆腔外照射序贯治疗,并根据术中高危因素必要时增加腔内照射和腹主动脉旁延伸野照射,可放疗前后各2~3个疗程化疗,总疗程4~6次。目前,已有研究[18,19]证明采取以上类似方案可改善局部晚期宫颈癌预后,但对于宫颈胃型腺癌来说,由于缺乏大样本量研究,预后仍有待观察。
综上所述,宫颈胃型腺癌是一种较少见的宫颈黏液性腺癌,发病与HPV感染不相关,主要表现为阴道排液和接触性出血,宫颈局部膨胀性生长,质硬病灶为典型体征,就诊时多数已是晚期,或伴有盆腹腔及远处转移,即使宫颈局部病灶为早期,仍可能存在宫旁组织、腹膜后淋巴结、卵巢、大网膜、肠管等部位的高转移率;CA19-9升高具有辅助诊断意义和治疗监测价值。增强MR宫颈管上段浸润性生长伴有囊性空洞的病灶对诊断有一定价值。治疗以手术为主,放化疗为辅的综合治疗,易复发及远处转移,多数预后不良。我们建议对于拟行手术治疗的宫颈胃型腺癌患者,术前应进行充分的影像学评估,查清肿瘤扩散的部位和范围;术中全面仔细探查盆腹腔各器官和组织,特别注意上腹部、膈下、网膜和腹膜后淋巴结;手术范围,除常规的广泛子宫、双附件、盆腔及腹主动脉旁淋巴结切除外,建议同时切除大网膜、阑尾以及所有转移病灶,有助于切净肉眼可见肿瘤,发现远处转移,确定肿瘤病理分期和指导术后辅助治疗;术后根据高危因素积极采取化疗+放疗的序贯治疗对改善预后可能有益。

