凋落物对土壤有机碳与微生物功能多样性的影响
王利彦,周国娜,朱新玉,高宝嘉,*,许会道
1 河北农业大学 林学院, 保定 071000
2 商丘师范学院 测绘与规划学院,商丘 476000
凋落物是植物生长发育过程中新陈代谢的产物,有利于促进土壤有机碳(soil organic carbon,SOC)的形成和微生物的活性及群落生长繁殖,土壤微生物在凋落物分解、有机质转化等方面发挥着重要作用[1-5]。森林生态系统中可以通过凋落物添加与去除试验(detritus input and removal treatments,DIRT)来研究凋落物对土壤微生物群落的影响以及SOC含量的变化规律[6]。室内培养试验能够控制土壤的温度、水分和pH状况,其结果对今后进行野外试验具有一定的指导和参考价值。
凋落物分解过程中SOC含量与微生物群落的变化特征等内容成为当前森林生态学领域研究的重点内容[7]。研究证明,添加凋落物会增加SOC含量和碳氮比[8-9],但也有研究表明添加凋落物与否,SOC含量并无显著差异[10-11]。土壤微生物群落结构受到凋落物数量和质量的影响,进而影响土壤碳氮循环过程[12]。目前通过DIRT试验研究凋落物数量变化对土壤微生物的影响研究亦有报道[13-14],研究表明凋落物添加与去除处理使土壤微生物群落结构发生显著变化,且土壤真菌、细菌、放线菌的PLFA含量具有显著差异,上述研究未曾针对凋落物的不同添加量与土壤微生物群落结构的关系进行深入探讨。近年来,室内土壤培养实验结合Biolog-ECO技术能够最大限度地保留微生物群落的原有代谢特征[15],是土壤微生物群落的生理特征和功能多样性研究的常见方法[16-20]。
目前学者的研究主要集中在凋落物与土壤养分、土壤微生物的关系方面,但凋落物对土壤微生物群落结构的影响以及土壤微生物群落与有机碳的代谢关系等机制性问题尚不清楚。本研究假设在凋落物输入发生变化时土壤有机碳含量受到土壤微生物群落功能多样性的影响,以雾灵山核桃楸—蒙古栎天然混交林的表层土壤为研究对象,通过去除和添加核桃楸与蒙古栎叶凋落物处理后室内恒温培养并结合Biolog-ECO方法,分析不同凋落物处理下SOC含量和土壤微生物的碳源利用差异,研究凋落物的去除与添加对SOC含量和土壤微生物群落代谢功能多样性的影响,探究不同处理下SOC含量变化的土壤微生物群落代谢机理,为核桃楸—蒙古栎混交林型的可持续经营提供科学依据和实践参考。
1 材料与方法
1.1 供试土壤
本研究的供试土壤为雾灵山国家自然保护区1405—1435 m处的核桃楸—蒙古栎混交林地0—20 cm的表层土壤,土壤类型为粉壤土,土地利用类型为天然混交林,年均温为7.6℃,年降水量763 mm,田间持水量为21.15%。在该林地内设置面积为20 m×15 m的样地,去除表层凋落物后按五点采样法采取0—20 cm的土壤,每个点采集3下,混合成1份,共采集土壤样品5份,带回实验室备用。
1.2 试验设计
为保证室内培养各个处理土样的一致性,故将各点采集的土样混合成一份,去除大型土壤动物、大型植物残体(残枝与根系)和凋落物。分别称取500 g干土的新鲜土壤进行挑除根系(CK)、保留根系(No litter,NL)、保留根系并添加单倍凋落物(Haploid litter,HL)、保留根系并添加双倍凋落物(Double litter,DL)四种处理。将在样地内采集的蒙古栎、核桃楸以及少部分草本植物的叶凋落物剪碎过2 mm筛后添加并与土壤充分混匀,添加标准为2 g/100 g干土,DL加倍。所添加的凋落物为未分解形态凋落物,NL、HL和DL的根系保留量为8—10 g。
处理后,装入1000 mL的培养瓶,各处理重复3次。调节含水量至田间持水量的70%后,置于25℃的培养箱中培养,每3天采用称重法补足缺失的水分,在培养至21 d时进行破坏性采样。为对比室内培养对SOC含量与土壤微生物代谢活性的影响,测定培养开始前的土壤(before cultivation,BC)和培养第21天时土壤的SOC含量及微生物群落的代谢活性(average well color development,AWCD)、Shannon-Wiener多样性指数、Simpson优势度指数、McIntosh均匀度指数、Pielou丰富度指数,测定时均去除土样中的根系与凋落物。
1.3 研究方法
田间持水量采用环刀法测定;土壤有机碳采用重铬酸钾氧化—高温外加热法测定;土壤颗粒组成采用激光粒度分布仪(Bettersize 2000)测定。土壤微生物代谢活性和土壤微生物功能多样性指数采用Biolog-ECO方法,根据温育96 h时在酶标仪所测的吸光度计算求得。
1.4 数据处理
试验数据采用SPSS 25.0和Excel 2019 软件进行处理,采用Origin 8.6绘制图形。采用ANOVA进行方差分析,多重比较利用最小显著差异法(Least-Significant Difference,LSD),文中字母相同代表差异不显著(P>0.05),字母不同代表差异显著(P<0.05)。主成分分析(principal component analysis,PAC)采用降维的方法将不同样本的多元向量变换为互不相关的主元向量进行分析。
2 结果与分析
2.1 土壤有机碳含量的变化特征
从整体上来看,4种不同处理土壤的SOC含量不同:DL的SOC含量最高,CK的SOC含量最低,且随凋落物添加量的变化,SOC含量呈现上升趋势(图1)。
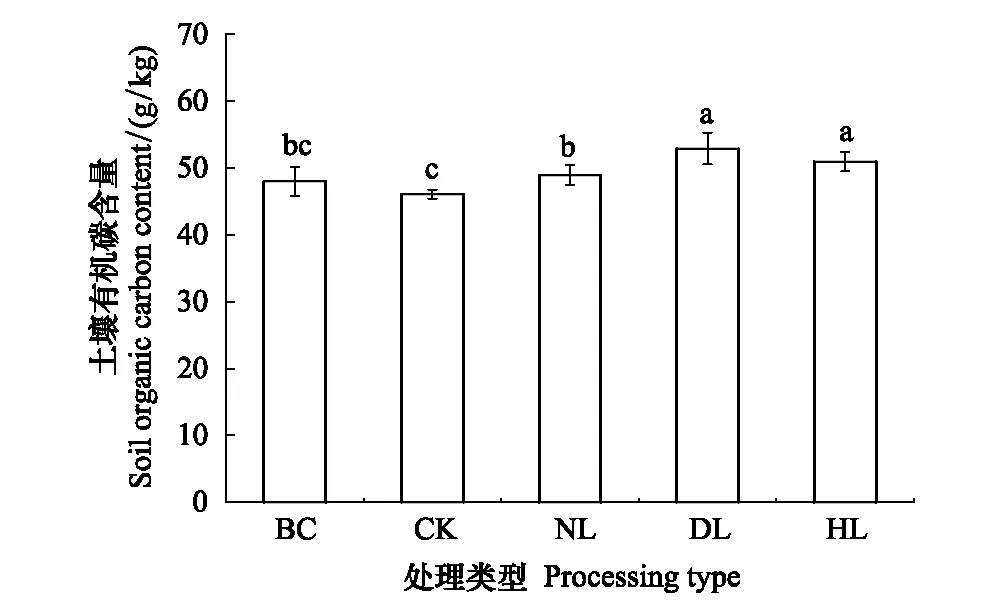
图1 土壤有机碳含量变化特征
添加凋落物对SOC含量具有显著的影响。与培养之前(BC)相比,除CK处理的SOC含量减少了4.15%外,NL、HL、DL处理的SOC含量分别增加了1.88%、5.79%和9.29%;去除凋落物与根系处理的SOC含量并无显著差异(P>0.05),而添加凋落物处理的SOC含量显著升高(P<0.05)。
凋落物的去除与添加对SOC有不同的影响。去除凋落物处理后,是否含有根系也对SOC含量有显著差异,NL处理的SOC含量显著高于CK;而添加凋落物数量的不同没有对SOC含量造成明显影响,HL处理的SOC含量与DL处理无明显差异(P>0.05);添加凋落物处理的SOC含量显著高于去除凋落物处理的土壤(P<0.05)。
2.2 土壤微生物群落代谢活性的变化特征
由图2可以看出,土壤微生物的代谢活性(AWCD值)总体上呈现S型曲线变化,均随培养时间的延长而增加,最终趋向于平稳;温育的前24 h内变化不明显,在24 h后进入迅速增长阶段,且在第48小时时HL和DL对碳源利用的增长速度与利用程度均明显高于BC、CK和NL并在第168小时时出现“拐点”达到最大值。
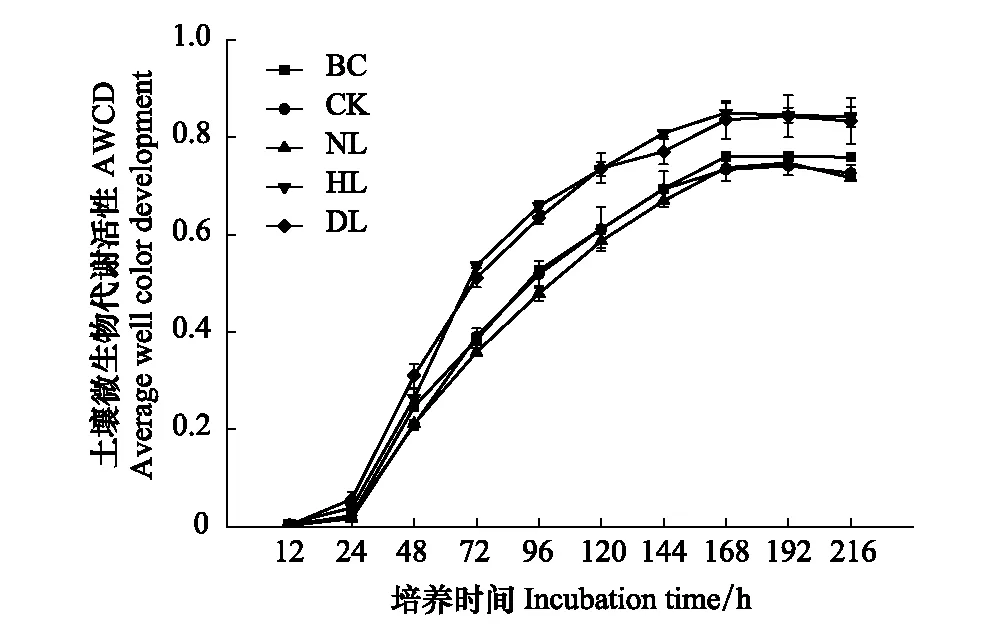
图2 不同凋落物添加处理土壤微生物平均颜色变化率
与BC相比,CK与NL的平均AWCD值在温育第144小时后呈现明显降低,而HL和DL的平均AWCD值则在温育第48 h时显著增加(P<0.05)。经过21 d的培养后,土壤微生物对碳源的利用程度与培养之前有显著的差异,而且不同处理间土壤微生物群落代谢活性差异明显,HL最高,NL最低,表现为HL>DL>CK>NL(表1);在120 h至168 h之间HL处理的AWCD值明显大于DL,而且在168 h以后HL和DL两种凋落物添加处理无明显差异。
2.3 土壤微生物对不同碳源的利用强度
由图3可见,脂类是土壤微生物的主要利用碳源,醇类和碳水化合物类利用最少。与培养之前相比,CK和NL处理的土壤微生物除对胺类的利用显著增加外,对其他碳源的利用均呈现出明显的下降现象,且对醇类的下降显著(P<0.05);而HL和DL处理的土壤微生物对各类碳源的利用均显著增加(P<0.05)。
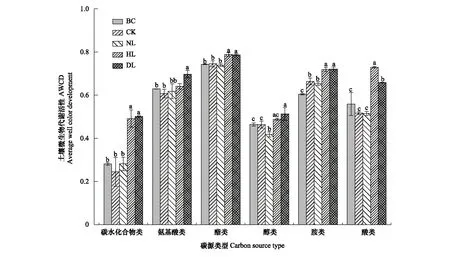
图3 土壤微生物群落对6类碳源的利用程度
室内培养21 d后,4种不同的凋落物处理对碳源的利用上呈现出显著差异。由图3可以看出,土壤微生物对各类碳源的利用均是DL最高,HL和DL大于CK和NL;CK和NL处理下土壤微生物对醇类的利用上差异显著,CK>NL;在氨基酸类和酸类的利用上,HL和DL有显著的差异,DL对氨基酸类的利用显著高于HL,而HL对酸类的利用明显高于DL(P>0.05)。
2.4 土壤微生物群落多样性指数分析
由表1可以看出,与培养之前相比,在温育第96小时时各处理间AWCD值及土壤微生物多样性指数均出现CK和NL处理降低、HL和DL处理升高的现象,HL处理的AWCD值最高,NL最低。CK和NL处理的土壤微生物群落Shannon-Wiener多样性指数和Pielou丰富度指数无明显变化(P>0.05),HL和DL处理则显著增加;CK和NL处理的各多样性指数均较培养之前有所减小,且NL处理的Mcintosh均匀度指数较BC降低显著(P<0.05)。室内培养21 d后,各处理间的多样性指数均有所变化:土壤微生物群落Shannon-Wiener多样性指数、Simpson优势度指数和Pielou丰富度指数与凋落物添加量呈现正相关关系,表现为DL>HL>NL>CK,且DL和HL、NL和CK差异不显著(P>0.05);Mcintosh均匀度指数则不同,各处理之间有显著的差异,表现为HL>DL>NL>CK处理(P<0.05)。
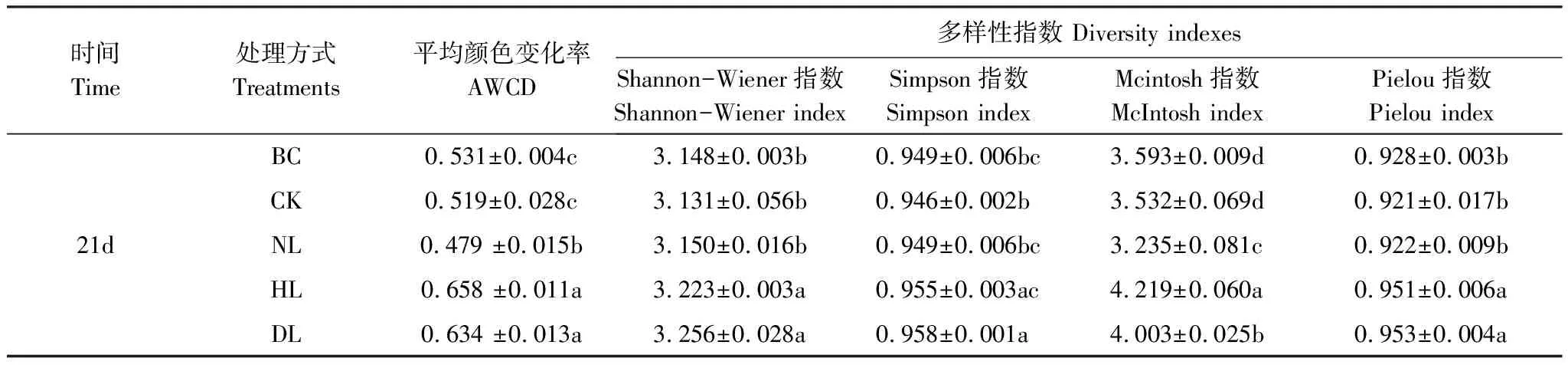
表1 土壤微生物群落AWCD值及多样性指数
2.5 土壤微生物群落代谢功能主成分分析
通过主成分分析,在31种碳源中提取了4个特征值大于1的主成分分子,累计方差贡献率达到99.463%。结合碎石图上的斜率变化从中选取贡献率为74.543%的前两个主成分因子PC1和PC2(贡献率分别为46.956%和27.587%)来分析微生物群落功能多样性(图4)。如图4所示,培养前和4种凋落物处理的土壤在PC1和PC2上分布分散。由于PC1和PC2反映的变异较大,计算得到各处理的得分系数(表2),可以看到培养前后以及不同凋落物处理后综合得分系数差异显著(P<0.05)。
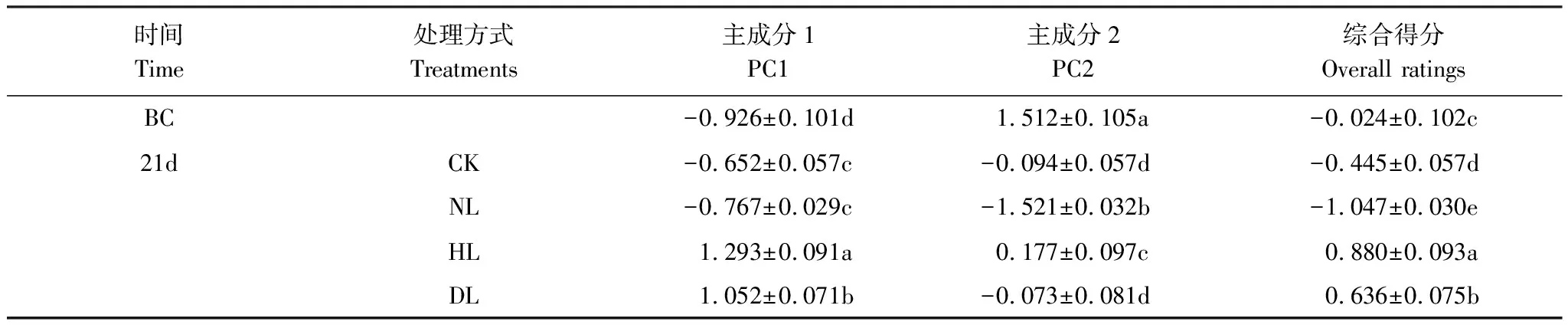
表2 不同凋落物添加处理主成分得分系数
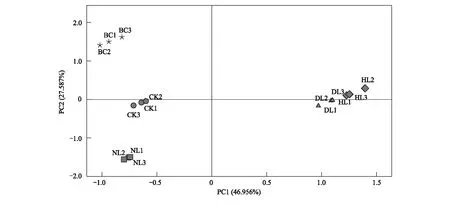
图4 土壤微生物群落功能多样性的主成分分析
将主成分的得分系数与各单一碳源的AWCD值做相关性分析(表3),发现与PC1显著相关性的碳源有22种,其中碳水化合物类6种、氨基酸类3种、醇类2种、胺类3种、酸类5种、酯类3种;与PC2显著相关性的碳源有10种,其中包括碳水化合物类3种、氨基酸类2种、醇类1种、酸类2种、酯类2种。对PC1和PC2起主要作用的分别是碳水化合物类和氨基酸类,因此碳水化合物类和氨基酸类在主成分分离中发挥主要贡献作用。
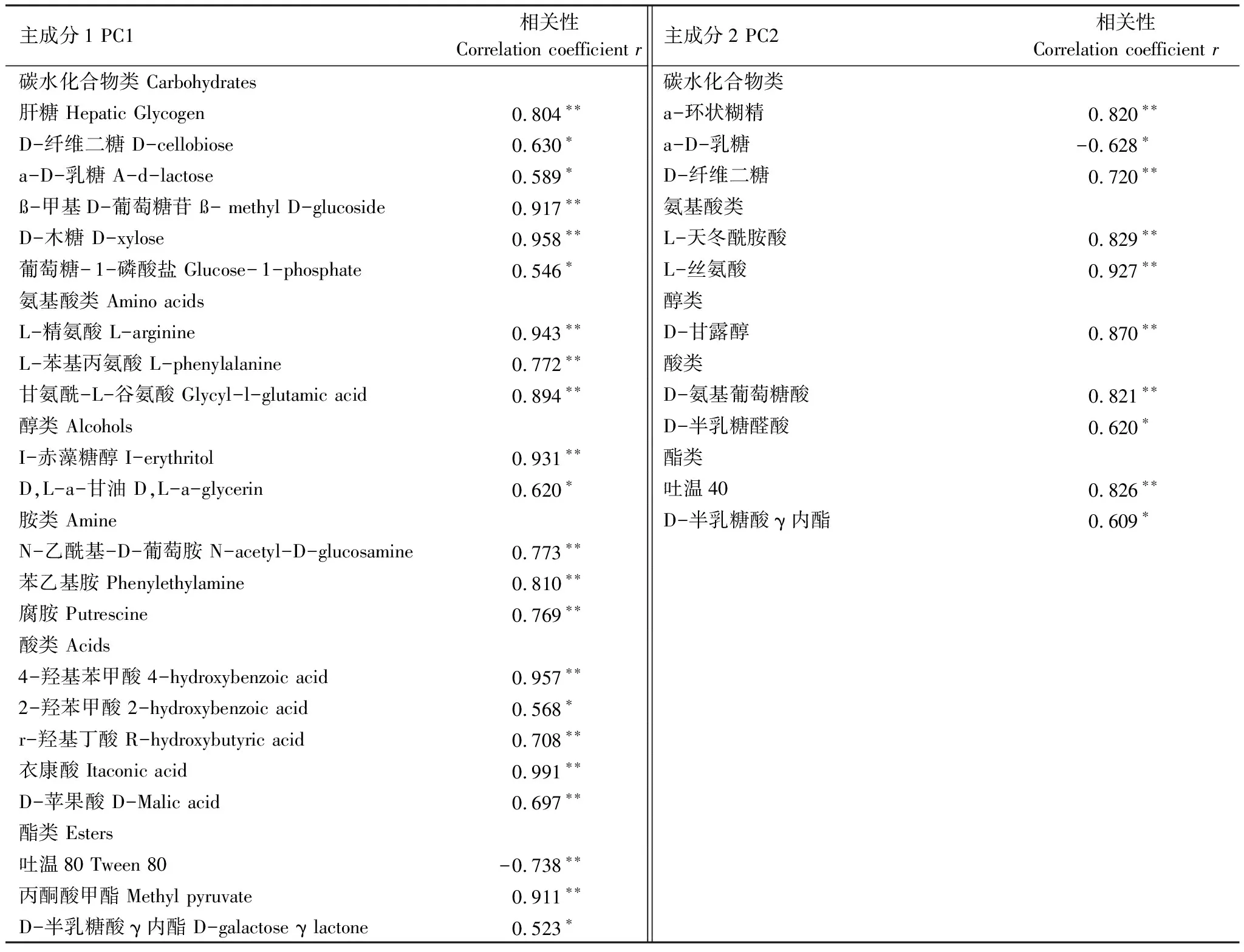
表3 与主成分1和主成分2的相关显著的碳源
2.6 土壤有机碳与土壤微生物多样性的相关性分析
对SOC含量与土壤微生物多样性指数进行相关性分析(表4),由表4可以看出土壤微生物多样性与SOC含量的相关性在0.4—0.6之间,属于中等强度水平,Simpson优势度指数与SOC含量的相关性最高,为0.637。各个土壤微生物多样性指数之间的相关性分析发现,各多样性指数间的相关性水平都较高,土壤微生物McIntosh均匀度指数与AWCD值的相关性最高,其次为Shannon-Wiener多样性指数与Simpson优势度指数,McIntosh均匀度指数与Pielou丰富度指数的相关性最低,为0.902。
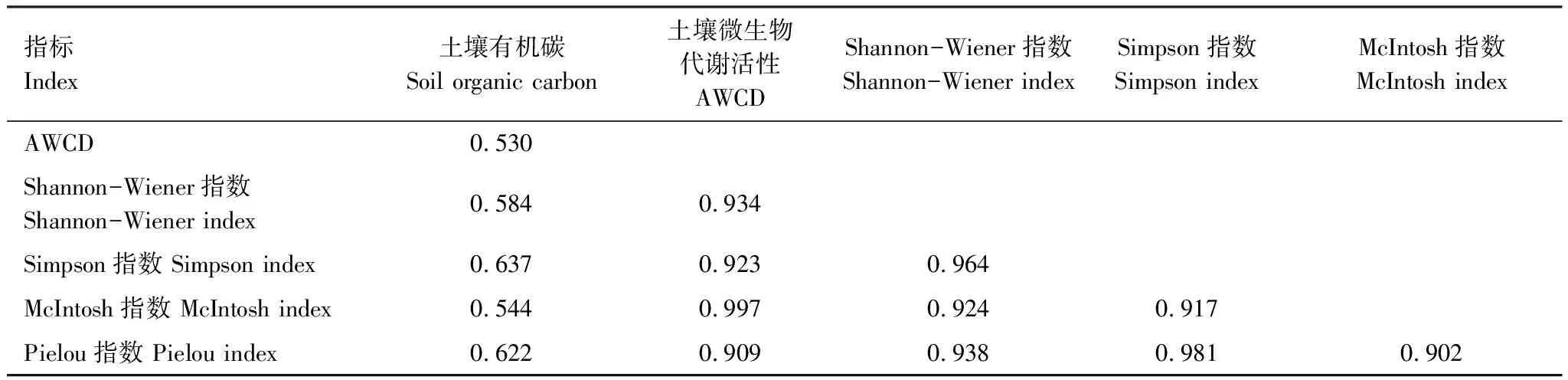
表4 多样性指标与SOC含量的相关性检验
3 讨论
3.1 凋落物输入变化对SOC含量的影响
SOC主要来源于凋落物的分解和积累[21],土壤有机碳库的变化在生态系统中表现为净初级生产力与土壤有机质分解之间的平衡[22],林地的表层土壤是有机质向土壤碳库转移的关键场所,能够表征SOC积累状况。本研究发现:凋落物的加倍添加处理使SOC含量显著增加(图1),这与前人研究结果一致[23-24]。因为凋落物在分解过程中向土壤中释放大量的营养物质,间接提高了SOC的含量[25]。本研究还发现HL处理的SOC含量与DL处理并无显著差异,这与卢胜旭[26]等的研究不一致。说明与添加单倍凋落物相比双倍凋落物的添加在短期内并未对SOC造成更大影响,可能由于凋落物加倍为微生物提供了丰富的底物来源,对土壤有机质产生“正激发效应”,从而提高了微生物对土壤SOC的分解使DL处理与HL处理SOC的差异不显著[27],也有可能是因为一定体积的土壤在短期内只能接受有限的有机质分解。
在浅层土壤内分布着植物细根[28-29],通过分泌有机物质向土壤中输送有机碳[30],对森林生态系统的碳循环具有重要作用,研究发现通过根系周转进入土壤的有机物质是土壤碳库的重要组成部分,如果忽略根系在SOC积累中的作用,则SOC的研究有失全面[31-33]。本研究也发现与BC相比,去除凋落物和根系(CK)后SOC含量降低,而去除凋落物保留根系处理(NL)的SOC含量升高,说明根系存在与否对SOC含量有明显影响,正好印证了这一说法。这是因为不同处理的土壤微生物代谢活性差异明显(图2),与BC相比,培养21 d后CK的SOC含量降低可能是由于去除根系与凋落物后,CK土壤中微生物生存环境发生改变,微生物数量减少,以致于储存在土壤微生物中的SOC含量减少;而NL的SOC含量变化不明显则有可能是因为NL土壤中所保留的根系为土壤微生物的生存提供了必需的营养源,在短期内对土壤微生物数量没有造成明显影响。
3.2 土壤微生物代谢功能对凋落物输入变化的响应
3.2.1对土壤微生物代谢活性的影响
Biolog-ECO方法在土壤微生物功能特征的研究中得到广泛应用,Biolog-ECO板含6大类有31种碳源:碳水化合物类、氨基酸类、酯类、醇类、胺类、酸类。根据Biolog数据计算得出的AWCD值是表征土壤微生物单一碳源利用能力的重要指标,能够反映土壤微生物对碳源的利用程度[34],是表征土壤微生物代谢活性的重要指标。有研究发现土壤微生物的生长存在适应期、对数生长期和稳定期3个阶段[35],本研究中AWCD值呈现S型曲线变化(图2),正好符合该生长规律。如图2所示,土壤微生物在前24 h处于适应期对ECO板的碳源利用很少,而经历了24 h后微生物逐渐适应了ECO板的生存环境,进入快速生长的对数增长期,微生物的代谢活性较为旺盛。AWCD值在48 h后开始出现明显的分化现象,HL和DL的增长速度明显快于CK和NL,微生物进入对数生长期,说明碳源被大量利用,凋落物的添加刺激了土壤微生物的代谢活性。在120 h至168 h之间HL处理的AWCD值明显大于DL这一现象可能是由于过多的添加凋落物在一定程度上对土壤微生物代谢活性具有抑制作用,而且在温育第168 h以后HL和DL的AWCD值无明显差异则体现出双倍凋落物的添加与单倍凋落物添加对土壤微生物代谢活性无显著的影响。
3.2.2对土壤微生物碳源利用的影响
群落代谢功能多样性指数可以反映土壤微生物群落利用碳源类型的差异,即土壤微生物的生态特征。土壤微生物群落功能多样性是评价土壤生态系统稳定性的重要生物学指标,土壤微生物群落物种组成和个体数量分布情况能够通过土壤微生物多样性指数反映出来[36-38]。本研究中不同凋落物添加处理培养后与培养前的土壤微生物相比对单一碳源的利用(图3)以及各多样性指数间(表2)均有较大的差异,四种处理的土壤微生物对碳源种类的利用各有侧重,但DL处理的土壤微生物对各种碳源的利用程度最高,其原因在于凋落物可以为微生物生长提供大量碳源与营养元素,添加量越高,越有利于微生物繁殖[39],说明对土壤进行凋落物的去除与添加处理后土壤微生物群落结构组成发生了显著地变化。由表2可以凋落物的去除与添加处理对土壤微生物群落的均匀度具有显著影响,而凋落物去除处理中,是否存在根系对土壤微生物群落的多样性、丰富度没有显著影响,这与胡凯等[40]的研究不一致,但DL和HL两处理间无显著差异(P>0.05),说明凋落物的含量与土壤微生物多样性呈现正相关关系,但是双倍凋落物的添加在短期内无法达到更为显著的水平,这一现象是否是由于双倍凋落物添加会抑制土壤微生物代谢活性还需做进一步的研究。
3.2.3对土壤微生物群落代谢功能的影响
凋落物作为土壤有机质的重要来源,凋落物输入量变化可通过改变土壤有机碳和养分含量等, 从而影响土壤微生物群落组成[10]。
在主成分分析中,样本之间距离的大小代表样本间相似程度,进而反映样本间微生物群落代谢功能差异的大小,距离越近,对碳源的利用能力越近,代谢功能差异程度越小[41]。采用PCA主成分分析法(PCA)将温育96 h后Biolog-ECO板每个孔的AWCD值转化为几个主成分,可以更好地反映微生物代谢功能特征的变化,用于解释微生物对碳源利用的多样性。通过PCA分析和不同类型碳源利用强度发现,在对土壤进行凋落物去除与添加处理后,土壤微生物对碳源的利用模式具有明显的差异(图4),说明PC1和PC2基本上能够区分培养前后和不同凋落物处理的土壤微生物群落代谢功能的差异,凋落物进入土壤后对土壤微生物的生存环境产生了重要影响,最终导致土壤微生物群落多样性的变化,这与Swift等[42]的研究结果一致。
土壤微生物多样性指数与AWCD值在总体上反映了土壤中微生物群落的变化情况,但不能反映土壤中微生物群落代谢的具体信息[37],还应进一步分析。
3.3 不同处理下SOC含量变化的土壤微生物群落代谢机理
SOC是土壤微生物生命活动的能量来源,对保持土壤的肥力具有重要作用[43]。碳水化合物和氨基酸是土壤中最活跃的有机碳库,是微生物生存的主要碳源[44-45],与微生物活性显著相关[46-47],同时也是微生物细胞的组分或代谢产物[44],约占土壤有机质总量的10%—20%[48],是土壤活性有机碳库的重要组成部分[49],可以指示SOC含量的变化[50]。微生物通过分解SOC获取碳源,以满足微生物自身生长需求[51]。本研究发现,31种碳源中起主要贡献作用的是碳水化合物类和氨基酸类,且通过对SOC含量与土壤微生物多样性指数进行相关性分析(表4)发现,土壤微生物多样性与SOC含量的具有正相关关系,说明凋落物去除与添加处理下土壤微生物群落功能多样性对SOC含量变化具有重要影响。但是本研究的相关性属于中等强度水平,说明凋落物去除与添加处理在短期内并未对SOC含量造成显著的差异。而且室内试验还有一定的局限性,不能完全反映野外的自然状态,将采回的土样过筛破坏了土壤的物理结构,可能引起底物可利用性的增加,造成外源碳的输入对深层土壤SOC含量的影响被低估,未来需进一步研究原位土壤对外源碳输入的响应[52]。
4 结论
凋落物去除与添加对SOC含量和土壤微生物群落功能多样性具有显著影响,但双倍凋落物处理在短期内难以产生显著作用且在一定程度上对土壤微生物的代谢活性具有抑制作用;不同处理的SOC含量与土壤微生物多样性具有正相关关系,且土壤微生物群落功能多样性对SOC含量具有重要影响。因此,未来对核桃楸—蒙古栎天然混交林的管理中应注重对凋落物的利用。

