阿帕替尼一线治疗晚期肝细胞肝癌的疗效及安全性
吴景艳,王彩娥,陈姣,王红霞
河南科技大学第一附属医院临床试验病房,河南 洛阳 471000
肝细胞肝癌是常见的恶性肿瘤,约占原发性肝癌的90%以上,发展迅速,易发生转移,预后较差。肝细胞肝癌的早期临床症状较隐匿,大部分患者确诊时已发展至中晚期阶段,外科手术是其首选治疗方式,但具备手术适应证的患者仅占15%~20%,且术后复发率较高。目前,经导管动脉栓塞化 疗(transcatheter arterialchemoembolization,TACE)是无法行手术切除术治疗的原发性肝癌患者的首选治疗方式之一,但并不能使肿瘤病灶完全坏死,残留肿瘤可通过血管形成并建立侧支循环,导致复发或转移,影响远期疗效。由此可见,对无法进行手术、TACE及经治疗后复发进展的患者进行姑息性治疗有一定的必要性。通过分析肝细胞肝癌的病理分子机制可知,血管内皮生长因子(vascular endothelial growth factor,VEGF)通过调控血管生成从而参与肿瘤发生与发展。阿帕替尼则是一种新型口服小分子抗血管生成药物,能够高度选择性地抑制血管内皮生长因子受体 2(vascular endothelial growth factor receptor 2,VEGFR2)的表达。研究表明,经TACE后,肝癌残余组织细胞中VEGFR2的阳性表达率明显升高,因此,基于阿帕替尼能够选择性抑制VEGFR2表达的药理特点,认为介入术后予以阿帕替尼治疗可增强抗肿瘤效果。基于此,本研究收集了60例晚期肝细胞肝癌患者的临床资料,旨在探讨阿帕替尼一线治疗肝细胞肝癌的疗效及对患者血清肿瘤标志物水平的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2018年1月河南科技大学第一附属医院收治的晚期肝细胞肝癌患者的临床资料。纳入标准:符合《原发性肝癌诊疗规范(2017年版)》中的相关诊断标准,经病理检查确诊为肝细胞肝癌;巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期为 C 期;肝功能 Child-Pugh分级为A级或B级;卡氏功能状态评分>60分;接受TACE治疗;临床及随访资料完整。排除标准:既往接受过化疗;有化疗、药物禁忌证;合并其他恶性肿瘤;生存期不足3个月;有感染史或手术史;合并严重的凝血功能障碍;存在大量腹腔积液;合并自身免疫系统疾病;合并严重的全身性疾病;存在门静脉瘘、肝静脉瘘及门静脉主干或左、右主干癌栓;妊娠期或哺乳期妇女;合并心、肾等重要器官严重功能不全。根据纳入和排除标准,共纳入60例晚期肝细胞肝癌患者,依据治疗方式的不同分为阿帕替尼组(n=36)和常规组(n=24)。阿帕替尼组中,男25例,女11例;年龄38~68岁,平均(46.91±7.02)岁;Child-Pugh分级:A级20例,B级16例;卡氏功能状态评分68~80分,平均(74.31±5.69)分;病因:乙型肝炎19例,酒精性脂肪肝13例,其他4例。常规组中,男19例,女5例;年龄36~69岁,平均(47.23±7.31)岁;Child-Pugh分级:A级15例,B级9例;卡氏功能状态评分70~82分,平均(75.08±6.32)分;病因:乙型肝炎15例,酒精性脂肪肝8例,其他1例。两组患者的性别、年龄、Child-Pugh分级、卡氏功能状态评分等临床特征比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者均接受常规影像学检查以明确肿瘤的位置、大小,并行常规实验室检查。常规组患者接受TACE治疗,并进行止吐、保肝、抑酸等常规处理。TACE治疗的具体方法:患者取平卧位,碘伏常规消毒,采用Seldinger法行股动脉穿刺,插入导管成功后进行肝动脉造影,明确肿瘤位置,然后在肿瘤供血动脉处插入微导管,经导管灌注表柔比星40 mg,再经微导管注入碘化油3~5 ml进行栓塞。
阿帕替尼组在常规组的治疗基础上接受阿帕替尼口服治疗。于TACE后第3天开始服用阿帕替尼(每次500 mg,每日1次),服用4周后进行CT、MRI复查,若影像学检查提示肿瘤存在明显血供,依据情况可追加TACE,TACE治疗前后3天停用阿帕替尼。患者在治疗过程中若出现3级或3级以上严重不良反应时,可酌情减少阿帕替尼剂量为250 mg,28天为1个治疗周期,患者治疗3个周期后评估临床疗效。
1.3 观察指标
1.3.1 近期疗效 通过增强MRI结合CT评估两组患者治疗3个周期后的病灶控制情况,依据改良实体瘤疗效评价标准进行疗效评价:①完全缓解(CR)。所有靶病灶均无动脉期增强;②部分缓解(PR):靶病灶增强扫描动脉期的直径总和缩小≥30%;③疾病稳定(SD):靶病灶的缩小程度未达到PR标准,且增大程度未达到PD标准;④疾病进展(PD):靶病灶增强扫描动脉期的直径增大≥20%或有新的肿瘤灶出现。总有效率=(CR+PR)例数/总例数×100%。
1.3.2 血清肿瘤标志物水平 治疗前及治疗3个周期后,于清晨采集两组患者空腹静脉采血3~5 ml,以3000 r/min(离心半径15 cm)的速度离心10 min后收集血清,并于-20℃低温保存。采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测两组患者的血清热休克蛋白90α(heat shock protein 90 alpha,HSP90α)、甲胎蛋白(alphafetoprotein,AFP)水平。
1.3.3 不良反应发生情况 治疗期间,常规监测两组患者的血常规、尿常规、肝功能、肾功能、凝血功能、心电图等。依据美国国家癌症研究所(National Cancer Institute,NCI)制定的常见不良事件评价标 准(common terminology criteria for adverse event,CTCAE)4.0 版评价并比较两组患者的不良反应发生情况,将不良反应分为1级(轻度)、2级(中度)、3级(严重,有医学意义但是不危及生命)、4级(危及生命)、5级(死亡)。
1.3.4 生存情况 采用电话、门诊、走访等形式对两组患者术后进行了至少1年的随访,每个月随访1次,以患者死亡或随访截止时间为随访终点。比较两组患者的生存情况。
1.4 统计学方法
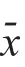
2 结果
2.1 近期疗效的比较
阿帕替尼组患者的有效率为63.89%(23/36),高于常规组患者的37.50%(9/24),差异有统计学意义(χ
=4.029,P
<0.05)。(表1)
表1 两组患者的近期疗效
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者的血清HSP90α、AFP水平比较,差异均无统计学意义(P
>0.05);治疗后,两组患者的血清HSP90α、AFP水平均低于本组治疗前,差异均有统计学意义(P
<0.05)。治疗后,阿帕替尼组患者的血清HSP90α、AFP水平均低于常规组患者,差异均有统计学意义(t
=2.029、4.711,P
<0.05)。(表 2)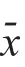
表2 两组患者治疗前后血清肿瘤标志物水平的比较(ng/ml,±s)
2.3 不良反应发生情况的比较
两组患者血常规、尿常规、肝功能、肾功能、凝血功能、心电图等常规检查结果均未见明显异常。两组患者均发生了≥3级的不良反应,阿帕替尼组中,治疗相关高血压5例,蛋白尿3例,腹泻3例,手足综合征2例;常规组中,治疗相关高血压3例,蛋白尿2例,腹泻2例,手足综合征1例。阿帕替尼组患者≥3级不良反应的总发生率为36.11%(13/36),常规组患者≥3级不良反应的总发生率为33.33%(8/24)。两组患者≥3级不良反应的总发生率比较,差异无统计学意义(P
>0.05)。2.4 生存情况的比较
截至随访结束,阿帕替尼组患者的中位生存时间为12个月(95%CI:10.29~13.71个月),长于常规组患者的10个月(95%CI:8.65~10.69个月),差异有统计学意义(Z
=-2.322,P
<0.05)。阿帕替尼组患者的1年生存率为72.22%(26/36),高于常规组患者的41.67%(10/24),差异有统计学意义(χ
=5.602,P
<0.05)。3 讨论
原发性肝癌具有发病隐匿、恶性程度较高、治疗困难、生存周期短、预后较差等特点,是世界公认最严重的恶性肿瘤之一,手术切除或TACE能够阻断肝癌细胞的血供,残癌组织能够在多种作用机制下调控VEGFR2等血管生成因子的表达,因此,以VEGFR2为重要靶点的分子靶向治疗成为临床关注的重点。阿帕替尼是一种抗血管生成小分子药物,其主要作用靶点为VEGF受体,通过抑制VEGF与受体结合阻断VEGF/VEGFR2通路活化,从而减少血管内皮细胞的增殖与迁移,抑制肿瘤血管生成,有效降低肿瘤微血管密度,发挥抗肿瘤作用;同时,阿帕替尼还可通过直接抑制肿瘤细胞的增殖从而发挥抗肿瘤作用;与传统抗肿瘤药物相比,阿帕替尼可减少肿瘤细胞对化疗药物的耐药性。既往相关研究指出,TACE后联合运用阿帕替尼治疗中晚期原发性肝癌能够明显提高患者的生存获益,降低血清肿瘤标志物水平,具有较好的抗肿瘤效果。
本研究将60例肝细胞肝癌患者依据治疗方式的不同分为阿帕替尼组与常规组,常规组患者接受TACE治疗,阿帕替尼组在TACE后配合服用阿帕替尼,结果显示,阿帕替尼组的总有效率高于常规组,提示在TACE治疗的基础上联合阿帕替尼能够提高近期疗效,控制病情的稳定,虽然仍有部分患者的近期疗效未达到CR或PR,但患者的血清肿瘤标志物水平均有所下降,且生存时间有所延长。恶性肿瘤属于慢性疾病,带瘤生存亦被临床与学术界所认可,上述研究结果提示,阿帕替尼对晚期肝细胞肝癌具有一定的治疗意义,其并非仅是简单地杀死肿瘤细胞,而是有效控制肿瘤细胞的恶性增殖,延长患者的生存期。
HSP90α对于生理、病理及应激状态下的细胞的正常生理作用具有重要的维持作用。研究证实,HSP90α还可表达于细胞表面,并分泌至细胞外发挥作用;分泌型HSP90α可在肿瘤患者的血液中被检测到,其水平与肿瘤恶性程度呈明显正相关;HSP90α与肝癌细胞的侵袭、转移及微血管浸润等密切相关。AFP为肝癌相关特异性肿瘤标志物,是临床常用的实验室指标。研究指出,肝癌患者的AFP水平明显高于正常人,推测其与肿瘤的发生、发展均具有一定的联系。因此,HSP90α、AFP是评估肝癌患者病情严重程度及疾病转归的重要血清标志物。本研究中,两组患者治疗后的HSP90α、AFP水平均低于本组治疗前,说明TACE治疗肝细胞肝癌及联合阿帕替尼治疗肝细胞肝癌均具有一定的疗效,能够改善血清肿瘤标志物水平,但阿帕替尼组的临床效果更优,提示TACE联合阿帕替尼能够抑制肿瘤生长,控制病情恶性发展。
本研究通过比较两组患者的生存情况发现,阿帕替尼组患者的中位生存时间长于常规组患者,1年生存率高于常规组患者(P<0.05),提示阿帕替尼治疗晚期肝癌具有良好的远期疗效,与其他抗肿瘤手段结合能够提高患者的生存获益。研究表明,51例口服750 mg阿帕替尼的晚期肝癌患者的中位生存期为9.8个月,70例口服850 mg阿帕替尼的晚期肝癌患者的中位生存期为4.2个月,而本研究阿帕替尼组患者口服500 mg阿帕替尼,中位生存期较长,对比上述研究结果,生存优势更加明显,且用药剂量更小,认为可能原因为本研究纳入的样本量较少,且采取联合治疗的方式。
本研究中,两组患者的3级以上不良反应主要包括治疗相关高血压、蛋白尿、腹泻和手足综合征,均是抗血管生成药物的常见不良反应,多于3个月后出现,可通过停药或减少剂量缓解症状,说明大多数不良反应是一过性或可逆的,在临床可控范围内。两组患者的不良反应发生情况并无显著差异,提示阿帕替尼的运用安全、可靠,不会明显增加非预期不良反应。
综上所述,阿帕替尼配合其他治疗手段能够提高晚期肝细胞肝癌患者的临床疗效,降低血清肿瘤标志物水平,提高生存获益,且安全可靠,不会明显增加不可预期不良反应。但本研究仍存在不足之处,对于阿帕替尼服用的最佳剂量并未进行研究,且随访时间过短,纳入的样本量较少,还有待进一步深入分析。

