PD-1 抑制剂联合FOLFOX4 化疗方案治疗晚期胃癌的效果
郑桂丽 梁秀菊 董 敏 时延龙 魏 炎 仲 晨
中国人民解放军联勤保障部队第九六〇医院肿瘤科,山东济南 250031
胃癌是起源于胃黏膜上皮的恶性肿瘤,发病率极高[1]。近年来,人们生活方式、饮食品类等不断变化,胃癌的患者愈加频发,且有年轻化的趋势[2]。胃癌早期症状无特异性,不少患者因明显症状入院就诊时已到达疾病晚期。而针对晚期胃癌患者,治愈已成为不可实现的目标,临床主要的治疗目标在于最大程度延长患者生存期[3]。放化疗是治疗晚期胃癌的主要方式,奥沙利铂和5-氟尿嘧啶(FOLFOX4)化疗是胃癌患者的首选化疗方案,但由于奥沙利铂、5-氟尿嘧啶等化疗药物对肿瘤细胞定向选择性偏低,在化疗时易对人体正常细胞造成损害,降低其化疗依从性,甚至放弃化疗,从而缩短生存期[4]。PD-1 抑制剂是免疫哨点单抗药物,其在黑素瘤和非小细胞肺癌的治疗效果已得到证实[5]。而有关于其辅助治疗晚期胃癌的疗效尚需进一步证实。本研究通过探讨PD-1 抑制剂联合FOLFOX4 化疗方案治疗晚期胃癌的效果,旨在为临床治疗提供指导。
1 资料与方法
1.1 一般资料
选取2016 年2 月—2019 年5 月中国人民解放军联勤保障部队第九六〇医院(以下简称“我院”)收治的80 例晚期胃癌患者为研究对象。纳入标准:①知情并签署相关同意书;②经胃镜活检、B 超、CT 及病理学检查确诊;③胃癌诊断标准参考《中国抗癌协会乳腺癌诊治指南与规范》[6];④各项生命体征平稳,意识清楚;⑤卡氏功能状态评分(KPS)[7]>60 分,预计生存期≥3 个月;⑥初诊。排除标准:①严重造血系统疾病;②严重感染、免疫性、内分泌疾病;③精神障碍无法正常沟通;④妊娠或哺乳期妇女。
依据随机数字表法将患者分为两组,研究组(40 例)男24 例,女16 例;年龄43~78 岁,平均(62.17±5.23)岁;KPS(72.49±4.82)分;肿瘤直径(4.06±0.38)cm;组织学类型:高分化8 例,中分化14 例,低分化18 例。对照组(40 例)男26 例,女14 例;年龄41~79 岁,平均(62.59±4.38)岁;KPS(72.81±3.64)分;肿瘤直径(3.87±0.41)cm;组织学类型:高分化12 例,中分化12 例,低分化16 例。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性。本研究经我院医学伦理委员会批准。
1.2 方法
两组同时给予FOLFOX4 化疗:5-氟尿嘧啶(上海旭东海普药业有限公司,规格:0.25 g/支,10 mL,生产批号:20160120)0.5 g,500 mL 5%葡萄糖溶液溶解,400 mg/m2,静脉滴注,d1;奥沙利铂(齐鲁制药,规格:0.1 g/支,生产批号:20151207)0.1 g 与甘露醇5.1 g,250 mL 5%葡萄糖溶液溶解,85 mg/m2,静脉滴注,d1;随后5-氟尿嘧啶持续静注46 h。研究组在对照组的基础上联合PD-1 抑制剂(江苏恒瑞医药股份有限公司,生产批号:20160214,规格:5 mg/瓶)治疗,2 mg/kg,静脉滴注,d1。21 d 为1 个疗程,连续治疗6 个疗程。化疗期间常规应用保胃、止吐药物。
1.3 观察指标
①治疗前后,早上抽取8 mL 空腹肘静脉血,3000 r/min 离心16 min,离心半径为15 cm,分离上清液保存待检。采用酶联免疫吸附试验检测血清糖类抗原(CA)125、癌胚抗原(CEA)、CA199 水平,相关试剂盒购自上海桑戈生物科技有限公司,生产批号:20151124,20160117。采用流式细胞仪(美国BD 公司,Fascalibur 型)分析T 淋巴细胞亚群:CD3+、CD4+、CD8+比例,并计算CD4+/CD8+。②记录两组治疗6 个疗程后的临床疗效。③记录不良反应情况发生情况。
1.4 疗效判定标准
发现新病灶为疾病进展;肿瘤直径缩小<40%或无变化为疾病稳定;40%≤肿瘤直径缩小≤70%,且持续时间≥28 d 为部分缓解;肿瘤直径缩小>70%,且持续时间≥28 d 为完全缓解[8]。总有效率=(完全缓解+部分缓解)例数/总例数×100%。
1.5 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
研究组总有效率高于对照组(P <0.05)。见表1。
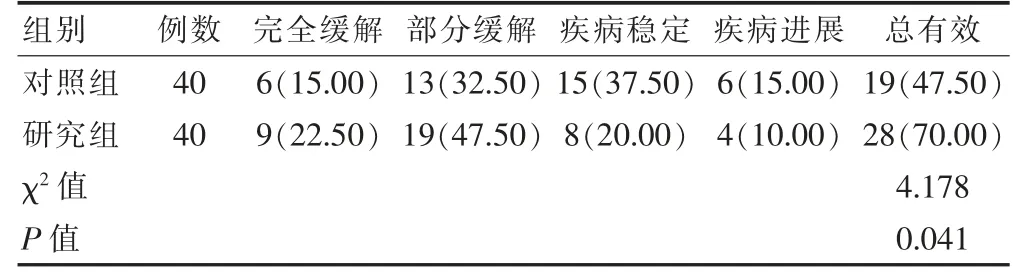
表1 两组临床疗效比较[例(%)]
2.2 两组血清肿瘤标志物比较
治疗前,两组CEA、CA125、CA199 水平比较,差异无统计学意义(P >0.05)。治疗后,两组CEA、CA125、CA199 低于治疗前,且研究组低于对照组(P <0.05)。见表2。
2.3 两组免疫功能指标比较
治疗前,CD3+、CD4+、CD8+、CD4+/CD8+比较,差异无统计学意义(P >0.05)。治疗后,两组CD3+、CD4+、CD4+/CD8+水平低于治疗前,CD8+高于治疗前;研究组CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P <0.05)。见表3。
2.4 两组不良反应发生情况比较
治疗期间,对照组出现肝功能异常、白细胞减少、骨髓抑制各1 例,神经毒性、恶心呕吐各2 例,不良反应发生率为17.50%(7/40);研究组治疗期间出现神经毒性2 例,白细胞减少、骨髓抑制各1 例,不良反应发生率为12.50%(5/40)。两组不良反应发生率比较,差异无统计学意义(χ2=0.392,P=0.531)。
表2 两组血清肿瘤标志物比较()
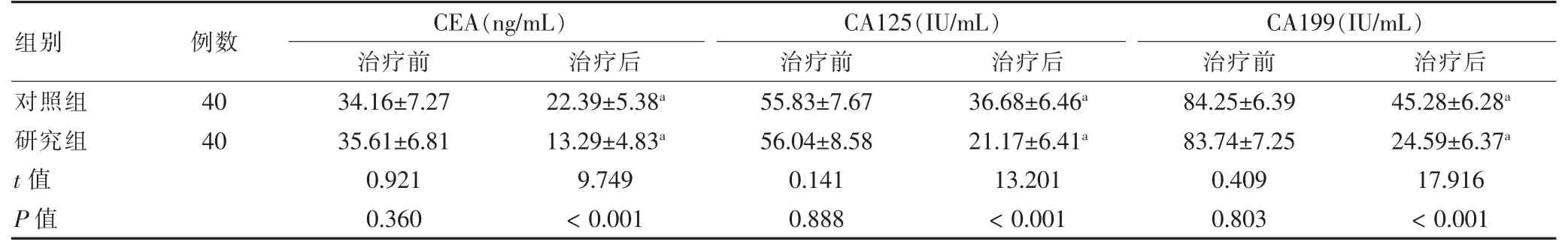
表2 两组血清肿瘤标志物比较()
注:与本组治疗前比较,aP <0.05。CEA:癌胚抗原;CA:糖类抗原
表3 两组免疫功能指标比较()
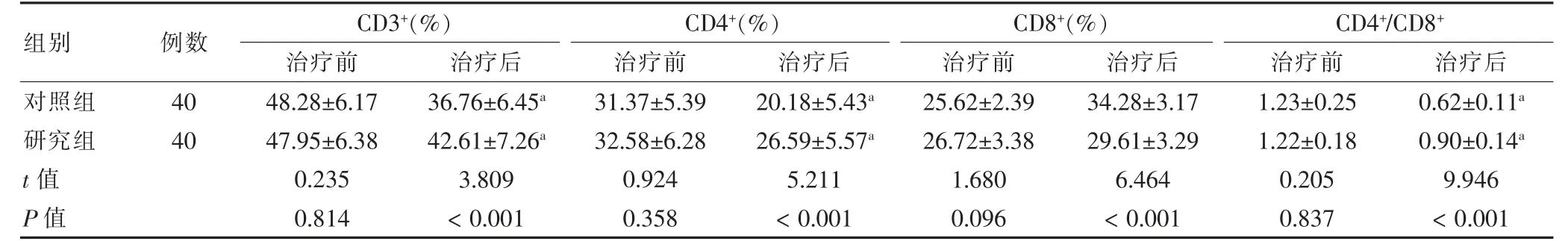
表3 两组免疫功能指标比较()
注:与本组治疗前比较,aP <0.05
3 讨论
胃癌因症状极其隐匿,多数为晚期胃癌患者,此时通过化疗可控制患者病灶转移,更好地改善患者预后。由于癌细胞扩散,晚期胃癌患者大部分已经发生转移,预后生存较差,而抗肿瘤药物可以清除残余肿瘤细胞,加快癌细胞凋亡,阻止细胞进一步增殖转移,因此化疗延长患者生存时间[9]。FOLFOX4 化疗方案作为胃癌的常见治疗方案,其中奥沙利铂通过产生水化衍生物作用于DNA,形成链内和链间交联,明显抑制各类肿瘤细胞;5-氟尿嘧啶可诱导细胞进入S期,与奥沙利铂发挥协同抗癌作用,从而降低肿瘤负荷。尽管FOLFOX4 化疗方案可改善患者预后,但前期副作用极其明显,部分患者可因副作用大而停止化疗,降低患者治疗依从性[10-13]。此外,化疗药物还可杀灭患者正常组织细胞,引起机体免疫抑制,患者免疫力下降,不仅不利于身体素质的改善,同时弱化机体对肿瘤细胞的杀伤力,影响最终治疗效果[14-15]。因此,寻找合适的方法促进化疗顺利进行具有积极的临床意义。
在肿瘤免疫中,免疫系统可识别并清除肿瘤细胞从而阻止癌症疾病进展。但由于肿瘤细胞可通过免疫逃逸而避免免疫系统的识别和杀伤,从而发展为恶性增殖。肿瘤细胞恶性增殖时期,其可通过不断改变抗原表型而逃脱免疫监视,随后通过肿瘤微环境中多种免疫抑制、免疫抑制因子来抑制抗肿瘤免疫反应,形成免疫逃逸[16]。鉴于此理论学说,学者们开始尝试研制与应用免疫检查点抑制剂。PD-1 为T 细胞表面的主要抑制性分子,在免疫应答的负性调控中发挥重要作用。在细胞[17]及动物实验[18]中均证实肿瘤微环境可诱导肿瘤表面PD-1 的表达,且PD-1 的表达可诱导抗肿瘤T 细胞凋亡。PD-1 抑制剂作为临床常见的免疫检查点抑制剂,诱导并增强抗肿瘤免疫反应。
本研究结果显示,研究组临床总有效率更高,且研究组的免疫抑制程度较对照组更轻,提示PD-1 抑制剂联合FOLFOX4 化疗方案治疗晚期胃癌,疗效显著,可促进化疗的顺利进行。CA125、CA199 在多种消化道肿瘤的发生发展中呈高水平表达,CEA 在多种恶性肿瘤组织中均有表达,随着肿瘤疾病的进展,其在肿瘤组织中表达亦明显增加[19-22]。本研究中两组血清肿瘤指标水平均有所改善,且研究组的改善效果更佳,考虑与PD-1 抑制剂可更好地减轻机体免疫抑制,增强抗肿瘤免疫反应,有效阻止疾病进展有关[23-26]。另外,两组治疗期间不良反应发生率比较,差异无统计学意义(P >0.05),提示PD-1 抑制剂联合FOLFOX4化疗方案治疗安全可靠[27]。
综上所述,PD-1 抑制剂与FOLFOX4 化疗方案联合治疗晚期胃癌疗效确切,可阻止肿瘤扩散,减轻免疫抑制,安全有效。

