基于Hedgehog信号通路的熊果酸诱导结直肠癌SW480细胞凋亡的机制研究
张 梦,何 曼,孙 强,陈 莉,曾 沙,赵 晖,杨 寒,刘茂伦,任 珊,徐海波
基于Hedgehog信号通路的熊果酸诱导结直肠癌SW480细胞凋亡的机制研究
张 梦,何 曼,孙 强,陈 莉,曾 沙,赵 晖,杨 寒,刘茂伦,任 珊,徐海波*
成都中医药大学药学院 药理系,四川 成都 611137
研究熊果酸通过经典Hedgehog信号通路影响人结直肠癌SW480细胞增殖和凋亡的作用及其机制。通过显微镜观察熊果酸对SW480细胞形态的影响;采用MTT比色法检测熊果酸对细胞活力的影响;细胞划痕实验检测熊果酸对细胞迁移的影响;Hoechest/PI染色法观察熊果酸对细胞凋亡的影响;荧光探针法检测熊果酸对细胞线粒体膜电位的影响;Caspase活性检测试剂盒检测熊果酸对细胞凋亡相关因子Caspase-3、Caspase-9的影响;蛋白免疫印迹法检测Hedgehog信号通路相关蛋白SHh、Gli1、Ptch1、Smo、c-Myc、SuFu及细胞凋亡相关蛋白Bax、Bcl-2的表达水平。SW480细胞经熊果酸给药后形态发生改变;细胞迁移能力显著下降;线粒体膜电位降低;细胞核出现致密浓染;Caspase-3、Caspase-9活性升高;SW480细胞发生凋亡;Hedgehog信号通路相关蛋白SuFu的表达水平升高,SHh、Gli1、Ptch1、Smo、c-Myc的表达水平下降;细胞凋亡相关蛋白Bax的表达水平升高,Bcl-2的表达水平下降。熊果酸对SW480细胞的生长、增殖具有抑制作用,通过抑制Hedgehog信号通路的激活促进SW480细胞凋亡。
熊果酸;Hedgehog信号通路;人结直肠癌SW480细胞;细胞增殖;细胞凋亡
随着现代生活水平的提高,结直肠癌的发病率逐年上升,其中在发达国家上升趋势尤为显著。结直肠癌常见于老年群体,但近年来逐渐趋向年轻化,在年轻人中的死亡率逐年上升[1-2]。临床治疗结直肠癌的方法包括手术、放疗、化疗等,现代治疗多根据结直肠癌靶点、异质性和耐药性等特点采取广谱疗法。目前结直肠癌临床治疗的常用药物如贝伐单抗、卡培他滨、5-氟尿嘧啶、奥沙利铂等都已有较为深入的开发和应用[3-5],尽管国内外均对结直肠癌的预防和治疗有大量的研究报道,为临床众多结直肠癌患者带来福音,但对其分子机制和治疗靶点的研究有待深入。
熊果酸是一类具有显著生物活性的五环三萜类化合物,广泛存在于多种水果、蔬菜中,同时也是中药材白花蛇舌草、冬凌草、木瓜、夏枯草等的主要活性成分[6-9],具有抗肿瘤、抗炎、抗氧化、抗菌、抗病毒、抗诱变等药理活性[10-11]。目前已有大量关于熊果酸抗癌机制报道,包括结直肠癌、乳腺癌、肺癌、宫颈癌、皮肤癌[12-16]等。Hedgehog信号通路近年来被发现参与多种肿瘤的发生、发展、转移和耐药性阶段[17],然而未见有关于熊果酸通过Hedgehog信号通路抑制结直肠癌的研究,因此本研究以人结直肠肿瘤SW480细胞为模型,检测熊果酸对细胞生长、增殖、迁移及细胞凋亡方面的影响,初步探索熊果酸通过Hedgehog信号通路对结直肠癌的作用效果,为临床结直肠癌的治疗提供更多的用药选择和实验数据基础。
1 材料
1.1 细胞与药物
人结直肠癌SW480细胞购自中国科学院上海细胞生物学研究所;熊果酸(质量分数>98%,批号MUST-18072310),购自成都曼斯特生物科技有限公司,Hedgehog信号通路抑制剂GANT-61(C27H35N5,质量分数>98%,批号#21798),购自美国Med Chem Express(MCE)公司。
1.2 试剂
DMEM低糖细胞培养基(批号SLBT7314),美国Sigma公司;磷酸盐缓冲液(PBS,批号121D039)、胰蛋白酶(批号HJ202410)、青霉素链霉素双抗(批号HJ202605),索莱宝科技有限公司;胎牛血清(批号20180524),赛澳美细胞技术有限公司;抗荧光淬灭封片液(含Hoechst33324和碘化丙啶(propidium iodide,PI,批号121818191028)、线粒体膜电位检测试剂盒(批号100918190307)、BCA蛋白浓度测定试剂盒(批号P1002)、Bradford蛋白浓度测定试剂盒(批号P0006)、MTT试剂盒(批号C0009-2)、半胱氨酸蛋白酶-3(Caspase-3)活性检测试剂盒(批号071018190123)、半胱氨酸蛋白酶-3(Caspase-9)活性检测试剂盒(批号060618200415),碧云天科技有限公司;Hedgehog信号通路相关抗体、音猬因子(sonic hedgehog,SHh)、GLI家族锌指蛋白1(GLI family zinc finger protein 1,Gli1)、G蛋白偶联受体蛋白(smoothened,Smo)、原癌基因蛋白(cellular-myelocytomatosis viral oncogene,c-Myc)、苏氨酸蛋白激酶Fused抑制因子(suppressor of Fused,SuFu),武汉三鹰生物技术有限公司;表面受体(Patched,Ptch1),美国Immunoway公司。细胞凋亡相关抗体:B细胞淋巴瘤/白血病-2蛋白(B-cell lymphoma-2,Bcl-2),美国Immunoway公司;Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax),武汉三鹰生物技术有限公司。内参抗体:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、山羊抗兔IgG二抗,杭州联科生物技术股份有限公司。
1.3 仪器
3001多功能酶标仪(美国Thermo公司);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司);DMI3000B倒置显微镜、SP8 SR激光共聚焦显微镜(德国Leica公司);QUOTQTION电泳仪、化学发光凝胶成像系统(美国Bio-Rad公司)Forma3111CO2培养箱(美国Thermo公司);AllegraX®-12series离心机(美国BECK MAN Coulter);CYT5MFV微孔板成像系统(美国BioTek公司)。
2 方法
2.1 细胞培养
SW480细胞用含有10%胎牛血清和1%青霉素和链霉素的DMEM培养基培养,放置于37 ℃、5% CO2的环境中。根据细胞生长情况,2~3 d更换新鲜培养基,待细胞生长面积达80%~90%时,按1∶2比例进行传代,传至第5代后部分用于保存,部分用于后续实验。
2.2 光学显微镜下观察细胞生长、细胞形态
取出处于对数生长期的SW480细胞,经胰蛋白酶消化并收集细胞后,以1.0×105个/mL的细胞密度,500 μL/孔的体积接种于24孔细胞培养板中,培养12 h待细胞贴壁后,对照组更换含0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换GANT-61(20 μmol/L)的培养基(100 μL/孔)处理细胞,继续培养24 h后,于微孔板成像系统中观察记录细胞生长情况和细胞形态。
2.3 MTT比色法检测细胞增殖
采用“2.2”项方法处理细胞,以1.0×104个/mL的细胞密度,100 μL/孔的体积接种于96孔细胞培养板中,培养12 h待细胞贴壁后,对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20、40、60、80、100、120、140 μmol/L)熊果酸的培养基(100 μL/孔)处理细胞,继续培养24 h后,更换含5 mg/mL MTT的培养基(100 μL/孔)处理细胞,继续培养24 h后,更换含5 mg/mL MTT的培养基(100 μL/孔)处理细胞,继续培养4 h后,更换DMSO(150 μL/孔)处理细胞结晶,振荡10~15 min,待结晶物充分溶解后,在酶标仪中测定波长570 nm下的吸光度()值,并计算细胞存活率。
细胞存活率=药物/对照
2.4 划痕实验检测细胞迁移能力
采用“2.2”项方法处理细胞,以1.0×106个/mL的细胞密度,500 μL/孔的体积接种于24孔细胞培养板中,培养12 h待细胞高密度贴壁后,手持移液器,使枪尖垂直于培养板底部,水平划线。然后对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换含GANT-61(20 μmol/L)的培养基(100 μL/孔)处理细胞,在加药后0、12、24 h时间点于显微镜下观察并记录细胞划痕的愈合情况。各组细胞不同时间点的划痕面积采用Image J软件统计,以对照组(0 h)的划痕面积为基准,计算相对划痕面积。
2.5 Hoechest/PI染色法观察细胞凋亡
在细胞发生凋亡的初期阶段,细胞膜还未破损,但细胞核染色质开始固缩,因此通过Hoechst/PI染色观察初期细胞凋亡。采用“2.2”项方法处理细胞,以1.0×105个/mL的细胞密度,1 mL/孔的体积接种于激光共聚焦培养皿中,培养12 h,待细胞贴壁后,对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换含GANT-61(20 μmol/L)的培养基(1 mL/孔)处理细胞,继续培养24 h后,吸弃培养基,PBS清洗后每孔加入50 μL含Hoechst 33324和PI的抗荧光淬灭封片液,然后于激光共聚焦显微镜下观察记录细胞凋亡情况。
2.6 JC-1染色法检测细胞线粒体膜电位
在细胞发生凋亡的早期阶段,线粒体膜电位会发生改变,因此通过检测线粒体膜电位的变化来考察细胞早期凋亡。采用“2.2”项方法处理细胞,以1.0×105个/mL的细胞密度,500 μL/孔的体积接种24孔培养板于中,培养12 h,待细胞贴壁后,对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换含GANT-61(20 μmol/L)的培养基(500 μL/孔)处理细胞,继续培养24 h后,收集细胞,按照线粒体膜电位检测试剂盒(JC-1法)说明书染色,在微孔板成像系统下观察线粒体膜电位的变化。
2.7 Caspase-3、Caspase-9活性的检测
采用“2.2”项方法处理细胞,以1.0×106个/mL的细胞密度,1 mL/孔的体积接种6孔培养板于中,培养12 h,待细胞贴壁后,对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换含GANT-61(20 μmol/L)的培养基(1 mL/孔)处理细胞,继续培养24 h后,收集细胞,每个样品加入200 μL裂解液,收集裂解液后部分采用Bradford法测定蛋白浓度,当蛋白质量浓度在1~3 mg/mL时,剩余样品按照Caspase-3、Caspase-9活性检测试剂盒设定反应体系,待体系颜色变化明显时在酶标仪中测定波长405 nm下的值,并计算酶活力单位。
2.8 蛋白免疫印迹法检测相关蛋白表达水平
采用“2.2”项方法处理细胞,以5.0×105个/mL的细胞密度,1 mL/孔的体积接种于6孔培养板中,培养12 h,待细胞贴壁后,对照组更换含0.1% DMSO、给药组更换含不同浓度(5、10、20 μmol/L)熊果酸、阳性药组更换含GANT-61(20 μmol/L)的培养基(1 mL/孔)处理细胞,继续培养24 h后,收集细胞,每个样品加入200 μL预冷的增强型RIPA裂解液,收集裂解液后部分采用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,剩余部分按4∶1加入5×蛋白上样缓冲液,混匀后加热制样以备用。制备10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶,分离蛋白样品,湿法转膜,5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭90 min,按比例加入相应一抗后于4 ℃孵育过夜,次日更换二抗孵育90 min,使用化学发光成像系统成像,采用Image Lab软件进行蛋白条带分析。
2.9 统计学处理

3 结果
3.1 对SW480细胞形态的影响
微孔板成像系统明场模式下记录的SW480细胞形态见图1,与对照组相比,SW480细胞经熊果酸和Hedgehog信号通路抑制剂GANT-61给药处理后,细胞贴壁能力降低,形态发生明显改变,逐渐皱缩变圆,且随着熊果酸浓度的增加,细胞皱缩和碎片化的比例增加。
3.2 对SW480细胞增殖的影响
MTT比色法检测熊果酸对SW480细胞增殖的影响,结果见图2,与对照组(0 μmol/L)相比,在40 μmol/L范围内,随着熊果酸浓度增加,细胞存活率急剧降低,当熊果酸浓度大于40 μmol/L时,对SW480细胞的存活率影响达到平稳阈值。通过分析得出熊果酸干预24 h对SW480细胞的半数抑制浓度(IC50)为18.16 μmol/L,基于IC50,后续实验设定熊果酸对SW480细胞的干预浓度为5、10、20 μmol/L。
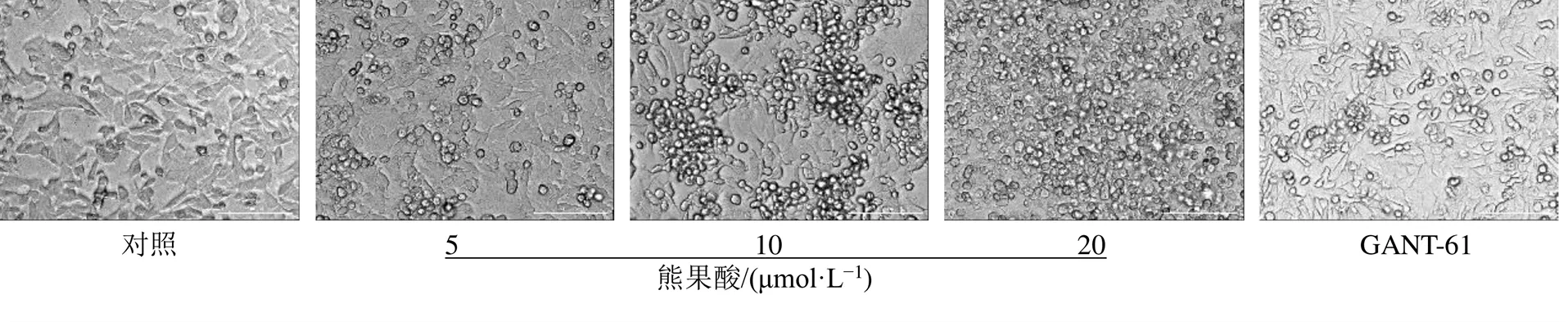
图1 熊果酸对SW480细胞形态的影响
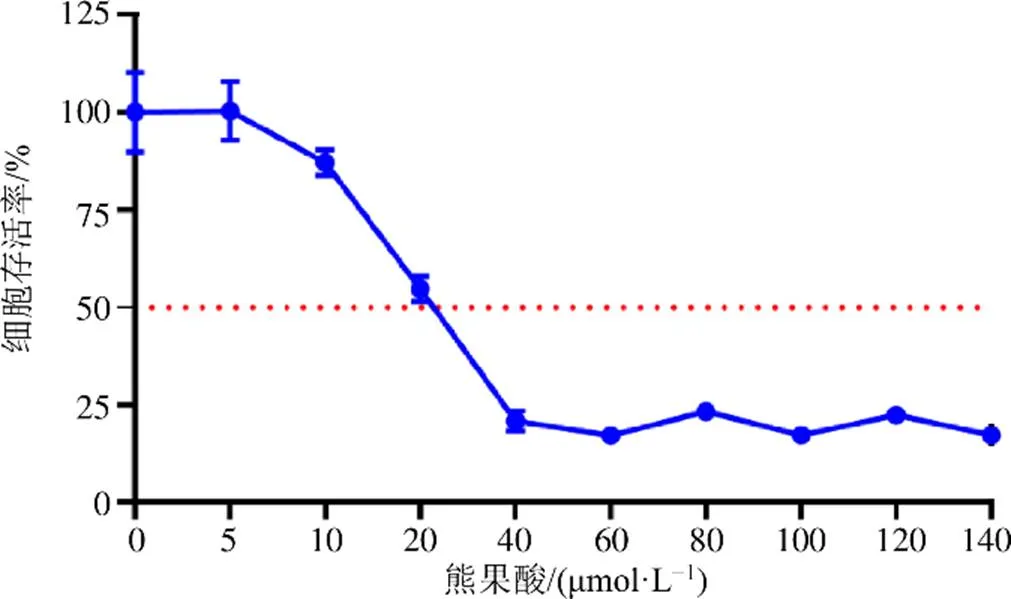
图2 熊果酸对SW480细胞增殖的影响()
3.3 对SW480细胞迁移的影响
细胞划痕法检测熊果酸对SW480细胞迁移的影响,结果见图3,与对照组及0 h相比,熊果酸处理后12 h和24 h时间点的细胞划痕的愈合面积显著减小(<0.01、0.001),说明熊果酸能够抑制SW480细胞的迁移能力,且这种抑制作用随着熊果酸干预浓度的增加而增强。
3.4 对SW480细胞凋亡的影响
Hoechst/PI染色法观察熊果酸诱导SW480细胞凋亡的情况,结果见图4,与对照组相比,熊果酸干预后细胞呈现凋亡早期染色质固缩所致的致密浓染,颜色过于饱和,甚至有些发白,表明熊果酸能够诱导SW480细胞凋亡,这种诱导作用随着熊果酸干预浓度的增加而增强,值得注意的是,熊果酸高浓度(20 μmol/L)处理诱导的细胞凋亡数量显著高于Hedgehog信号通路抑制剂GANT-61(20 μmol/L)处理组。
3.5 对SW480细胞线粒体膜电位的影响
JC-1染色法观察熊果酸对SW480细胞线粒体膜电位的影响,结果见图5,与对照组相比,熊果酸干预后细胞的红色荧光减弱,绿色荧光增强,表明熊果酸能使SW480细胞的线粒体膜电位降低,且膜电位降低程度随着熊果酸干预浓度的增加而增大。
3.6 对SW480细胞Caspase-3、Caspase-9活性的影响
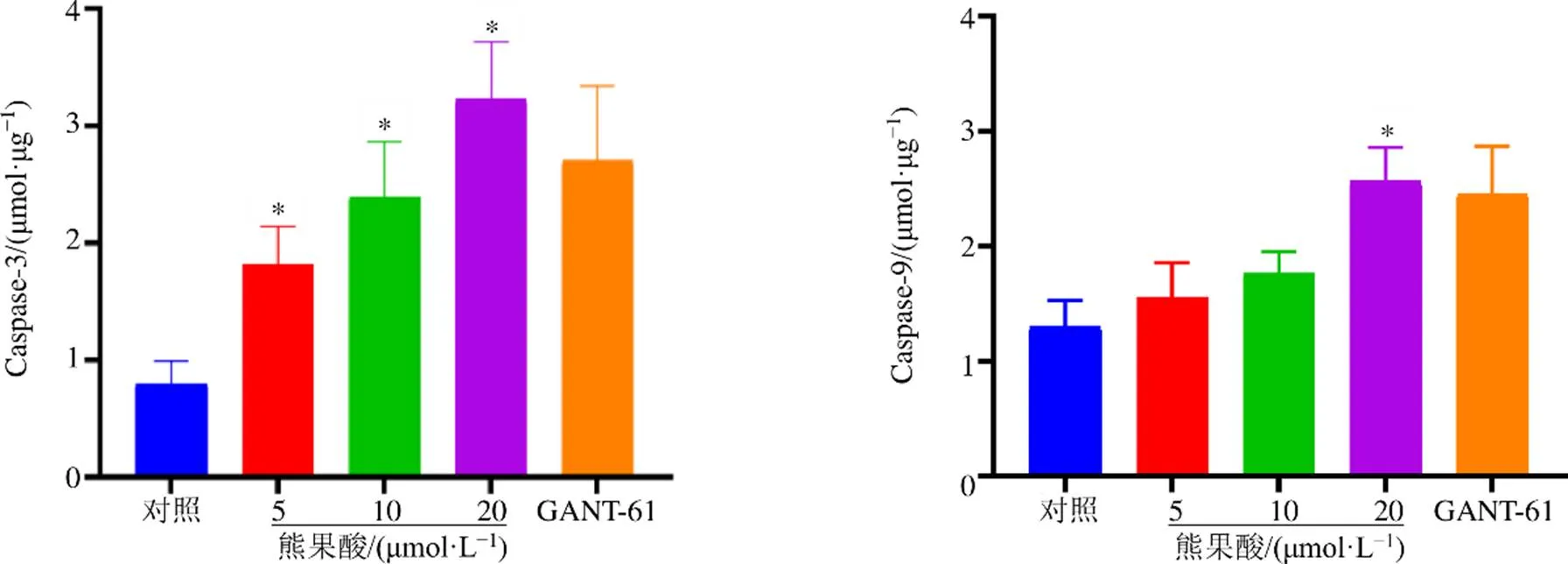
试剂盒检测熊果酸对SW480细胞Caspase-3、Caspase-9活性的影响,结果见图6,与对照组相比,熊果酸各剂量干预后细胞的Caspase-3活性显著升高(<0.05),熊果酸高剂量干预后细胞的Caspase-9活性显著升高(<0.05),表明熊果酸能够增强SW480细胞的Caspase-3、Caspase-9活性。

图3 熊果酸对SW480细胞迁移能力的影响()

图4 熊果酸对SW480细胞凋亡的影响()
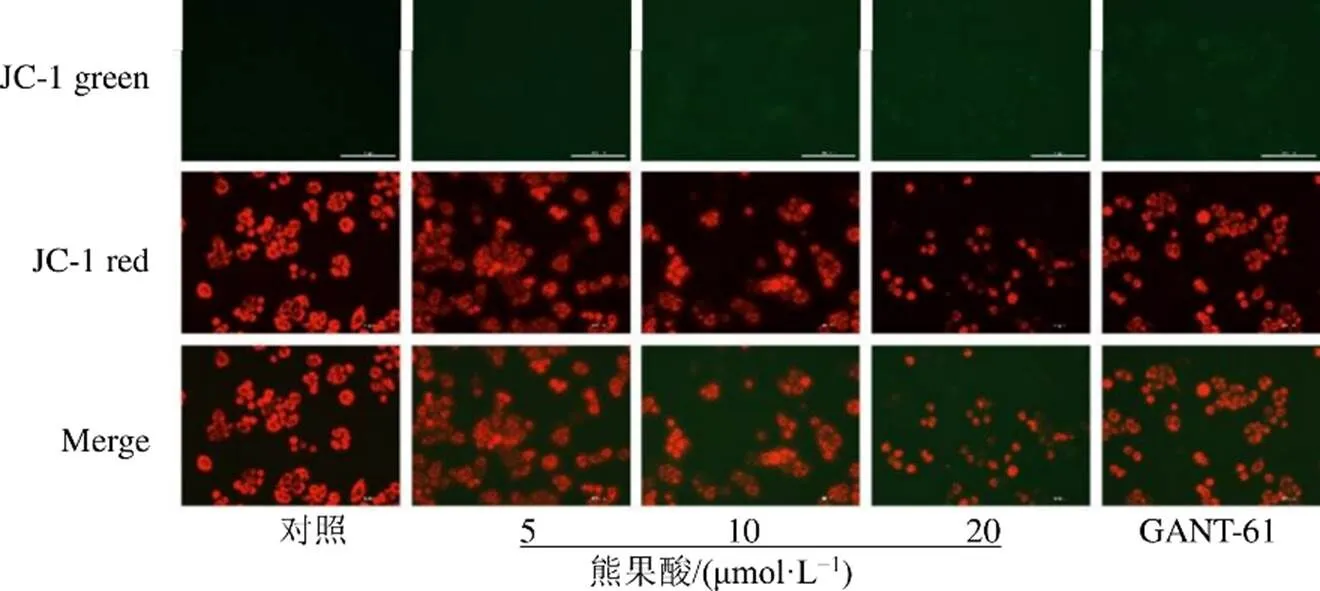
图5 熊果酸对SW480细胞线粒体膜电位的影响()
3.7 对SW480细胞凋亡相关蛋白的影响
蛋白免疫印迹法检测熊果酸对SW480细胞凋亡相关蛋白Bax、Bcl-2表达的影响,结果见图7,与对照组相比,熊果酸(20 μmol/L)能显著升高SW480细胞中促凋亡蛋白Bax表达量(<0.05),熊果酸各剂量均能显著降低抗凋亡蛋白Bcl-2表达量(<0.05),表明熊果酸能够综合调控凋亡相关蛋白Bax、Bcl-2水平,促进SW480细胞发生凋亡。
与对照组比较:*P<0.05,图7同
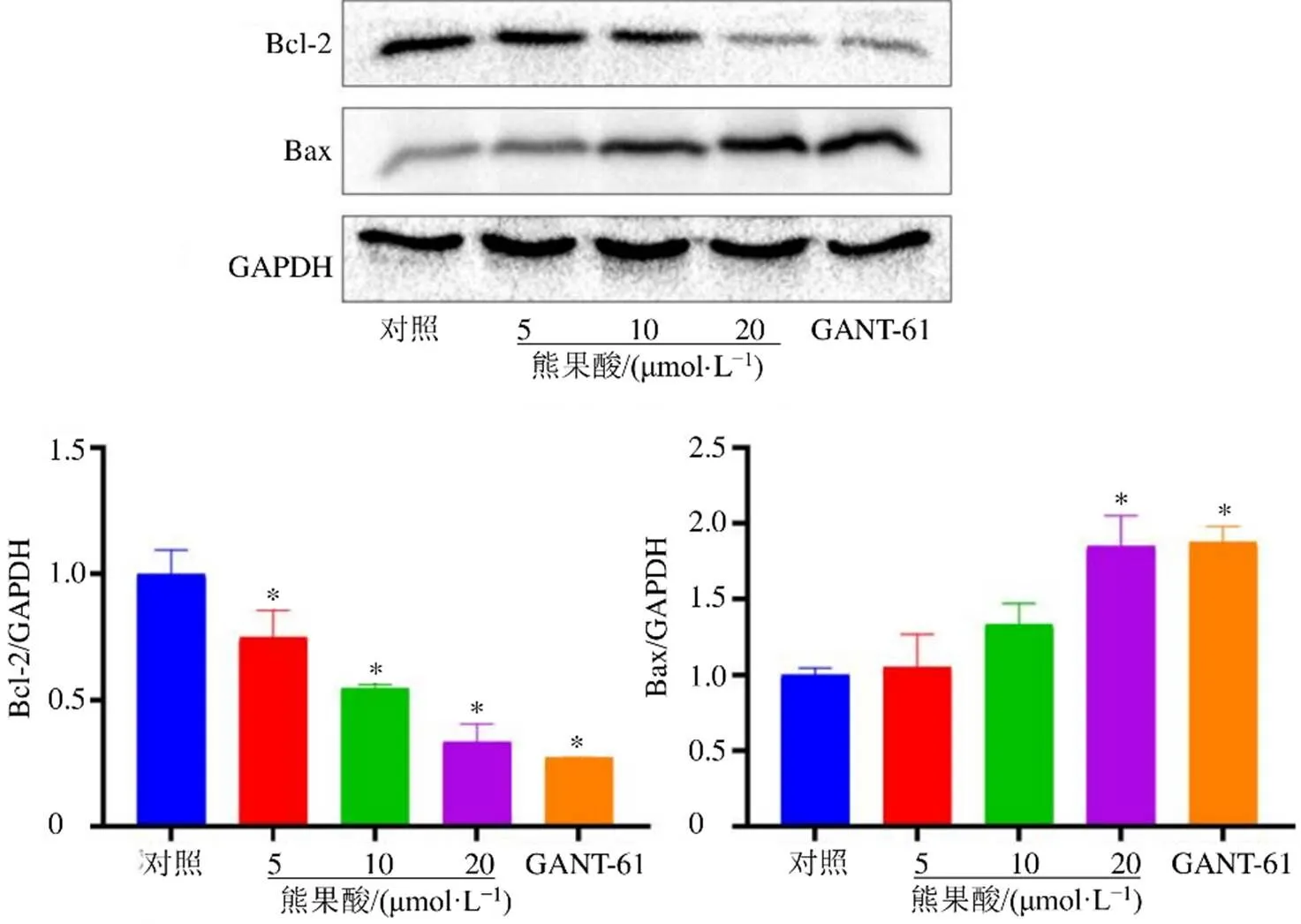
图7 熊果酸对SW480细胞凋亡相关蛋白的影响()
3.8 对SW480细胞Hedgehog信号通路相关蛋白的影响
蛋白免疫印迹法检测熊果酸对SW480细胞Hedgehog信号通路蛋白SHh、Gli1、Ptch1、Smo、c-Myc、SuFu表达的影响,结果见图8,与对照组相比,熊果酸能显著降低SHh、Gli1、Ptch1、Smo、c-Myc蛋白的表达量(<0.05、0.01),显著升高SuFu蛋白的表达量(<0.05),表明熊果酸能够抑制Hedgehog信号通路的激活。
4 讨论
作为世界3大癌症之一的结直肠癌,近年来随着饮食的精细化、高热量化和生活方式的久坐化、少运动化,结直肠癌的发病率和死亡率居高不下[18]。20世纪80年代,细胞凋亡开始作为癌症治疗的可行策略进入人们的视线,此后的30多年,人们一直致力于探索细胞凋亡在癌症治疗中的应用,促进肿瘤细胞凋亡不仅能保护正常细胞,死亡的肿瘤细胞还能促进临床反应,减少肿瘤复发的几率,未来靶向细胞凋亡作为癌症治疗的手段仍旧意义重大[19]。Hedgehog信号通路是癌症发生发展的重要信号通路SHh与Ptch1结合,Ptch1对Smo的抑制解除,Smo被激活释放,Smo激活是将SHh信号跨膜传递至细胞质的关键步骤,Smo激活后,SuFu与Gli1蛋白分离,Gli1释放出来,开始转录靶基因[20],导致引起细胞分裂和修复受损DNA的原癌基因表达水平上调[21],此外SHh过表达和Gli1转录都能激活Bcl-2启动子,导致抗凋亡蛋白Bcl-2表达水平上调[22-23]。熊果酸是中药白花蛇舌草的主要活性成分,《广西中药志》中记载白花蛇舌草:“治小儿疳积,毒蛇咬伤,癌肿(肿瘤)”。此外熊果酸在抗肿瘤方面药效显著,对肠道、肺、肝、肾都具有良好的保护作用[24]。基于Hedgehog信号通路参与了肿瘤细胞的凋亡逃逸,因此,本实验将Hedgehog信号通路作为靶点,探索熊果酸通过Hedgehog信号通路抑制结直肠癌SW480细胞增殖的机制。
与对照组比较:*<0.05**<0.01
*< 0.05**< 0.01control group
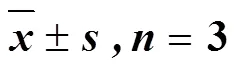
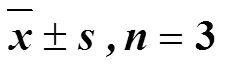
本实验结果证明熊果酸对结直肠癌SW480细胞具有良好的细胞毒作用,在一定剂量范围内对细胞形态的影响显著,明显抑制细胞的生长、迁移,诱导细胞凋亡,其机制可能是通过抑制Hedghog信号通路的激活,使得Hedgehog信号通路中的关键因子SHh、Gli1和协助细胞规避凋亡的原癌基因c-Myc被抑制,凋亡蛋白家族Bcl-2表达下调,与仅含BH3区域蛋白(BH3-onlyproteins,BOPs)的结合减少,线粒体外膜开始产生孔隙,逐渐通透化,膜电位下降;Bax表达上调,转位到线粒体内部,释放细胞色素C,形成凋亡复合体,凋亡复合体的形成激活Caspase家族中的Caspase-9、Caspase-3等凋亡执行者,从线粒体途径诱发细胞凋亡,进而抑制SW480细胞的增殖。此外,本实验发现熊果酸诱导细胞凋亡的作用优于GANT-61,说明在熊果酸诱导SW480细胞凋亡的过程中,除Hedgehog信号通路参与外,其他通路也发挥了作用。因此,熊果酸通过综合调控包括Hedgehog信号通路在内的多种信号通路调控结直肠癌SW480细胞的形态、生长、增殖、迁移,诱导其发生线粒体途径的凋亡,对临床上靶向癌细胞凋亡疗法和信号通路阻滞疗法具有重大意义。本实验结果为进一步研究Hedgehog信号通路靶点在结直肠癌治疗中的应用提供了有效参考,为熊果酸在癌症预防和治疗方面的应用提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Siegel R L, Miller K D, Goding Sauer A,. Colorectal cancer statistics, 2020 [J]., 2020, 70(3): 145-164.
[2] O'Connell J B, Maggard M A, Livingston E H,. Colorectal cancer in the young [J]., 2004, 187(3): 343-348.
[3] Gu G, Barone I, Gelsomino L,.extracts exert antiproliferative and apoptotic effects on human breast cancer cells through ERα/Sp1-mediated p53 activation [J]., 2012, 227(10): 3363-3372.
[4] Kumar R, Harilal S, Carradori S,. A comprehensive overview of colon cancer- A grim reaper of the 21st century [J]., 2020, doi: 10.2174/ 0929867327666201026143757.
[5] Block K I, Gyllenhaal C, Lowe L,. Designing a broad-spectrum integrative approach for cancer prevention and treatment [J]., 2015, 35(Suppl): S276-S304.
[6] PDQ Adult Treatment Editorial Board. Colon Cancer Treatment (PDQ®): Health Professional Version [EB/OL]. [2020-07-31]. https://www.ncbi.nlm.nih.gov/books/NBK65858/.
[7] Yang Y C, Wang C S, Wei M C. A green approach for the extraction and characterization of oridonin and ursolic and oleanolic acids fromand its kinetic behavior [J]., 2020, 319: 126582.
[8] Miao J, Li X, Zhao C C,. Active compounds, antioxidant activity and α-glucosidase inhibitory activity of different varieties offruits [J]., 2018, 248: 330-339.
[9] Lee M K, Ahn Y M, Lee K R,. Development of a validated liquid chromatographic method for the quality control of: Determination of triterpenic acids [J]., 2009, 633(2): 271-277.
[10] Woźniak Ł, Skąpska S, Marszałek K. Ursolic acid: A pentacyclic triterpenoid with a wide spectrum of pharmacological activities [J]., 2015, 20(11): 20614-20641.
[11] Zielińska S, Matkowski A. Phytochemistry and bioactivity of aromatic and medicinal plants from the genus() [J]., 2014, 13: 391-416.
[12] Prasad S, Yadav V R, Sung B,. Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways: Chemosensitization with capecitabine [J]., 2012, 18(18): 4942-4953.
[13] Yin R, Li T, Tian J X,. Ursolic acid, a potential anticancer compound for breast cancer therapy [J]., 2018, 58(4): 568-574.
[14] Lin Y J, Liang W M, Chen C J,. Network analysis and mechanisms of action of Chinese herb-related natural compounds in lung cancer cells [J]., 2019, 58: 152893.
[15] Guo J L, Han T, Bao L,. Ursolic acid promotes the apoptosis of cervical cancer cells by regulating endoplasmicstress [J]., 2019, 45(4): 877-881.
[16] Tremmel L, Rho O, Slaga T J,. Inhibition of skin tumor promotion by TPA using a combination of topically applied ursolic acid and curcumin [J]., 2019, 58(2): 185-195.
[17] Doheny D, Manore S G, Wong G L,. Hedgehog signaling and truncated GLI1 in cancer [J]., 2020, 9(9): E2114.
[18] Mehta R S, Nishihara R, Cao Y,. Association of dietary patterns with risk of colorectal cancer subtypes classified byin tumor tissue [J]., 2017, 3(7): 921-927.
[19] Carneiro B A, El-Deiry W S. Targeting apoptosis in cancer therapy [J]., 2020, 17(7): 395-417.
[20] Drenkhahn S K, Jackson G A, Slusarz A,. Inhibition of hedgehog/Gli signaling by botanicals: A review of compounds with potential hedgehog pathway inhibitory activities [J]., 2013, 13(5): 580-595.
[21] Palle K, Mani C, Tripathi K,. Aberrant GLI1 activation in DNA damage response, carcinogenesis and chemoresistance [J].(Basel), 2015, 7(4): 2330-2351.
[22] Chen X L, Cheng Q Y, She M R,. Expression of sonic hedgehog signaling components in hepatocellular carcinoma and cyclopamine-induced apoptosis through Bcl-2 downregulation[J]., 2010, 41(5): 315-323.
[23] Bigelow R L, Chari N S, Unden A B,. Transcriptional regulation of bcl-2 mediated by the sonic hedgehog signaling pathway through gli-1 [J]., 2004, 279(2): 1197-1205.
[24] Sun Q, He M, Zhang M,. Ursolic acid: A systematic review of its pharmacology, toxicity and rethink on its pharmacokinetics based on PK-PD model [J]., 2020, 147: 104735.
Mechanism study on ursolic acid induced apoptosis of colorectal cancer SW480 cells based on Hedgehog signaling pathway
ZHANG Meng, HE Man, SUN Qiang, CHEN Li, ZENG Sha, ZHAO Hui, YANG Han, LIU Mao-lun, REN Shan, XU Hai-bo
Department of Pharmacology, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To investigate the effects and mechanisms of ursolic acid on proliferation and apoptosis of human colorectal cancer cell SW480 through canonical Hedgehog signaling pathway.The effect of ursolic acid on cell morphology was observed by microscope. MTT colorimetric method, cell scratch experiment and Hoechest/PI staining were used to detect the effect of ursolic acid on cell viability, cell migration and cell apoptosis. Fluorescent probe method was used to detect the effect of ursolic acid on mitochondrial membrane potential. The effects of ursolic acid on Caspase-3 and Caspase-9 were detected by Caspase activity detection kit. The expressions of Hedgehog signaling pathway-related proteins SHh, Gli1, Ptch1, Smo, c-Myc, SuFu and apoptosis-related proteins Bax and Bcl-2 were detected by Western blotting.Ursolic acid significantly affected the morphology of human colorectal cancer cell SW480; The migration ability of SW480 cells was decreased markedly; Mitochondrial membrane potential was decreased; The nuclei were densely stained; The activity of Caspase-3 and Caspase-9 was increased; SW480 cell apoptosis was found; The expression levels of Hedgehog signaling pathway related protein SuFu and apoptosis-related protein Bax were increased; The expression levels of apoptosis-related protein Bcl-2 and Hedgehog signaling pathway-related proteins SHh, Gli1, Ptch1, Smo c-Myc were decreased.Ursolic acid enable to inhibit the growth and proliferation and promote apoptosis of SW480 cells by inactivating Hedgehog signaling pathway.
ursolic acid; Hedgehog signaling pathway; human colorectal cancer cells SW480; cell proliferation; cell apoptosis
R285
A
0253 - 2670(2021)08 - 2365 - 09
10.7501/j.issn.0253-2670.2021.08.020
2020-11-15
国家自然科学基金项目(81573813);国家自然科学基金项目(81173598);四川省教育厅省属高校科研创新团队建设计划项目(18TD0017);成都中医药大学“杏林学者”基金项目(YXRC2019002,ZRYY1917);成都中医药大学西南特色中药资源重点实验室开放研究基金资助项目(2020XSGG006)
张 梦,硕士研究生,研究方向为中药药理。
徐海波,博士,教授,博士生导师。E-mail: xuhb@hotmail.com
[责任编辑 潘明佳]

