肝硬化患者血浆cfDNA中TERT热点突变率研究
薛晓霞,何美琳,梁国威*
(1.北京大学航天临床医学院 检验科,北京100049;2.航天中心医院 检验科,北京100049)
端粒酶逆转录酶(TERT)启动子区-124bp C/T和-146bp C/T突变是多种自我更新率较低的组织来源的肿瘤突变驱动基因[1-4],其在肝细胞性肝癌(HCC)中的突变率在60%左右,而在肝硬化中突变率为6%-19%,是肝硬化向HCC转化过程中的最早和唯一的癌变突变驱动基因[5]。目前,该热点突变已成为肝硬化患者早期癌变的研究靶点。
目前,肝硬化患者组织活检依从性差,难以获得满意的组织标本[6]。循环游离DNA(cfDNA)作为“液体活检”标本,在肝硬化患者中TERT热点突变的检出率为8.6%左右[7],而在肝硬化患者随访、监测TERT突变的研究中显示,患者癌变前后TERT热点突变也由阴性转为阳性[8],提示检测cfDNA中TERT热点突变对于监测肝硬化患者是否早期发生癌变具有重要的临床应用价值。
目前,关于肝硬化患者cfDNA中测定TERT热点突变的相关研究较少[5,7-8],相关研究有待于进一步完善。本研究在80例肝硬化患者cfDNA中检测TERT基因-124bp C/T和-146bp C/T热点突变,旨在进一步明确肝硬化患者TERT热点突变的发生率及其突变与肝硬化患者临床基本资料的相关性。
1 材料与方法
1.1 研究对象
收集航天中心医院2019年10月-2020年11月确诊肝硬化患者80例,其中男性40例,女性40例,年龄范围33-94岁,平均年龄66.4±16.1岁。纳入标准:根据Child-Pugh肝功评分(A、B、C级),结合患者出现腹水、肝性脑病及门脉高压引起的食管、胃底静脉明显曲张或破裂出血,临床明确诊断肝硬化患者。排除标准:排除各种疑似或明确诊断原发性肝癌或肝转移癌患者和除肝癌外疑似或明确诊断的各种肿瘤患者。纳入研究者签署知情同意书,本研究通过航天中心医院医学伦理委员会审查(项目批号:20190830-YN-01)。
1.2 方法
收集研究对象的基础资料,包括性别、年龄,有无腹水和临床肝性脑病诊断。检测肝功(TBiL、ALB、ALT和AST)、凝血指标(PT、PTA、APTT)、肿瘤标志物(AFP、CEA、CA199)、病毒性肝炎指标(HBV两对半、HCV抗体)。其中肝功指标采用AU 2700全自动生化分析仪检测(贝克曼库尔特,美国)、凝血指标采用top2全自动凝血分析仪(贝克曼库尔特,美国),由公司提供配套试剂。肿瘤标志物和病毒性肝炎指标采用美国雅培公司 i2000 免疫分析仪进行检测,由雅培公司提供配套试剂。
1.3 外周血cfDNA提取
留取2 h内EDTA抗凝外周全血3 mL,4℃、2 000×g离心10 min, 吸出的血浆层再次4℃、16 000×g 离心10 min后,留取500 μL血浆后,采用天根生化科技(北京)有限公司的磁珠法血清/血浆游离DNA提取试剂盒(目录号:DP709)提取cfDNA,按试剂盒说明操作,洗脱体积35 μL,-80℃保存待测。
1.4 cfDNA中TERT热点突变率检测
采用2步PCR扩增法检测TERT热点突变,首先,采用普通PCR富集cfDNA模板(引物及反应条件见表1),扩增产物纯化后稀释1000倍作为模板进行突变率检测;第二步采用扩增阻滞原理结合荧光定量PCR(ARMS-qPCR)检测突变率(引物及反应条件见表1),即采用ARMS-qPCR和内参-qPCR分别同时检测待测样本,根据5套突变率标准品测得的循环阈值(Ct值)的平均值,以Lg突变率对应ΔΔCt值,分别建立-124(C/T)和-146(C/T)的突变率标准曲线。其中,ΔΔCt值=ΔCt值待测标本-ΔCt值100%M;ΔCt值待测标本=待测标本ARMS-qPCR的Ct值 - 待测标本内参-qPCR的Ct值,ΔCt值100%M=100%突变标准品ARMS-qPCR的Ct值-100%突变标准品内参-qPCR的Ct值。突变率回归曲线分别为:-124M%=10(1.979-0.272×ΔΔCt值),-146M%=10(1.993-0.258×ΔΔCt值)。采用所建方法测定30例表观健康人结果显示,-124(C/T)和-146(C/T)突变率检测下限皆为0.05%(方法学评价具体数据未列出)。
1.5 统计学处理
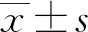
2 结果
2.1 研究对象的基本资料
80例肝硬化患者中, TBiL、DBiL、TP、AST、PT、PTA、APTT、AFP、CEA、CA199在男、女性之间无显著性差异(P>0.05),而年龄、ALT水平在男、女性之间有显著性差异(P<0.05),见表2。

表1 ARMS-qPCR方法测定TERT热点突变的引物和探针序列
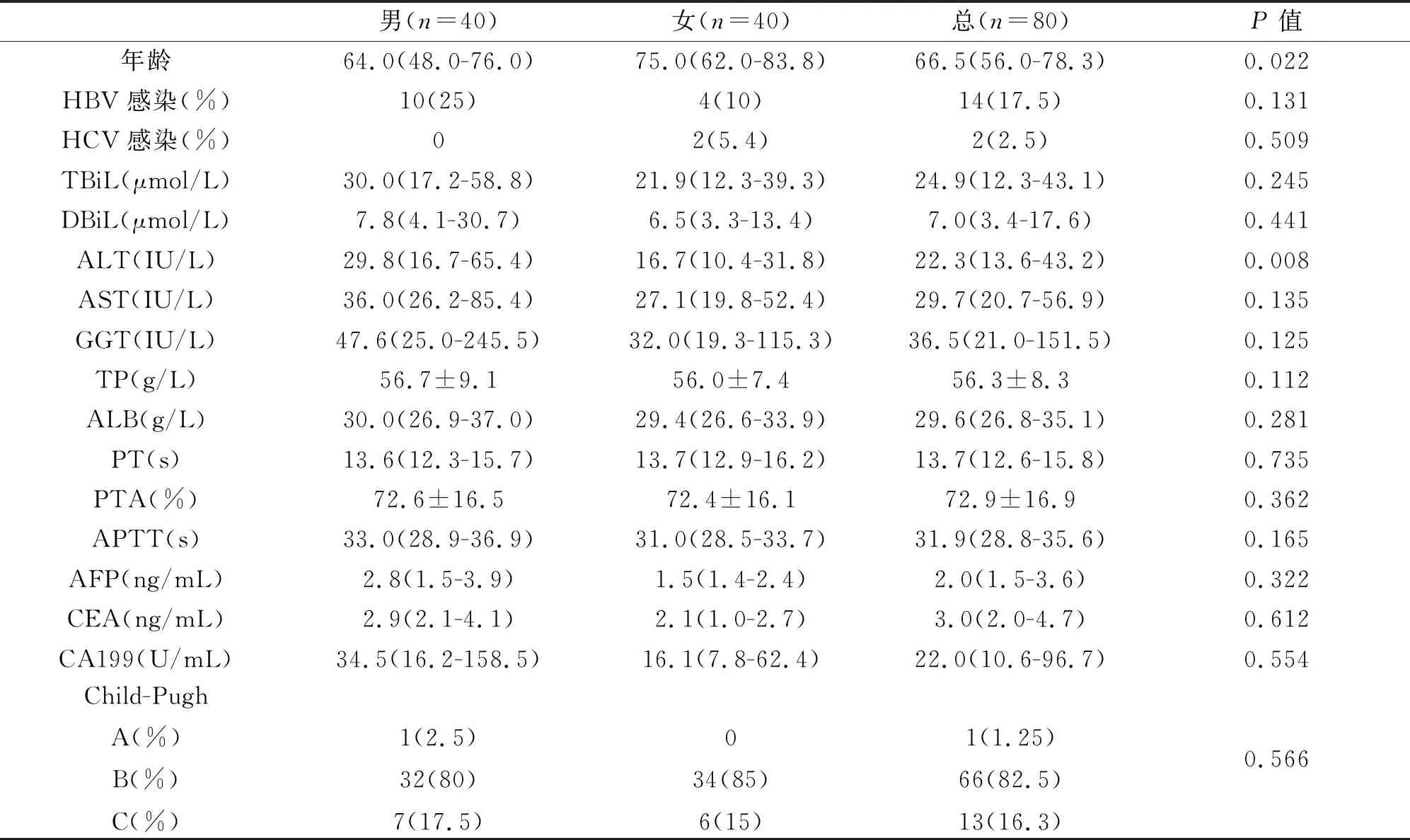
表2 80例肝硬化患者基本资料
2.2 80例肝硬化患者血浆cfDNA标本TERT突变率检测结果
采用所建方法对80例肝硬化患者cfDNA中TERT突变进行检测,结果显示TERT基因突变阳性有6(7.5%)例,其中-124bp位点突变4例(5%),突变率分别为0.13%、0.27%、0.46%和0.52%;-146bp位点2例(2.5%),突变率分别为1.92%和2.77%。
2.3 TERT阳性病例基础资料比较
TERT突变与临床基本资料统计结果显示,与TERT未突变组比较,TERT突变(-124bp和-146bp,6例)阳性组患者的血清ALB水平显著降低,CA199水平显著增高,差异具有统计学意义(P<0.05)。而与年龄、性别、有无HBV感染、HCV感染、肝功指标(TBiL、TP、ALT和AST)、凝血常规指标(PT、PTA、APTT)、肿瘤标志物(AFP、CEA)和Child-Pugh分级均没有统计学意义(P>0.05)。
3 讨论
本研究采用ARMS-qPCR方法,在80例肝硬化患者cfDNA中检测到-124位点突变4例(5%),-146位点突变2例(2.5%),总计突变率为6例(7.5%)。进一步分析显示TERT突变阳性组患者的血清ALB水平显著低于非突变组,CA199水平显著高于非突变组,而与其他临床基础资料和检测指标无显著相关性。
TERT是肝硬化患者中发生HCC风险的癌前病变的新生生物标志物。研究表明,在肝硬化向肝癌的恶性转变过程中,TERT的突变发生率逐渐增加。在病理组织标本的研究显示,低级别分化不良性结节、高级别分化不良性结节和早期HCC中分别检测到TERT突变率是6%、19%和61%[5],而在cfDNA中检测到TERT的突变率为8.6%左右[7]。本研究检测肝硬化患者cfDNA中TERT基因突变率为7.50%,提示检测肝硬化患者cfDNA中TERT热点突变或可监测肝硬化患者的早期癌变。
最新研究显示,在对肝硬化患者进行跟踪随访时,发现肝硬化患者在癌变后-124位点突变转呈阳性[8],说明TERT在肝硬化向HCC转变的早期监测中具有重要的临床意义。流调资料显示,肝硬化患者年癌变率2%-5%[9],结合本研究和以往研究[7]在cfDNA中检测到TERT突变率为7.5%和8.6%,两者发生率基本一致,进一步提示在肝硬化患者cfDNA中监测TERT基因突变必要性和重要性。
本研究TERT突变阳性患者中,血清ALB水平显著降低,CA199水平显著升高,差异具有统计学意义(P<0.05);而Child-Pugh评分、TBiL、DBiL、TP、ALT、AST、PT、PTA、APTT、AFP、CEA与TERT阴性患者之间虽存在差异,差异未见显著相关性(P>0.05),这可能是由于阳性样本总体偏少所致,有待于进一步深入研究。
综上所述,本研究在肝硬化患者cfDNA中检测到TERT突变率发生率为7.5%,提示TERT可作为监测肝硬化患者发生HCC的早期生物标志物。由于肝硬化患者进行组织活检具有患者依从性差、有创性和组织异质性的局限性,而cfDNA标本易于反复取材更适用于临床常规检测,因此,在肝硬化患者cfDNA中检测TERT位点突变,进而监测肝硬化早期癌变具有重要的临床指导意义。

