基于网络药理学研究黄连-吴茱萸干预抑郁症的作用机制Δ
吴明权,周 许,彭 伟,朱力阳,涂 禾
(四川省骨科医院制剂中心,四川 成都 610041)
抑郁症是一种情感性精神障碍疾病,以情绪低落、思维困难、睡眠障碍、行为异常和意志脆弱等为主要临床表现[1]。目前,抑郁症呈现高发病率、高致残率和高死亡率等特点[2],世界卫生组织指出其或将成为继冠心病之后的第二大疾病[3]。需特别注意的是,在临床上,抑郁亦可多见于强直性脊椎炎、高血压及脑卒中等疾病的伴随症状,并可以作为独立病因加剧疾病的发展[4-6]。抑郁症归属中医“情志病”“郁症”的范畴,中医文献中多以“癫证”“梅核气”等疾病描述。中医理论认为,抑郁症的病机与肝气郁结,失于疏泄,脾虚致气血升降出入失常密切相关,中医治疗抑郁症,多以辛开苦降治法为基础,强调疏肝理气,最终使肝脏疏泄功能和脾脏升清降浊功能恢复正常。
黄连味苦,性寒,归心、脾、胃、肝、胆、大肠经,具有清热燥湿、泻火解毒的功效。吴茱萸味辛、苦,性热,归肝、脾、胃、肾经,具有散寒止痛、降逆止呕、助阳止泻的功效[7]。黄连-吴茱萸是左金丸、反左金丸、变通丸、甘露散和戊己丸等方剂的基础配伍,是辛开苦降治法的经典药对。黄连与吴茱萸配伍充分体现了辛开苦降、寒热并用、反佐及制性存用等配伍原则,能够起到调和脾胃、调匀寒热、调节升降、调畅肝脾气机和恢复脾胃运化的作用。黄连-吴茱萸配伍常用于干预肝火上逆、吞酸、泻痢、痞满及暑气等中焦症状。早期临床研究结果显示,部分消化性溃疡患者能够从抗抑郁药的联合治疗中获益[8]。尤其值得关注的是,临床上常用于治疗胃肠道溃疡的黄连-吴茱萸同样具有干预抑郁症的作用。研究结果表明,吴茱萸碱和小檗碱能够通过增加5-羟色胺(5-HT)能神经元的受体浓度,对5-HT转运体低表达的抑郁症患者具有保护作用[9]。此外,左金丸乙醇提取物能够显著增加由利血平诱导的抑郁症模型小鼠海马区中单胺类神经递质多巴胺与去甲肾上腺素的水平,同时使纹状体中去甲肾上腺素、多巴胺及5-HT水平也能显著增加。在悬尾实验、强迫游泳实验和5-羟色氨酸诱导的甩头试验中,黄连-吴茱萸乙醇提取物也被证实具有抗抑郁作用[10]。目前,黄连-吴茱萸抗抑郁作用机制尚不完全清楚,相关研究多偏重探讨一种药物成分作用于单个靶标,缺乏中药复方治疗疾病的系统性和整体性证据。本研究基于中医整体观念,采用网络药理学理论和方法,对黄连-吴茱萸有效成分-靶点和蛋白质相互作用的网络关系进行探讨,从多成分、多层次、多靶点和多通路作用的角度阐述黄连-吴茱萸治疗抑郁症的作用机制,以期为黄连-吴茱萸干预抑郁症的临床应用及开发利用提供依据。
1 资料与方法
1.1 黄连-吴茱萸化学成分的收集和活性成分的筛选
采用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)[11](http://tcmspw.com/tcmsp.php)获取黄连、吴茱萸的化学成分。输入关键字“黄连”“吴茱萸”,得到黄连和吴茱萸的化学成分信息。中药口服成分(群)需要经过吸收、分布、代谢和排泄(absorption,distribution,metabolism and excretion,ADME)过程才能发挥药效,而口服生物利用度(oral bioavailability,OB)和类药性(drug likeness,DL)是中药成分ADME的重要参数指标。利用TCMSP数据库设置筛选参数OB≥30%和DL≥0.18,筛选得到黄连、吴茱萸的有效成分。
1.2 有效成分作用靶点和疾病潜在相关靶点的收集
通过Swiss Target Prediction数据库(swiss institute of bioinformatics)(http://www.swisstargetprediction.ch)预测出黄连、吴茱萸有效成分作用靶点,筛选条件为Probability>0.5。在Gene Card数据库(https://www.genecards.org/)中以“depression”“depressive disorder”及“depressive”为关键词,检索与抑郁症疾病相关的靶基因,获得疾病相关靶点。
1.3 网络的构建及基因富集分析
采用软件Cytoscape 3.2.1构建黄连、吴茱萸的“成分-靶点”和“蛋白质-蛋白质相互作用(protein-protein interaction,PPI)”交互网络,并采用内置插件分析网络拓扑参数。采用DAVID生物信息数据库(https://david.ncifcrf.gov/)提取多个基因或者蛋白质的生物学信息,同时富集分析得出黄连-吴茱萸干预抑郁症的基因功能和通路。
2 结果
2.1 黄连-吴茱萸有效成分筛选
通过TCMSP 数据库检索,筛选出具有良好OB和DL的黄连-吴茱萸潜在有效成分共41个,其中黄连11个,具体是berberrubine、epiberberine、(R)-canadine、berlambine、corchoroside A_qt、magnograndiolide、palmidin A、palmatine、coptisine、worenine和moupinamide;吴茱萸27个,分别是1-methyl-2-undecyl-4-quinolone、1-methyl-2-nonyl-4-quino-lone、evocarpine、icosa-11,14,17-trienoic acid methyl ester、24-methyl-31-norlanost-9(11)-enol、5α-O-(3′-Methylamino-3′-phenylpropionyl) nicotaxine、6-OH-luteolin、evodiamide、fordi-mine、goshuyuamide Ⅰ、goshuyuamide Ⅱ、gossypetin、gravacri-doneshlirine、N-(2-Methylaminobenzoyl) tryptamine、isorha-mnetin、β-sitosterol、sitosterol、rutaecarpine、rutaevine、rutalinidine、1-methyl-2-[(Z)-pentadec-10-enyl]-4-quinolone、1-methyl-2-[(Z)-undec-6-enyl]-4-quinolone、dihydrorutaecarpine、1-methyl-2-pentadecyl-4-quinolone、evodiamine和1-(5,7,8-trimethoxy-2,2-dimethylchromen-6-yl) ethanone;黄连-吴茱萸共有成分3个,包含obacunone、quercetin和berberine。
2.2 黄连-吴茱萸抗抑郁的潜在作用靶点预测
通过Swiss Target Prediction数据库检索并设置筛选条件为Probability>0.5,共获得与药物成分相关的靶点51个。以“depression”“depressive disorder”等作为关键词,检索Gene Card数据库,整合获得抑郁症相关的疾病靶点12 608个。将黄连-吴茱萸的作用靶点与疾病相关靶点进行交互筛选,获得关键靶点46个。
2.3 成分-疾病-关键靶点网络的构建与分析
将黄连和吴茱萸有效成分、作用靶点及疾病相关靶点分别导入Cytoscape 3.6.1 软件,构建成分-靶点-疾病网络,见图1。在网络图中,六边形节点代表疾病抑郁症;10个菱形节点代表黄连-吴茱萸干预抑郁症的有效成分,分别是小檗碱(berberine)、β-谷甾醇(β-sitosterol)、吴茱萸次碱(rutaecarpine)、巴马汀(palmatine)、24-methyl-31-norlanost-9(11)-enol、6-羟基木犀草素(6-OH-luteolin)、棉花素(gossypetin)、谷甾醇(sitosterol)、表小檗碱(epiberberine)和R-四氢小檗碱((R)-canadine),黄连贡献5个成分,吴茱萸贡献8个成分,其中小檗碱为共有活性成分;46个圆形节点代表疾病和有效成分相关的关键靶点;节点与节点之间的作用关系,即203条边。该结果表明黄连-吴茱萸中有效成分作用多个抑郁症相关靶点,呈现多成分、多靶点的作用特点。

图1 黄连-吴茱萸干预抑郁症的“成分-靶点-疾病”网络图Fig 1 “Component-target-disease” network of coptidis rhizoma and euodiae fructus in the intervention of depression
2.4 PPI网络的构建
将46个黄连-吴茱萸干预抑郁症作用靶点导入STRING数据库中,得出蛋白质之间相互作用网络。通过Cytoscape软件进行可视化处理,网络图中圆形节点表示抗抑郁靶点蛋白,边代表各靶点间的相互关系,共包含43个节点,有3个靶点未发生相互作用,101个边;图中圆形节点大小和颜色深浅代表靶点Degree值,节点越大,颜色由浅至深,表示抗抑郁靶点贡献度越大,反之表示越小,见图2。结果显示,前列素内环氧化物合成酶2(prostaglandin endoperoxide synthase 2,PTGS2)、乙酰胆碱酯(acetylcholinesterase,ACHE)、单胺氧化酶A(monoamine oxidaseA,MAOA)、雄激素受体(androgen receptor,AR)、丁酰胆碱酯酶(butyryleholinesterase,BCHE)和多巴胺受体2(dopamine receptor D2,DRD2)等疾病靶点的Degree值排名靠前,说明该类靶点是黄连-吴茱萸干预抑郁症重要的作用靶点。

图2 黄连-吴茱萸干预抑郁症相关基因的蛋白质相互作用网络Fig 2 Protein interaction network of coptidis rhizoma and euodiae fructus in the intervention of depression-related genes
2.5 基因本体(gene ontology, GO)生物功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将黄连-吴茱萸干预抑郁症靶点导入DAVID 数据库进行基因功能与通路富集分析,共获得生物过程(biological process, BP)101个,主要涉及多细胞生物过程的调节(regulation of multicellular organismal process)、生物调节(biological regulation)、代谢过程(metabolic process)等;细胞组成(cell composition, CC)23个,涉及细胞核(cell nucleus)、内膜系统(endomembrane system)和细胞膜(cell membrane);分子功能(molecular function, MF)23个,包括蛋白质结合(protein binding)等,见图3。利用DAVID数据库中KEGG进行通路富集,富集到显著相关通路20条。将P值由小到大排列,选取前10位信号通路,通过P值和基因数量来衡量KEGG富集程度。黄连-吴茱萸干预抑郁症的前10位信号通路依次是血清素的神经突触通路(serotonergic synapse)、卵巢类固醇生成通路(ovarian steroidogenesis)、神经活性配体-受体互作通路(neuroactive ligand-receptor interaction)、脂肪代谢调控通路(regulation of lipolysis in adipocytes)、氮代谢通路(nitrogen metabolism)、环磷酸鸟苷-cGMP依赖性蛋白激酶通路(cGMP-PKG signaling pathway)、钙信号通路(calcium signaling pathway)、胰岛素抵抗通路(insulin resistance)、癌症信号通路(pathways in cancer)和环磷酸腺苷通路(cAMP signaling pathway),见图4。

图3 黄连-吴茱萸活性成分干预抑郁靶点的GO生物学过程富集分析Fig 3 Enrichment analysis of GO biological process of active components of coptidis rhizoma and euodiae fructus in the intervention of depression
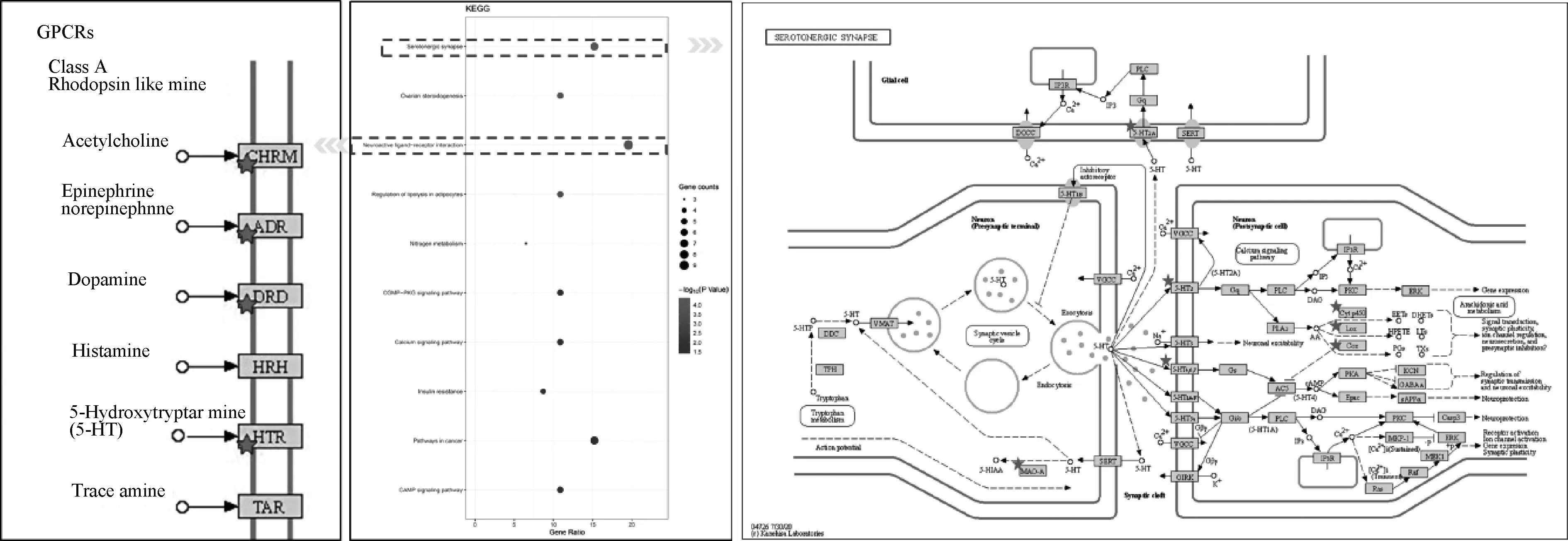
图4 黄连-吴茱萸干预抑郁症KEGG通路富集分析Fig 4 Enrichment analysis on KEGG pathways of targets from active compounds of coptidis rhizoma and euodiae fructus in the intervention of depression
3 讨论
抑郁症发病机制主要涉及到:(1)中枢神经系统中5-HT释放减少,突触间隙中浓度降低;(2)多巴胺含量或功能异常及其代谢产物异常;(3)去甲肾上腺素功能变化,包括蓝斑核的改变、去甲肾上腺素的利用及突触前、突触后的受体异常;(4)5-HT、去甲肾上腺素、多巴胺转运体、受体及相关酶的改变;(5)炎症及氧化应激水平升高;(6)脑源性神经营养因子水平低下。目前临床上常用的抗抑郁药主要是通过选择性5-HT再摄取抑制、去甲肾上腺素再摄取抑制和调节大脑及外周单胺类递质的代谢酶发挥抗抑郁作用。
本研究采用网络药理学方法对黄连-吴茱萸药对干预抑郁症作用机制进行了初步研究,构建了黄连-吴茱萸“化学成分-靶点-疾病”网络,初步明确了黄连-吴茱萸干预抑郁症的活性成分(群),主要有小檗碱、β-谷甾醇、吴茱萸次碱、巴马汀、24-methyl-31-norlanost-9(11)-enol、6-羟基木犀草素、棉花素、谷甾醇、表小檗碱和R-四氢小檗碱,提示黄连-吴茱萸干预抑郁症成分具有多成分、多层次、多靶点协同作用的特点。研究结果表明,小檗碱作为黄连和吴茱萸的共有成分,可改善由卵巢摘除或者由外周皮质酮注射导致的抑郁样行为[12-13],对不同抑郁动物模型均表现出良好的抗抑郁作用,其作用机制与调节大脑内单胺类成分转运及代谢、抗炎、抗氧化作用和提高脑源性神经营养因子水平等方面密切有关[14]。在强迫游泳实验、悬尾实验中,吴茱萸次碱可以减少小鼠的不动时间,增加小鼠海马去甲肾上腺素、纹状体去甲肾上腺素、5-HT和多巴胺的含量,产生抗抑郁作用[10];β-谷甾醇可能通过提高5-HT、去甲肾上腺素和多巴胺等中枢神经递质水平来发挥抗抑郁的作用[15]。
PPI网络分析结果显示,黄连-吴茱萸能够通过调控PTGS2、ACHE、MAOA、AR、BCHE及DRD2等靶点治疗抑郁症。经典的5-HT系统和ACHE异常是抑郁症发病的重要环节[16-17]。PTGS2在脑内海马和谷氨酸能神经元中表达,在维持突触功能、长期突触可塑性等方面发挥作用[18]。MAOA为单胺氧化酶,DRD2和DRD4为多巴胺受体,三者属于单胺类神经递质范畴。MAOA在单胺类神经递质代谢中起着关键作用,是重要的临床抗抑郁药单胺氧化酶抑制剂的药理学靶点,亦与抑郁症密切相关[19]。以上结果说明黄连、吴茱萸可通过多成分、多靶点的协同作用而充分发挥抗抑郁的作用,为中药抗抑郁药效物质基础的探究及潜在药物的研发提供了新线索。此外,KEGG通路富集分析结果显示,黄连-吴茱萸干预抑郁症的关键基因靶点主要富集在血清素能突触通路、神经活性配体-受体互作通路、钙信号通路、CAMP受体通路和cGMP-PKG通路等。抑郁模型大鼠海马神经元凋亡与海马突触体内游离Ca2+浓度显著升高相关,提示黄连-吴茱萸药对作用的靶点参与了Ca2+信号通路,从而能够抑制Ca2+超载引起的能量代谢障碍和神经元损伤[20]。cGMP信号传导级联参与神经可塑性,主要下游效应物是PKG[21]。氟西汀和阿米替林治疗8周可增加海马cGMP含量,进而激活下游PKG为主的cGMP信号级联反应,从而发挥抗抑郁作用,提示黄连-吴茱萸药对可作用于cGMP-PKG信号通路,发挥抗抑郁作用[22-23]。综合来看,黄连-吴茱萸干预抑郁症具有系统性和整体性的优势。
此外,研究结果显示,抑郁症的发生、发展与微生物-脑-肠轴密切相关,其机制涉及神经内分泌、免疫调节、炎症反应和菌群代谢产物等多个方面[24]。通过调节,恢复肠道菌群稳态可以干预焦虑或抑郁行为[25-27]。另有研究结果表明,抑郁症与紧张所致胃溃疡的症状有一些相似之处,胃溃疡与抑郁症在神经体液系统的病理机制存在高度相关,如氟西汀、阿米替林、米氮平及度洛西汀能通过调节去甲肾上腺素和5-HT水平,促进胃溃疡的愈合,减轻胃黏膜出血,该类抗抑郁药对胃溃疡模型都有明显的抗溃疡作用[28-29]。黄连-吴茱萸乙醇提取物能调节应激性胃溃疡大鼠模型脑组织中去甲肾上腺素、5-HT及多巴胺等单胺神经递质浓度,通过神经-体液途径发挥抗应激性胃溃疡的作用[30]。综上所述,基于微生物-脑-肠轴角度,深入探究黄连-吴茱萸干预抑郁症作用机制是一种新的思路,具有可预期的研究价值,有助于建立黄连-吴茱萸干预抑郁症多维证据链。

