青蒿琥酯通过miR-21/PTEN通路对人大肠癌CCL229细胞恶性生物学行为抑制作用的研究
巩会杰,唐建荣,姚兰杰,冯鹏飞
青蒿琥酯通过miR-21/PTEN通路对人大肠癌CCL229细胞恶性生物学行为抑制作用的研究
巩会杰,唐建荣,姚兰杰,冯鹏飞
驻马店市中心医院 消化内科,河南 驻马店 463000
探究青蒿琥酯对人大肠癌CCL229细胞恶性生物学行为抑制作用的机制。采用MTT法检测青蒿琥酯对CCL229细胞活力的影响;通过流式细胞术检测青蒿琥酯对CCL229细胞凋亡的影响;采用Transwell法检测青蒿琥酯对CCL229细胞侵袭能力的影响;采用克隆形成实验检测青蒿琥酯对CCL229细胞集落形成能力的影响;采用Western blotting法检测青蒿琥酯对CCL229细胞内自噬特异性蛋白如自噬效应蛋白(Beclin1)、轻链3-Ⅰ/Ⅱ蛋白(light chain 3-Ⅰ/Ⅱ,LC3-Ⅰ/Ⅱ)、自噬相关蛋白5(autophagy related protein 5,Atg5)、Atg5-Atg12复合物以及上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白如紧密连接蛋白(ZO-1)、上皮钙黏蛋白(epithelial cadherin,E-cadherin)、神经钙黏蛋白(neuronal cadherin,N-cadherin)、锌指转录因子(Slug)和第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)表达的影响;采用qRT-PCR法检测青蒿琥酯对CCL229细胞内mRNA表达的影响;通过双荧光素酶报告基因实验验证与的靶向关系;考察过表达或抑制与对青蒿琥酯抑制CCL229细胞恶行生物学行为的影响。青蒿琥酯显著降低CCL229细胞存活率(<0.05、0.01、0.001),显著促进CCL229细胞凋亡(<0.001),显著抑制CCL229细胞侵袭和克隆形成能力(<0.001),显著上调CCL229细胞内Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ、ZO-1、E-cadherin表达水平(<0.05、0.01),显著下调N-cadherin和Slug蛋白表达水平(<0.05)。CCL229细胞内mRNA高表达(<0.01),青蒿琥酯显著抑制CCL229细胞内mRNA表达水平(<0.05)。过表达显著抑制青蒿琥酯对CCL229细胞的促凋亡作用(<0.001),显著减弱青蒿琥酯对CCL229细胞侵袭和克隆形成能力的抑制作用(<0.01),显著抑制青蒿琥酯对CCL229细胞Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ、ZO-1、E-cadherin表达水平的上调作用(<0.05、0.01),显著抑制青蒿琥酯对CCL229细胞N-cadherin和Slug蛋白表达水平的下调作用(<0.01);抑制则作用相反。是的下游靶基因,过表达显著抑制CCL229细胞内PTEN蛋白表达水平(<0.01),抑制显著上调PTEN蛋白表达水平(<0.01),过表达显著抑制野生型PTEN()质粒的荧光素酶活性(<0.01)。过表达与抑制表达对CCL229细胞作用一致,同时过表达和不会影响青蒿琥酯对CCL229细胞恶性生物学行为的抑制作用。青蒿琥酯能够通过调控miR-21和PTEN表达诱导CCL229细胞凋亡和自噬,并抑制细胞增殖和侵袭。
大肠癌;青蒿琥酯;miRNA;增殖;侵袭;上皮间质转化;自噬;凋亡
大肠癌是世界范围内常见的恶性肿瘤之一,其发病率和死亡率居高不下[1]。目前手术、化疗和放疗是治疗大肠癌的主要手段[2]。5-氟尿嘧啶是用于治疗实体瘤的主要药物,临床广泛应用于大肠癌的治疗,治疗效果较好[3],然而化疗对患者带来的不良反应不容小觑,因此寻找有效且不良反应较小的药物对提升大肠癌患者的治疗效果至关重要。
微小RNA(miRNA,miR)是一类在真核生物中起转录后调控作用的非编码小分子RNA,在细胞的增殖、分化、凋亡等多种生物学行为中起重要作用[4]。研究表明,miRNA在肿瘤中的异常表达可作为抑癌基因参与大肠癌等多种肿瘤的发生、转移、侵袭等过程,且与患者的预后密切相关[5-6]。miR-21在大肠癌患者血清中异常高表达[7],且参与大肠癌细胞的增殖、凋亡、侵袭等过程[8]。青蒿琥酯是从传统中药青蒿中提取出的一种天然倍半萜烯,是治疗疟疾的安全药物[9]。Efferth等[10]发现青蒿琥酯能诱导肿瘤细胞凋亡,对多发性骨髓瘤[11]、宫颈癌[12]、乳腺癌[13]、前列腺癌[14]等多种肿瘤具有抑制作用,但其抗肿瘤的作用机制尚不清楚。本研究探究青蒿琥酯抑制大肠癌细胞恶性生物学行为的作用机制,为其临床应用提供依据。
1 材料
1.1 细胞
人大肠癌CCL229细胞株和人正常肠上皮HIEC细胞株购自上海康朗生物科技有限公司。
1.2 药品与试剂
青蒿琥酯(60 mg/支)购自桂林南药股份有限公司;5-氟尿嘧啶(0.25 g/支)购自上海旭东海普药业有限公司;胎牛血清(批号SA190501)、RPMI 1640培养基(批号C22400500BT)、DMEM培养基(批号C11995500CP)、Trizol试剂(批号15596-026)、PrimeScript逆转录试剂盒(批号RR047A)、SYBR Green Real-Time PCR MasterMix试剂盒(批号RR420A)、Lipofectamine 2000试剂盒(批号11668-027)购自美国Thermo Fisher Scientific公司;RAPI蛋白裂解液(批号P0013)、BCA试剂盒(批号P0010S)购自美国Invitrogen公司;MTT试剂盒(批号GM01-500T)、Annexin V-FITC/PI试剂盒(批号40302ES20)购自上海翊圣生物科技有限公司;Dual-Luciferase Reporter Assay Kit试剂盒(批号ab228530)购自美国Promega公司;Transwell小室(批号353090)购自美国Corning公司;紧密连接蛋白(ZO-1)抗体(批号13663)、上皮钙黏蛋白(epithelial cadheri,E-cadherin)抗体(批号3195)、神经钙黏蛋白(neuronal cadherin,N-cadherin)抗体(批号61572S)、锌指转录因子(Slug)抗体(批号9585)、第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)抗体(批号9188)、自噬相关蛋白5(autophagy related protein 5,Atg5)抗体(批号9980)、Atg12抗体(批号4180)、自噬效应蛋白(Beclin 1)抗体(批号3495)、轻链3-Ⅰ/Ⅱ蛋白(light chain 3-Ⅰ/Ⅱ,LC3-Ⅰ/Ⅱ)兔抗人单克隆抗体(批号4599)购自美国CST公司;β-肌动蛋白(β-actin)鼠抗人单克隆抗体(批号20536-1-AP)、HRP标记的IgG抗体购自美国Protein Tech Group公司;引物由山东维真生物科技有限公司设计并合成。
1.3 仪器
超净工作台(苏州净化设备一厂);恒温培养箱(美国Forma Scientific公司);低温高速离心机(德国Heraeus公司);倒置显微镜和光学显微镜(日本Olympus公司);酶联免疫检测仪器(华东电子集团医疗装备有限公司);PCR扩增仪(美国ABI公司);流式细胞仪(美国Beckman公司)。
2 方法
2.1 细胞培养
CCL229细胞和HIEC细胞用含10%胎牛血清、1%青霉素和1%链霉素的DMEM培养基,于37 ℃、5% CO2的恒温培养箱中培养。
2.2 青蒿琥酯对CCL229细胞存活率的影响
取处于对数生长期的CCL229细胞,以2×104/孔接种于96孔板中,100 μL/孔,设置对照组、青蒿琥酯(5、10、20、40 μg/mL)组和5-氟尿嘧啶(40 μg/mL)组,待细胞贴壁后,各给药组加入100 μL相应药物,对照组加入不含药物的培养基,分别培养24、48、72 h,加入20 μL MTT(5 mg/mL)溶液,37 ℃孵育4 h,弃去上清液,每孔加入150 μL DMSO,采用酶标仪检测490 nm处的吸光度()值,计算细胞存活率。
2.3 青蒿琥酯对CCL229细胞凋亡的影响
取处于对数生长期的CCL229细胞,以1×105/mL接种于6孔板中,2 mL/孔,设置对照组、青蒿琥酯(20 μg/mL)组和5-氟尿嘧啶(40 μg/mL)组,待细胞贴壁后,各给药组加入相应药物,对照组加入不含药物的培养基,培养24 h。收集细胞,1000×离心5 min后弃上清,PBS冲洗3次后重悬细胞,加入1 mL 70%预冷乙醇溶液固定细胞;加入PBS离心沉淀去除固定液,加入100 μL RNA消化酶(100 μg/mL),37 ℃水浴30 min,加入100 μL碘化丙啶(PI,50 μg/mL)染色液,4 ℃避光染色30 min后,采用流式细胞仪进行检测。
2.4 青蒿琥酯对CCL229细胞侵袭能力的影响
将Matrigel和无血清RPMI 1640培养基按1∶1配制成细胞外基质胶,Transwell小室中加入30 μL细胞外基质胶。按“2.3”项下方法处理细胞,收集细胞,以无血清RPMI 1640培养基重悬,在Transwell小室的上室中加入200 μL细胞悬液,下室中加入600 μL含FBS的RPMI 1640培养基,培养24 h。擦除小室滤膜内表面细胞,于4%多聚甲醛中固定,PBS冲洗3次后使用0.1%结晶紫染色,于显微镜下对穿过膜的细胞进行计数。
2.5 青蒿琥酯对CCL229细胞克隆形成的影响
按“2.3”项下方法处理细胞,收集细胞,台盼蓝染色后对活细胞进行计数。将细胞接种于6孔板,加入3 mL含FBS的RPMI 1640培养基,隔天更换培养基,于恒温培养箱中培养7 d后对各组集落数目进行计数。
2.6 青蒿琥酯对CCL229细胞自噬特异性蛋白及上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白表达的影响
按“2.3”项下方法处理细胞,收集细胞,加入RIPA裂解液提取细胞总蛋白,采用BCA蛋白定量试剂盒检测蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,于室温封闭1 h,分别加入Beclin1、LC3-Ⅰ/Ⅱ、Atg5、Atg12、ZO-1、E-cadherin、N-cadherin、Slug、β-actin抗体(1∶2000),4 ℃孵育过夜,TBST洗涤3次后加入HRP标记的IgG抗体(1∶10 000),于室温孵育1 h,TBST洗涤3次后使用ECL发光试剂盒显影,采用Image J软件分析条带灰度值。
2.7 CCL229细胞和HIEC细胞中miR-21 mRNA表达
设置CCL229组、HIEC组和青蒿琥酯(20 μg/mL)组,HIEC组加入HIEC细胞,其余各组加入CCL299细胞,以1×105/mL接种于6孔板中,待细胞贴壁后,青蒿琥酯组加入药物,培养24 h。收集细胞,按照试剂盒说明书提取RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-ACACTCCAGCTGGGTAGCTTATCAG- ACTGA-3’,下游引物5’-TGGTGTCGTGGAGTCG-3’;上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。
2.8 过表达或抑制miR-21对CCL229细胞miR-21 mRNA表达的影响
设置对照组、过表达阴性对照组(miR-NC mimics)、过表达组(miR mimics)、抑制阴性对照组(miR-NC inhibitor)、抑制组(miR inhibitor)。按照Lipofectamine 2000转染试剂盒说明书将、()、、()转染至CCL229细胞内,48 h后,按“2.7”项下方法检测CCL229细胞中mRNA表达情况。序列:5’-UA- GCUUAUCAGACUGAUGUUGA-3’;序列:5’-UAGCUUAUCAGACUGAUGUUGA-3’。
2.9 过表达或抑制miR-21对青蒿琥酯促CCL229细胞凋亡的影响
设置对照组、过表达组(miR mimics)、抑制组(miR inhibitor)。按“2.8”项下方法进行转染,转染48 h后,各组加入青蒿琥酯(20 μg/mL),继续培养24 h,按“2.3”项下方法检测细胞凋亡情况。
2.10 过表达或抑制miR-21对青蒿琥酯抑制CCL229细胞侵袭能力的影响
按“2.9”项下方法处理细胞,按“2.4”项下方法检测细胞侵袭情况。
2.11 过表达或抑制miR-21对青蒿琥酯抑制CCL229细胞克隆形成的影响
按“2.9”项下方法处理细胞,按“2.5”项下方法检测细胞克隆形成情况。
2.12 过表达或抑制miR-21对青蒿琥酯调控CCL229细胞自噬特异性蛋白及上皮间质转化相关蛋白表达的影响
按“2.9”项下方法处理细胞,按“2.6”项下方法检测自噬特异性蛋白及上皮间质转化相关蛋白表达情况。
2.13 双荧光素酶报告基因实验验证miR-21与PTEN靶向关系
将和的3’-UTR靶序列插入到萤火虫荧光素酶基因下游。将miR-NCmimics、miR mimics载体与、载体分别共转染到CCL229细胞内,于培养箱中培养8 h,弃上清,加入0.5 mL含10%胎牛血清、无抗生素的DMEM培养基,于培养箱中培养48 h,收集细胞。按照双荧光素酶报告基因试剂盒说明书检测荧光素酶,采用酶标仪检测萤火虫和海肾荧光值,并以海肾荧光值作为内参。
2.14 过表达或抑制miR-21对CCL229细胞PTEN蛋白表达的影响
设置对照组、过表达组(miR mimics)、抑制剂组(miR inhibitor)。按“2.8”项下方法进行转染,按“2.6”项下方法检测细胞中PTEN蛋白表达情况。
2.15 CCL229细胞和HIEC细胞中PTEN蛋白表达
按“2.7”项下方法处理细胞,按“2.6”项下方法检测细胞中PTEN蛋白表达情况。
2.16 过表达或抑制PTEN对CCL229细胞PTEN蛋白表达的影响
设置对照组、过表达阴性对照组(pc-NC)、过表达组(pc-PTEN)、抑制阴性对照组(si-NC)、抑制组(si-PTEN)和过表达联合过表达组(pc-PTEN+miR mimics),按“2.8”项下方法进行转染,按“2.6”项下方法检测CCL229细胞中PTEN蛋白表达情况。序列为:5’-GACGGGAAGACAAGUUCAUTT-3’。
2.17 过表达或抑制PTEN对青蒿琥酯降低CCL229细胞存活率的影响
设置对照组、过表达组(pc-PTEN)、抑制组(si-PTEN)和过表达联合过表达组(pc-PTEN+miR mimics),按“2.8”项下方法进行转染,各组加入青蒿琥酯(20 μg/mL),培养24 h,按“2.2”项下方法检测细胞存活率。
2.18 过表达或抑制PTEN对青蒿琥酯促CCL229细胞凋亡的影响
按“2.17”项下方法处理细胞,按“2.3”项下方法检测细胞凋亡情况。
2.19 过表达或抑制PTEN对青蒿琥酯抑制CCL229细胞侵袭能力的影响
按“2.17”项下方法处理细胞,按“2.4”项下方法检测细胞侵袭情况。
2.20 过表达或抑制PTEN对青蒿琥酯抑制CCL229细胞克隆形成的影响
按“2.17”项下方法处理细胞,按“2.5”项下方法检测细胞克隆形成情况。
2.21 过表达或抑制PTEN对青蒿琥酯调控CCL229细胞自噬特异性蛋白及上皮间质转化相关蛋白表达的影响
按“2.17”项下方法处理细胞,按“2.6”项下方法检测自噬特异性蛋白及上皮间质转化相关蛋白表达情况。
2.22 统计分析
采用SPSS 20.0软件进行统计分析,运用GraphPad Prism 8.2绘制统计图,两组间比较采用检验,多组间比较采用单因素方差分析。
3 结果
3.1 青蒿琥酯对CCL229细胞存活率、凋亡、侵袭及克隆形成的影响
如图1所示,青蒿琥酯(5、10、20、40 μg/mL)作用24、48、72 h均可显著抑制CCL229细胞存活率(<0.05、0.01、0.001),呈剂量和时间相关性;与5-氟尿嘧啶组比较,青蒿琥酯(20 μg/mL)可显著抑制CCL229细胞活力(<0.05),因此选择20 μg/mL青蒿琥酯进行后续实验。
如图2-A所示,与对照组比较,青蒿琥酯组细胞凋亡率显著升高(<0.001),优于5-氟尿嘧啶。如图2-B所示,与对照组比较,青蒿琥酯组细胞侵袭能力显著降低(<0.001),优于5-氟尿嘧啶;如图2-C所示,与对照组比较,青蒿琥酯组细胞克隆形成能力显著降低(<0.001),优于5-氟尿嘧啶。
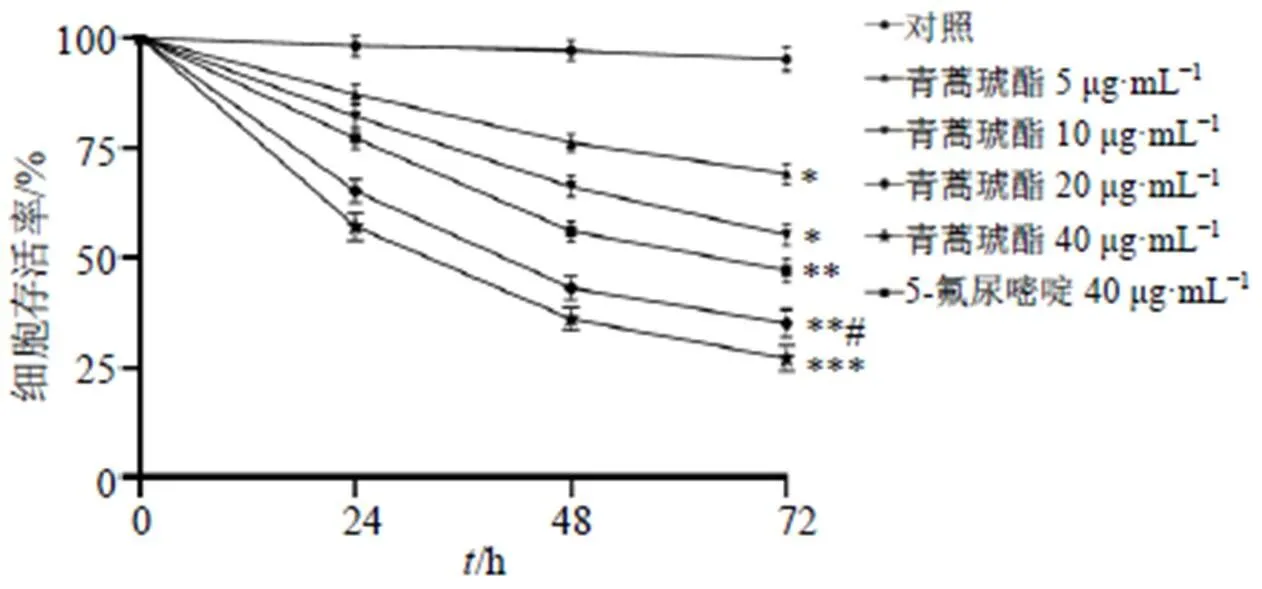
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与5-氟尿嘧啶组比较:#P<0.05
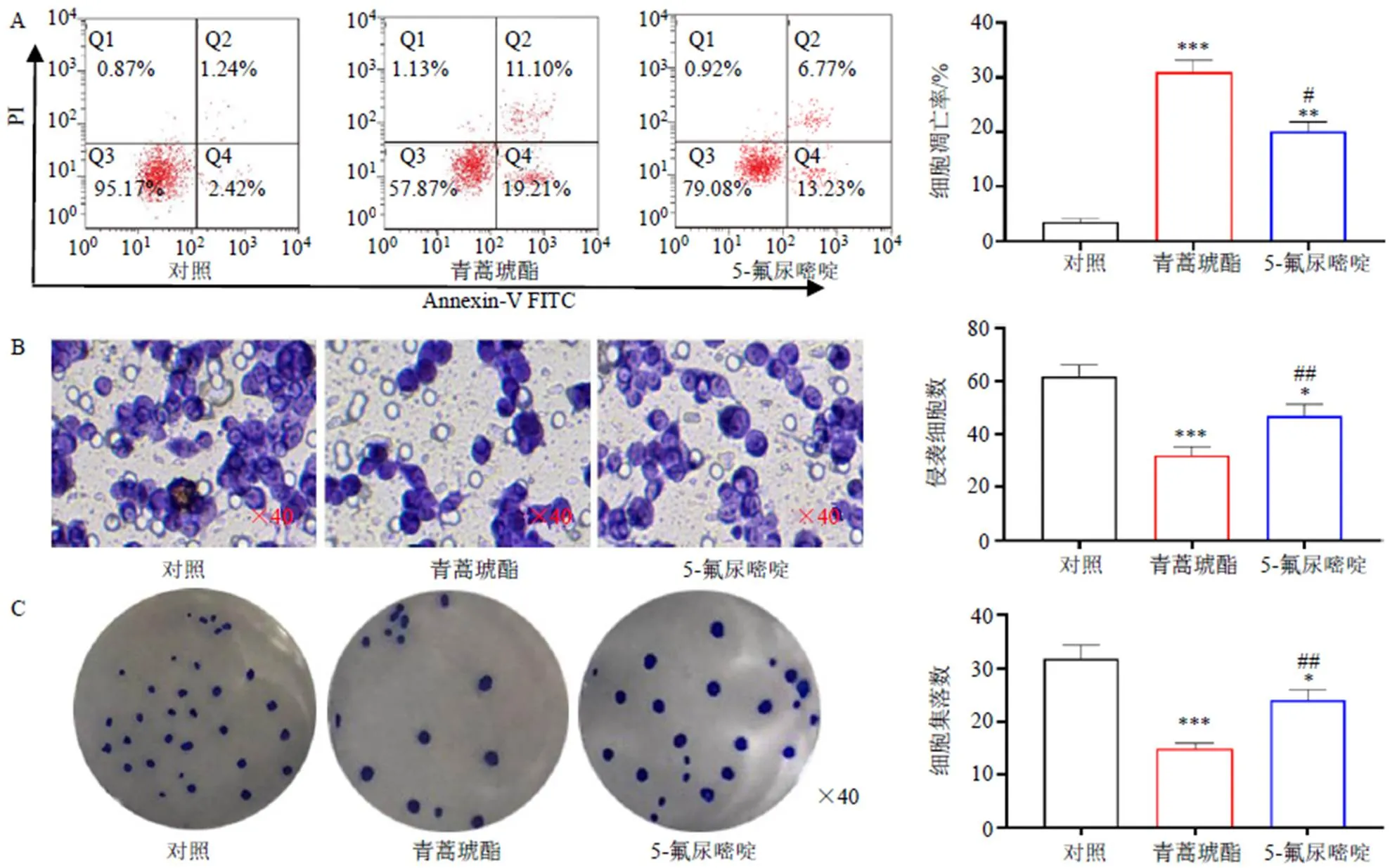
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与青蒿琥酯组比较:#P<0.05 ##P<0.01
如图3所示,与对照组比较,青蒿琥酯组CCL229细胞内自噬特异性蛋白Atg5-Atg12复合物、Atg5、Beclin1和LC3-Ⅰ/Ⅱ蛋白表达水平均显著升高(<0.05、0.01),EMT相关蛋白ZO-1、E-cadherin表达水平显著升高(<0.01),N-cadherin和Slug蛋白表达水平显著降低(<0.05)。
3.2 miR-21在CCL229细胞内的表达及作用
如图4-A所示,与CCL229细胞比较,HIEC细胞内mRNA表达水平显著降低(<0.01),青蒿琥酯组CCL229细胞内mRNA表达水平显著降低(<0.05)。如图4-B所示,转染过表达载体或抑制载体至CCL229细胞内,CCL229细胞内mRNA表达水平显著升高或降低(<0.01、0.001)。
如图5-A所示,过表达显著抑制青蒿琥酯对CCL229细胞的促凋亡作用(<0.001),抑制显著增强青蒿琥酯对CCL229细胞的促凋亡作用(<0.01)。如图5-B所示,过表达显著减弱青蒿琥酯对CCL229细胞侵袭能力的抑制作用(<0.01),抑制显著增强青蒿琥酯对CCL229细胞侵袭能力的抑制作用(<0.05)。如图5-C所示,过表达显著减弱青蒿琥酯对CCL229细胞克隆形成能力的抑制作用(<0.01),抑制显著增强青蒿琥酯对CCL229细胞克隆形成能力的抑制作用(<0.05)。
如图6所示,过表达显著抑制青蒿琥酯对CCL229细胞自噬特异性蛋白Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ以及EMT相关蛋白ZO-1、E-cadherin表达水平的上调作用(<0.05、0.01),显著抑制青蒿琥酯对CCL229细胞N-cadherin和Slug蛋白表达水平的下调作用(<0.01);抑制显著增强青蒿琥酯对CCL229细胞自噬特异性蛋白Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ以及EMT相关蛋白ZO-1、E-cadherin表达水平的上调作用(<0.05、0.01),显著增强青蒿琥酯对CCL229细胞N-cadherin和Slug蛋白表达水平的下调作用(<0.01)。
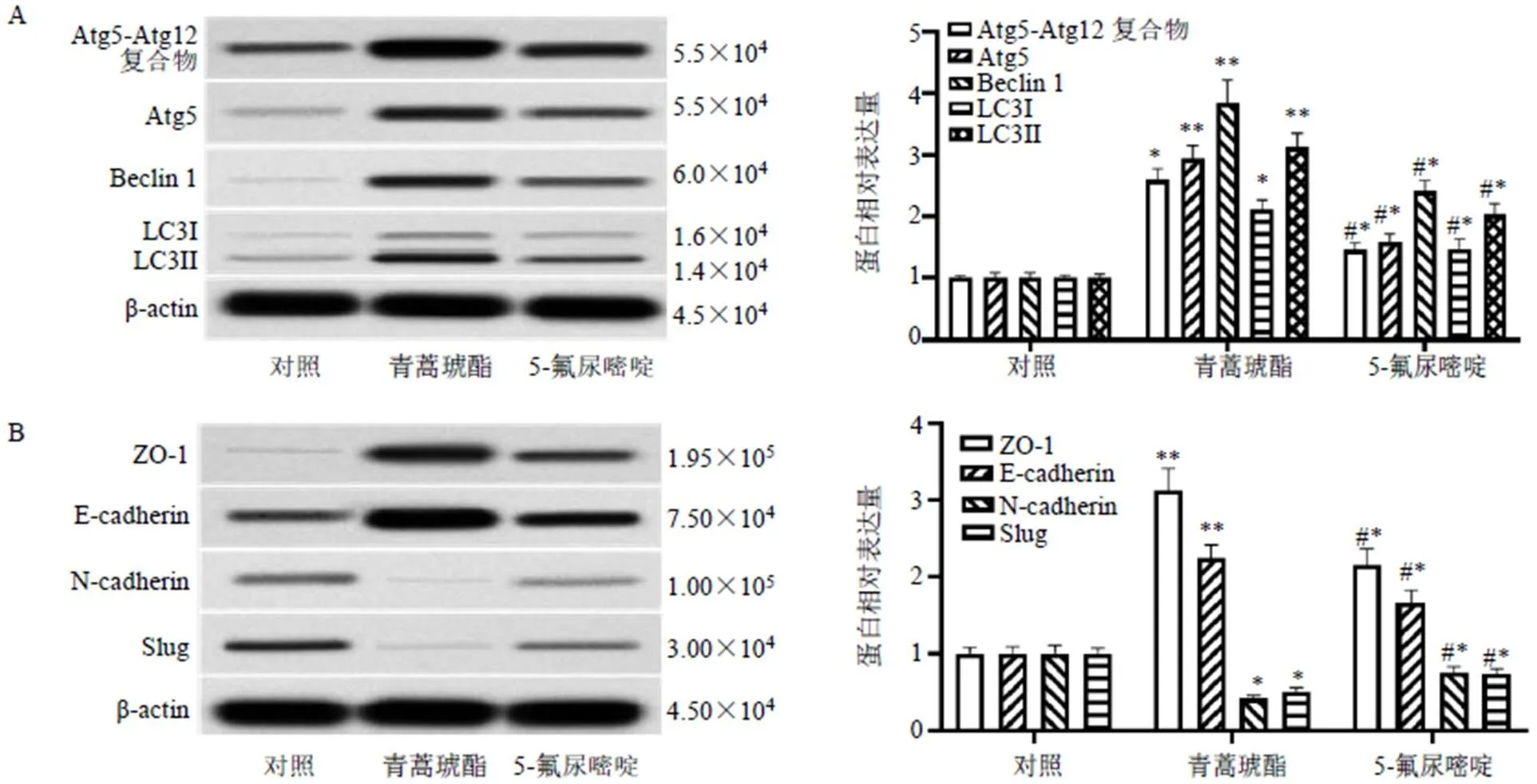
与对照组比较:*P<0.05 **P<0.01;与青蒿琥酯组比较:#P<0.05
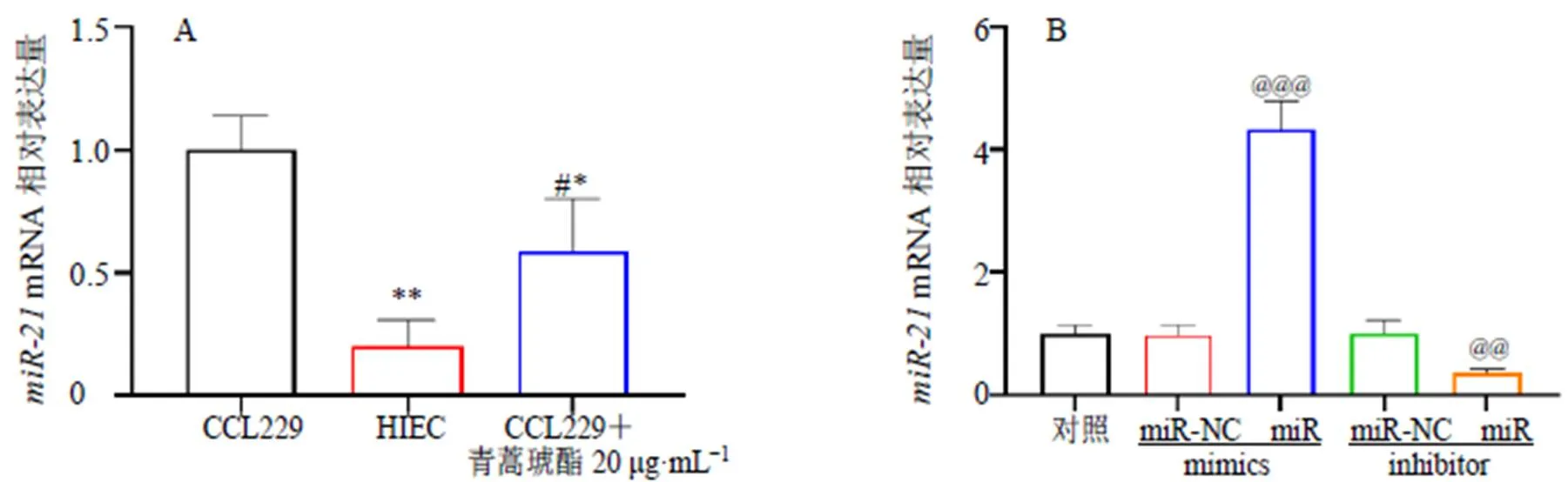
与CCL229细胞比较:*P<0.05 **P<0.01;与HIEC细胞比较:#P<0.05;与对照组比较:@@P<0.01 @@@P<0.001
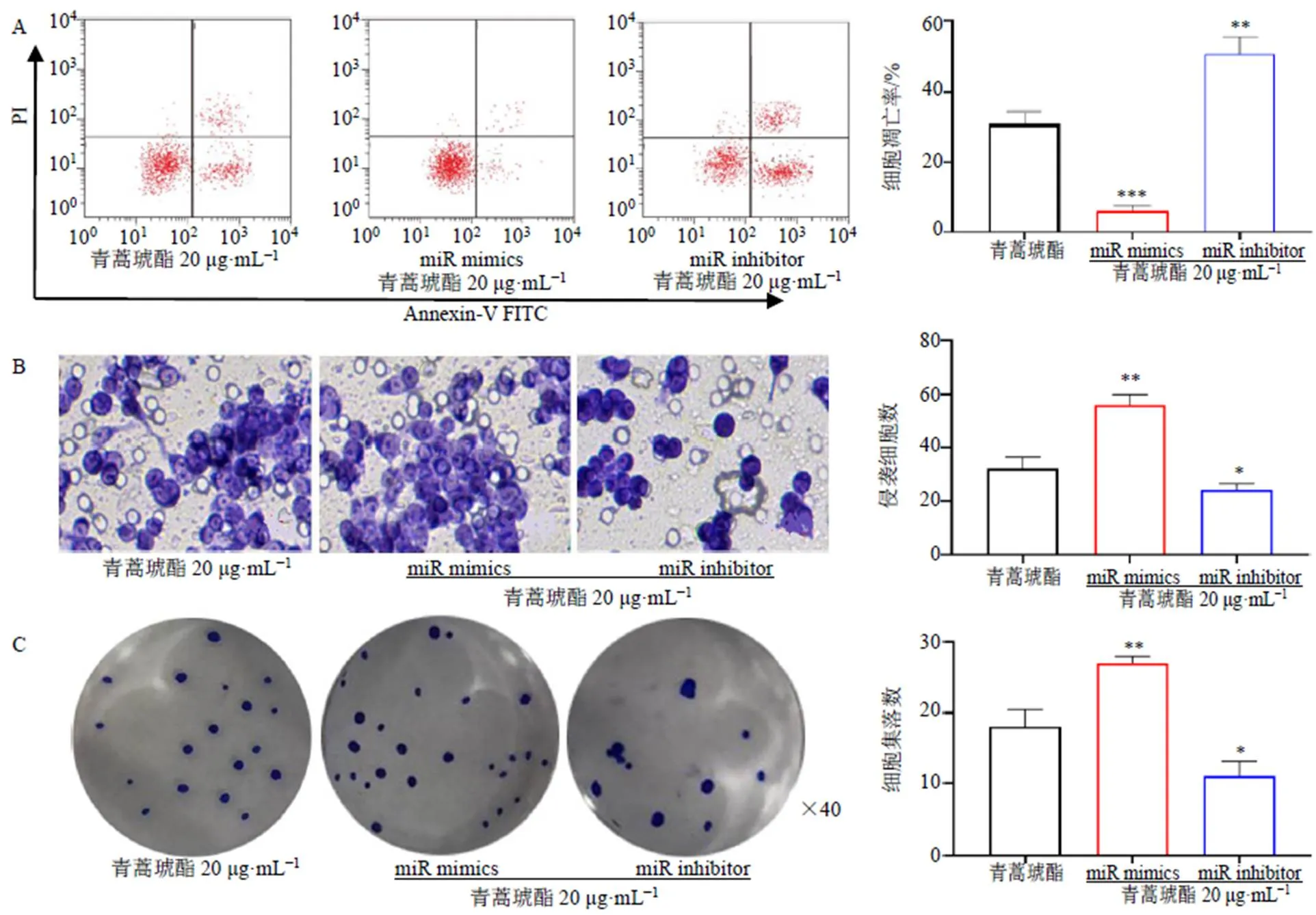
与青蒿琥酯组比较:*P<0.05 **P<0.01 ***P<0.001
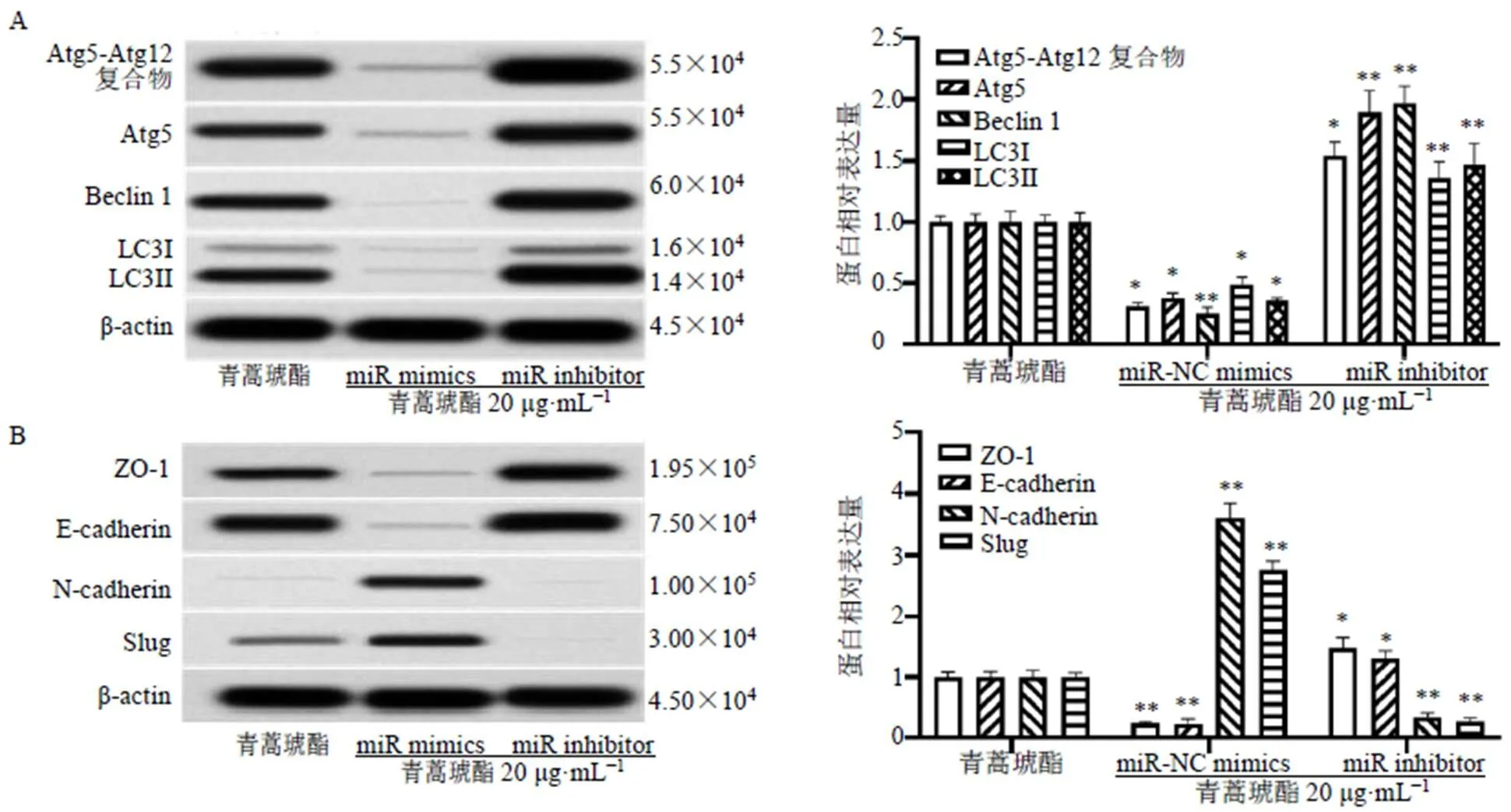
与青蒿琥酯组比较:*P<0.05 **P<0.01
3.3 PTEN为miR-21的下游靶基因
生物信息学网站(ENCORI)预测结果如图7-A所示,与mRNA 3’-UTR端存在部分靶向结合序列。如图7-B所示,过表达显著抑制CCL229细胞内PTEN蛋白表达水平(<0.01),抑制表达显著上调PTEN蛋白表达水平(<0.01)。双荧光素酶报告基因结果如图7-C所示,过表达显著抑制野生型PTEN()质粒的荧光素酶活性(<0.01),但对突变型PTEN()质粒的荧光素酶活性无显著影响。
3.4 青蒿琥酯通过miR-21/PTEN抑制CCL229恶性生物学行为
如图8-A所示,与CCL229细胞比较,HIEC细胞内PTEN蛋白表达水平显著升高(<0.01),青蒿琥酯组CCL229细胞内PTEN蛋白表达水平显著升高(<0.01)。如图8-B所示,转染过表达载体或抑制载体至CCL229细胞内,CCL229细胞内PTEN蛋白表达水平显著升高或降低(<0.01)。
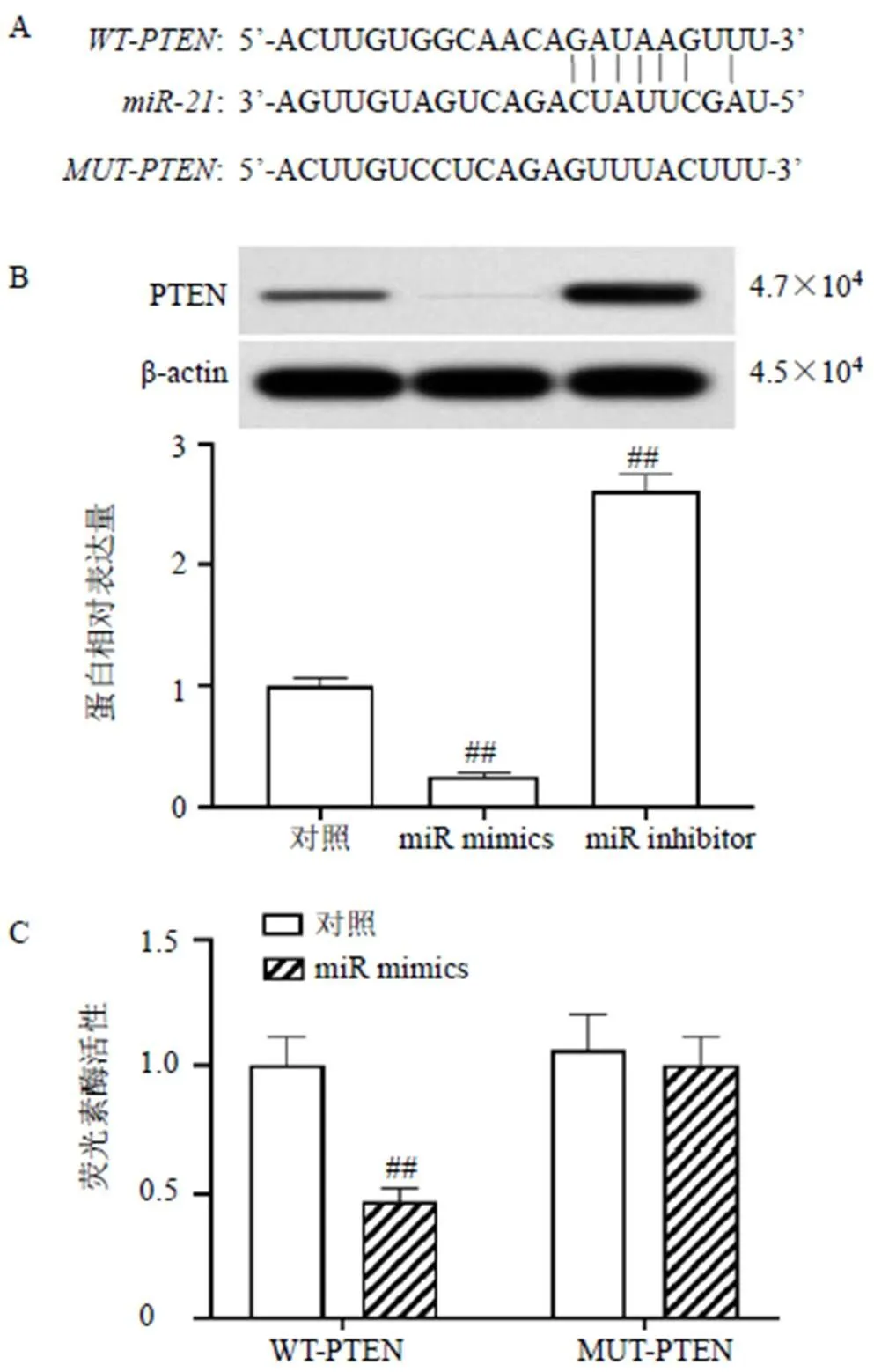
A-miR-21与PTEN mRNA靶向结合位点 B-过表达或抑制miR-21对CCL229细胞内PTEN蛋白表达的影响 C-过表达miR-21对CCL229细胞荧光素酶活性的影响;与对照组比较:##P<0.01
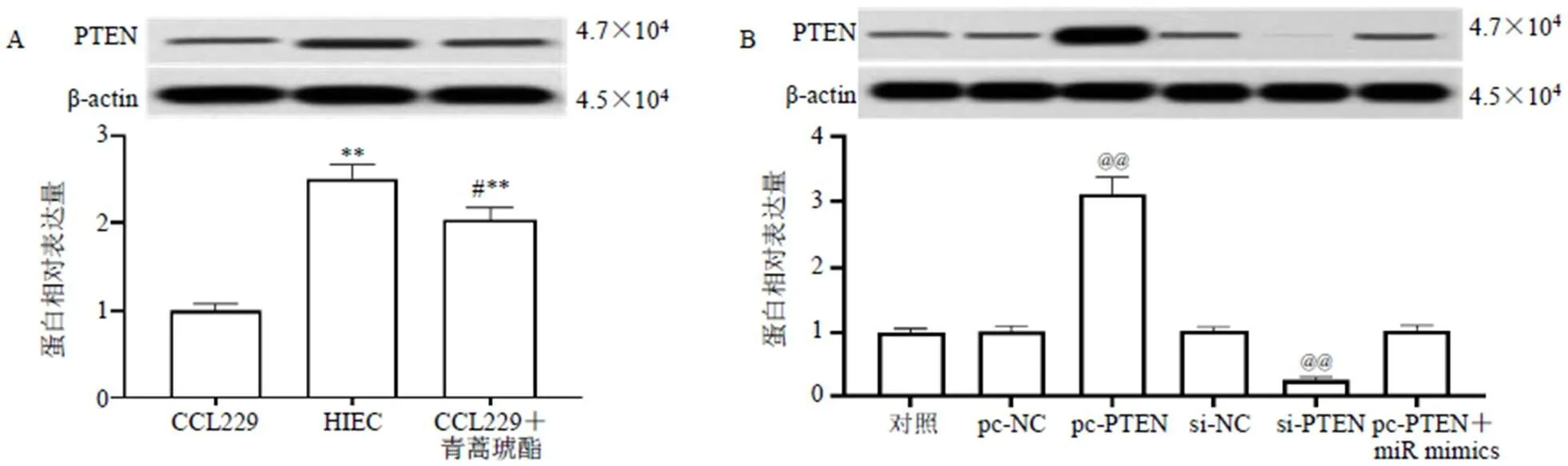
与CCL229细胞比较:**P<0.01;与HIEC细胞比较:#P<0.05;与对照组比较:@@P<0.01
如图9所示,过表达显著增强青蒿琥酯对CCL229细胞存活率的抑制作用(<0.05),抑制显著减弱青蒿琥酯对CCL229细胞存活率的抑制作用(<0.01)。

与青蒿琥酯组比较:*P<0.05 **P<0.01
如图10-A所示,过表达显著增强青蒿琥酯对CCL229细胞的促凋亡作用(<0.05),抑制显著减弱青蒿琥酯对CCL229细胞的促凋亡作用(<0.001)。如图10-B所示,过表达显著增强青蒿琥酯对CCL229细胞侵袭能力的抑制作用(<0.05),抑制显著减弱青蒿琥酯对CCL229细胞侵袭能力的抑制作用(<0.01)。如图10-C所示,过表达显著减弱青蒿琥酯对CCL229细胞克隆形成能力的抑制作用(<0.05),抑制显著减弱青蒿琥酯对CCL229细胞克隆形成能力的抑制作用(<0.05)。
如图11所示,过表达显著增强青蒿琥酯对CCL229细胞自噬特异性蛋白Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ以及EMT相关蛋白ZO-1、E-cadherin表达水平的上调作用(<0.05、0.01),显著增强青蒿琥酯对CCL229细胞N-cadherin和Slug蛋白表达水平的下调作用(<0.01);抑制显著抑制青蒿琥酯对CCL229细胞自噬特异性蛋白Atg5-Atg12复合物、Atg5、Beclin1、LC3-Ⅰ/Ⅱ以及EMT相关蛋白ZO-1、E-cadherin表达水平的上调作用(<0.05、0.01),显著抑制青蒿琥酯对CCL229细胞N-cadherin和Slug蛋白表达水平的下调作用(<0.01)。

与青蒿琥酯组比较:*P<0.05 **P<0.01 ***P<0.001
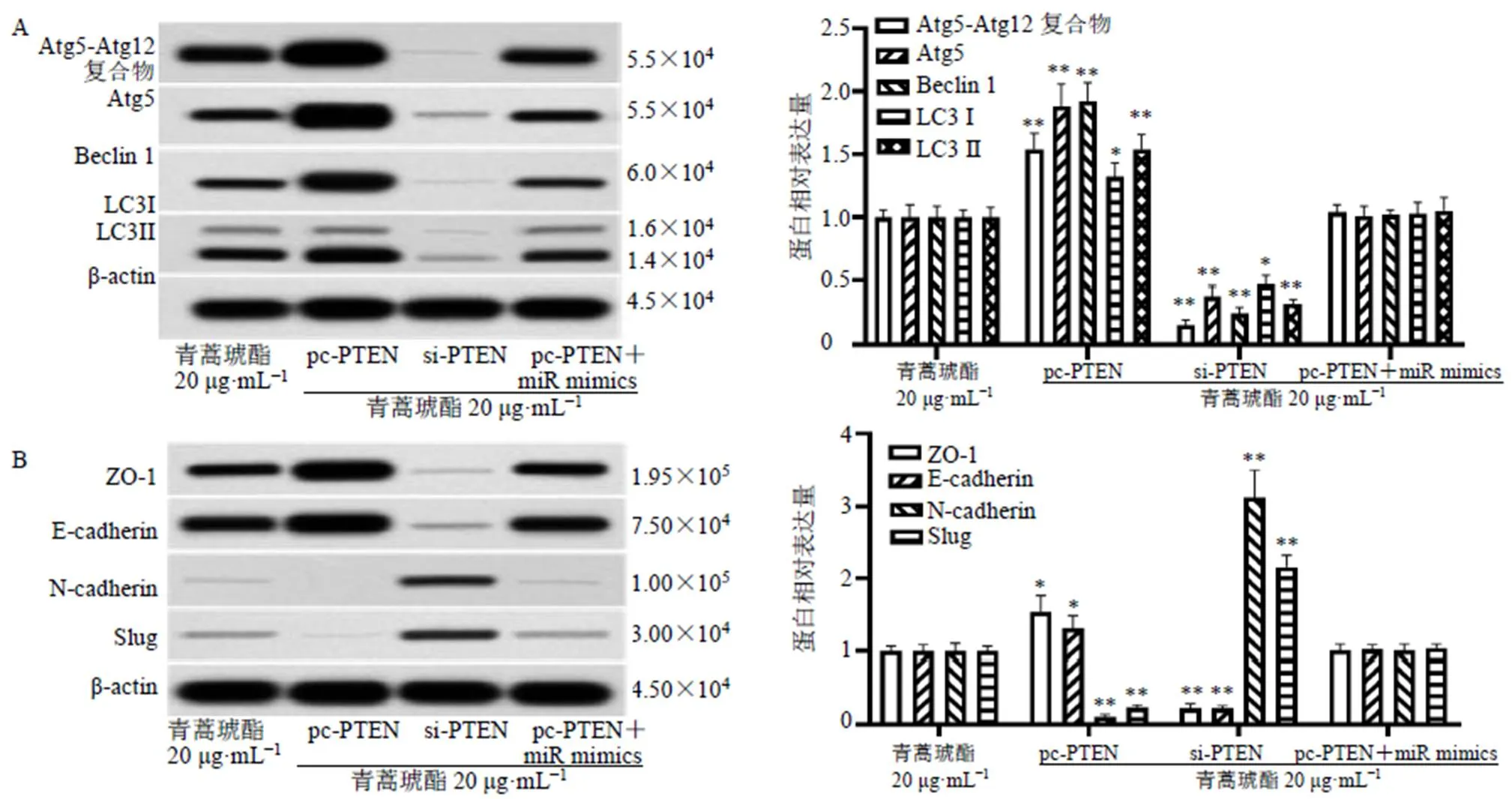
与青蒿琥酯组比较:*P<0.05 **P<0.01
此外,同时过表达和对青蒿琥酯抑制CCL229细胞的恶性生物学行为无显著影响。
4 讨论
青蒿素及其衍生物如蒿甲醚、青蒿琥酯、双氢青蒿素等具有抗疟疾、免疫调节、抗肿瘤等作用[15-17]。Efferth等[10]发现青蒿琥酯对白血病细胞和大肠癌细胞株表现出明显的抑制作用,对黑色素瘤、乳腺癌、卵巢癌、前列腺癌、神经系统肿瘤也有一定程度的抑制作用。本研究结果显示,青蒿琥酯可抑制CCL229细胞存活率,且呈剂量和时间相关性;青蒿琥酯可促进CCL229细胞凋亡,抑制CCL229细胞侵袭和克隆形成能力。大肠癌的复发与转移是影响患者术后生存率的主要因素[18]。大肠癌的转移是多步骤、多因素共同导致的结果,其中EMT发挥重要的作用[19]。EMT的发生涉及多个环节,包括细胞因子和转录因子表达上调、上皮标志物下调、间质标志物上调等[20]。EMT是多种癌症侵袭和早期转移的一个重要过程[21],本研究结果显示,青蒿琥酯显著上调CCL229细胞内ZO-1和E-cadherin蛋白表达水平,显著下调N-cadherin和Slug蛋白表达水平,表明青蒿琥酯能抑制CCL229细胞侵袭,与Transwell实验结果一致。自噬过程是一种细胞内的降解系统,可将细胞质成分递送至溶酶体并参与自噬体的形成,在细胞的发育及对外界刺激的响应中极为重要[22]。自噬过程在乳腺癌[23]、口腔癌[24]、大肠癌[25]等肿瘤的发生和发展中具有重要作用,本研究结果显示,青蒿琥酯显著上调CCL229细胞内Beclin1、LC3-Ⅰ/Ⅱ、Atg5和Atg5-Atg12复合物蛋白表达水平,表明青蒿琥酯能够诱导CCL229细胞发生自噬。此外,本研究发现20 μg/mL青蒿琥酯对CCL229细胞恶性生物学行为的抑制作用优于40 μg/mL 5-氟尿嘧啶。与化疗药物5-氟尿嘧啶相比,青蒿琥酯不会直接杀伤癌细胞,主要通过诱导癌细胞凋亡从而抑制癌细胞的恶性生物学行为。
研究发现,多种在大肠癌细胞株和组织中异常表达,如、、、等在大肠癌组织中呈高表达水平,、、等在大肠癌组织中呈低表达水平[26]。本研究结果显示,相较于HIEC细胞,mRNA在CCL229细胞中表达显著上调,过表达后CCL229细胞对青蒿琥酯的敏感性显著降低,抑制后CCL229细胞对青蒿琥酯的敏感性显著增加,表明参与了CCL229细胞的增殖、凋亡、侵袭及EMT等过程,青蒿琥酯可能通过下调表达,从而抑制CCL229细胞恶性生物学行为。
PTEN是重要的肿瘤抑制基因,PTEN的缺失可能会导致癌症干细胞的恶性增殖或正常干细胞分化能力的丢失[27],本研究发现PTEN蛋白在CCL229细胞中异常下调,过表达可显著增强CCL229细胞对青蒿琥酯的敏感性,抑制可显著抑制CCL229细胞对青蒿琥酯的敏感性,表明大肠癌的发生可能与PTEN表达的缺失具有一定的相关性。Jiang等[28]发现可通过影响表达促进卵巢癌细胞的增殖和侵袭;Lin等[29]发现lncRNA DUXAP8通过负调控PTEN表达促进膀胱癌细胞增殖。本研究通过生物信息学网站预测的下游靶基因,结果显示,是的下游靶基因,且过表达会显著抑制PTEN蛋白在CCL229细胞内的表达。此外,将过表达载体与过表达载体共转染至CCL229细胞内,并不会对青蒿琥酯的敏感性产生显著影响,表明青蒿琥酯可能通过作用于miR-21/PTEN,从而抑制CCL229细胞的恶性生物学行为。
综上,青蒿琥酯通过调控miR-21和PTEN的表达,从而诱导细胞发生凋亡和自噬,并抑制细胞的增殖和侵袭。
利益冲突 所有作者均声明不存在利益冲突
[1] Greathouse K L, White J R, Padgett R N,. Gut microbiome meta-analysis reveals dysbiosis is independent of body mass index in predicting risk of obesity-associated CRC [J]., 2019, 6(1): e000247.
[2] Marks K M, West N P, Morris E,. Clinicopathological, genomic and immunological factors in colorectal cancer prognosis [J]., 2018, 105(2): 99-109.
[3] Fang L, Jiang Y, Yang Y X,. Determining the optimal 5-FU therapeutic dosage in the treatment of colorectal cancer patients [J]., 2016, 7(49): 81880- 81887.
[4] Correia de Sousa M, Gjorgjieva M, Dolicka D,. Deciphering miRNAs’ action through miRNA editing [J]., 2019, 20(24): 6249.
[5] Zhou X, Lu Z P, Wang T S,. Plasma miRNAs in diagnosis and prognosis of pancreatic cancer: A miRNA expression analysis [J]., 2018, 673: 181-193.
[6] Wasik M A. Distinct miRNA profile in prognosis of early CTCL [J]., 2018, 131(7): 711.
[7] Hao J P, Ma A. The ratio of miR-21/miR-24 as a promising diagnostic and poor prognosis biomarker in colorectal cancer [J]., 2018, 22(24): 8649-8656.
[8] Ding T, Cui P P, Zhou Y,. Antisense oligonucleotides against miR-21 inhibit the growth and metastasis of colorectal carcinoma via the DUSP8pathway [J]., 2018, 13: 244-255.
[9] Adebayo J O, Tijjani H, Adegunloye A P,. Enhancing the antimalarial activity of artesunate [J]., 2020, 119(9): 2749-2764.
[10] Efferth T, Rücker G, Falkenberg M,. Detection of apoptosis in KG-1a leukemic cells treated with investigational drugs [J]., 1996, 46(2): 196-200.
[11] Papanikolaou X, Johnson S, Garg T,. Artesunate overcomes drug resistance in multiple myeloma by inducing mitochondrial stress and non-caspase apoptosis [J]., 2014, 5(12): 4118-4128.
[12] Trimble C L, Levinson K, Maldonado L,. A first-in-human proof-of-concept trial of intravaginal artesunate to treat cervical intraepithelial neoplasia 2/3 (CIN2/3) [J]., 2020, 157(1): 188-194.
[13] Pirali M, Taheri M, Zarei S,. Artesunate, as a HSP70 ATPase activity inhibitor, induces apoptosis in breast cancer cells [J]., 2020, 164: 3369-3375.
[14] Wang Z Z, Wang C, Wu Z Y,. Artesunate suppresses the growth of prostatic cancer cells through inhibiting androgen receptor [J]., 2017, 40(4): 479-485.
[15] Ji P, Wang L, Wang S Q,. Hyaluronic acid-coated metal-organic frameworks benefit the ROS-mediated apoptosis and amplified anticancer activity of artesunate [J]., 2020, 28(10): 1096-1109.
[16] Hamoya T, Fujii G, Iizumi Y,. Artesunate inhibits intestinal tumorigenesis through inhibiting wnt signaling [J]., 2021, 42(1): 148-158.
[17] 费伟东, 叶轶青, 陈玥, 等. 双氢青蒿素诱导肿瘤细胞铁死亡及其机制研究 [J]. 中草药, 2020, 51(13): 3473-3481.
[18] Qi L, Song F Y, Ding Y Q. Regulatory mechanism of ITGBL1 in the metastasis of colorectal cancer [J]., 2020, 10: 259.
[19] Li Q Y, Lai Q H, He C C,. RUNX1 promotes tumour metastasis by activating the Wnt/β-catenin signalling pathway and EMT in colorectal cancer [J]., 2019, 38(1): 334.
[20] Siraj A K, Pratheeshkumar P, Divya S P,. TGFβ-induced SMAD4-dependent apoptosis proceeded by EMT in CRC [J]., 2019, 18(7): 1312-1322.
[21] Saitoh M. Involvement of partial EMT in cancer progression [J]., 2018, 164(4): 257-264.
[22] Yan X J, Zhou R M, Ma Z Y. Autophagy-cell survival and death [J]., 2019, 1206: 667-696.
[23] Ulasov I V, Borovjagin A V, Timashev P,. KISS1in breast cancer progression and autophagy [J]., 2019, 38(3): 493-506.
[24] Lin F, Gao L, Su Z Y,. Knockdown of KPNA2 inhibits autophagy in oral squamous cell carcinoma cell lines by blocking p53 nuclear translocation [J]., 2018, 40(1): 179-194.
[25] Wang Y F, Zhang S Y, Dang S W,. Overexpression of microRNA-216a inhibits autophagy by targeting regulated MAP1S in colorectal cancer [J]., 2019, 12: 4621-4629.
[26] 胡婷, 陈梅香, 闫雍容, 等. miR-21在大肠癌细胞迁移和侵袭中的作用及机制探讨 [J]. 山东医药, 2012, 52(31): 7-10.
[27] Zhang B G, Zhang X B, Jin M,. CagA increases DNA methylation and decreases PTEN expression in human gastric cancer [J]., 2019, 19(1): 309-319.
[28] Jiang J H, Lv Q Y, Yi Y X,. MicroRNA-200a promotes proliferation and invasion of ovarian cancer cells by targeting PTEN [J]., 2018, 22(19): 6260-6267.
[29] Lin M G, Hong Y K, Zhang Y,. Mechanism of lncRNA DUXAP8 in promoting proliferation of bladder cancer cells by regulating PTEN [J]., 2018, 22(11): 3370-3377.
Inhibitory effect of artesunate on malignant biological behavior of human colorectal cancer CCL229 cells through miR-21/PTEN pathway
GONG Hui-jie, TANG Jian-rong, YAO Lan-jie, FENG Peng-fei
Department of Gastroenterology, Zhumadian Central Hospital, Zhumadian 463000, China
To explore the mechanism of inhibitory effect of artesunate on malignant biological behavior of human colorectal cancer CCL229 cells.MTT method was used to detect the effect of artesunate on viability of CCL229 cells; Flow cytometry was used to detect the effect of artesunate on apoptosis of CCL229 cells; Transwell method was used to detect the effect of artesunate on invasion of CCL229 cells; Clone formation experiment was used to detect the effect of artesunate on colony forming ability of CCL229 cells; Western blotting was used to detect the effects of artesunate on expressions of intracellular autophagy-specific proteins such as autophagy effector protein (Beclin1), light chain 3-Ⅰ/Ⅱ protein (LC3-Ⅰ/Ⅱ), autophagy related protein 5 (Atg5), Atg5-Atg12 complex, and epithelial-mesenchymal transition (EMT) related proteins such as tight junction protein (ZO-1), epithelial cadherin (E-cadherin), neuronal cadherin (N-cadherin), zinc finger transcription factor (Slug) and phosphatase and tensin homolog deleted on chromosome ten (PTEN) in CCL229 cells; qRT-PCR was used to detect the effect of artesunate on expression ofmRNA in CCL229 cells; The dual luciferase reporter gene experiment was used to verify the targeting relationship betweenand; Effect of overexpression or inhibition ofandon biological behavior of artesunate in inhibiting CCL229 cells was investigated.Artesunate significantly inhibited the survival rate of CCL229 cells (< 0.05, 0.01, 0.001), promoted the apoptosis of CCL229 cells (< 0.001), inhibited CCL229 cell invasion and clone formation ability (< 0.001), up-regulated the expressions of Atg5-Atg12 complex, Atg5, Beclin1, LC3-Ⅰ/Ⅱ, ZO-1, E-cadherin in CCL229 cells (< 0.05, 0.01), and significantly down-regulated the expressions of N-cadherin and Slug (< 0.05). The expression ofmRNA in CCL229 cells was high (< 0.01), artesunate significantly inhibited the expression ofmRNA in CCL229 cells (< 0.05). Overexpression ofsignificantly inhibited the pro-apoptotic effect of artesunate on CCL229 cells (< 0.001), weakened the inhibitory effect of artesunate on CCL229 cell invasion and clonal formation (< 0.01), inhibited the up-regulation of artesunate on expressions of Atg5-Atg12 complex, Atg5, Beclin1, LC3-Ⅰ/Ⅱ, ZO-1, and E-cadherin in CCL229 cells (< 0.05, 0.01), and significantly inhibited the down-regulation of artesunate on expressions of N-cadherin and Slug protein in CCL229 cells (< 0.01); The inhibition ofexpression had the opposite effect.was the downstream target gene of. Overexpression ofsignificantly inhibited the expression of PTEN in CCL229 cells (< 0.01), the inhibited expression ofsignificantly upregulated the expression of PTEN (< 0.01), overexpression ofsignificantly inhibited the luciferase activity of wild-type PTEN (WT-PTEN) plasmid (< 0.01). Overexpression ofhad the same effect with inhibition ofexpression on CCL229 cells, while overexpression ofanddid not affect the inhibitory effect of artesunate on malignant biological behavior of CCL229 cells.Artesunate can induce apoptosis, autophagy and inhibit cell proliferation and invasion of CCL229 cells by regulating the expression of miR-21 and PTEN.
colorectal cancer; artesunate; miRNA; proliferation; invasion; epithelial-mesenchymal transition; autophagy; apoptosis
R285.5
A
0253 - 2670(2021)08 - 2331 - 12
10.7501/j.issn.0253-2670.2021.08.016
2020-12-22
河南省高等学校重点科研计划项目(20A320085)
巩会杰(1980—),女,硕士,主治医师,从事肝病、炎症性肠病、急性胰腺炎、消化道肿瘤等研究。Email: zmdgonghuijie@126.com
[责任编辑 李亚楠]

