超声联合微泡增强细胞内药物递送的研究进展∗
范真真 张苏妍 张美如 王裕琳
(天津大学精密仪器与光电子工程学院 天津 300072)
0 引言
细胞是最小的生命单元。将功能性的生物分子或者材料递送到目标细胞内,是解码细胞功能、改变细胞命运以及重新编码细胞行为的重要一步。正是由于细胞内递送在基础科学研究和临床治疗上的重要价值,为了实现这一过程,众多的物理、化学和生物方法被开发出来。Stewart等[1]近期的综述对所有以干扰细胞膜为基础的细胞药物递送技术进行了完整的论述。超声和微泡联合使用,通过微泡的声空化与细胞膜的相互作用,实现靶向的细胞内药物递送。超声是一种体外施加的、具有良好的组织穿透深度、时空高度可控的物理能量。而作为超声造影剂的微泡已经在临床上得到广泛应用,因此超声联合微泡的细胞内药物递送技术在临床应用方面具有独特的优势。
1997年,Miller教授的研究组首次报道了超声和超声造影剂微泡联合使用显著增加了质粒DNA对细胞的转染效率[2],从而开启了超声联合微泡增强药物靶向递送的研究方向。在Web of Science以“ultrasound”、“microbubble”和“delivery”为关键词,搜索到的文章数目随年份的关系如图1所示。在20余年的发展进程中,现象发现和机理阐释贯穿始终。从研究对象来说,从体外细胞试验逐渐进入动物实验,并于2013年首次进入了临床试验;从技术发展的角度来说,不断丰富微泡的功能性以及提高超声对微泡声学响应的可控性是近年来的研究重点。本文围绕超声联合微泡实现药物递送的发生机理,综述了近年来的研究进展,并就未来的发展提出了作者的几点建议和思考。
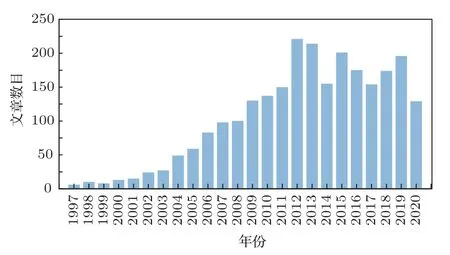
图1 Web of Science以“ultrasound”、“microbubble”和“delivery”为主题的文章数目与年份关系Fig.1 The number of papers on“ultrasound”,“microbubble”and“delivery”versus years in Web of Science
1 微泡的声学动态响应
微泡在细胞旁发生的声空化是增强细胞内药物递送的物理基础。超快速照相机的直接观测,清晰地展示了单个微泡在稳态空化时发生的微泡壁的周期性振动,及其对细胞膜周期性地挤压[3](图2(a));在瞬态空化时微泡壁剧烈振动甚至破碎、崩塌[4](图2(b))或形成高速微流体喷流[5](图2(c)),这些剧烈的冲击会使细胞膜局部下凹、形成小孔甚至死亡。微泡空化时在周围空间会形成微流体流(图2(d)),从而对附近的细胞膜施加剪切力[6−7]。当有多个微泡比邻时,在次级声辐射力的驱动下,微泡会聚集,甚至融合为更大的微泡(图2(e)),可能进一步降低周围细胞的存活率[8−9]。

图2 微泡的几种不同的声学动态响应Fig.2 Several different acoustic dynamic responses of microbubbles
在稳态空化时,自由的气体小泡的半径随时间的振动可以用Rayleigh-Plesset公式进行描述[10];加入了微泡膜结构的流变性的物理模型,更为准确地描述了具有膜结构的现代微泡在声场中的振动[11]。Forbes等[12]提出了理论模型及实验观测,表明了微泡空化形成的微流对细胞膜的剪切力可以导致声孔效应。Guo等[13]通过使用边界单元法,把微泡和细胞视为液体中的球体,对微泡与细胞的相互作用过程进行了系统的理论研究。Yang等[14]近期的综述围绕微泡与微泡的相互作用,系统讨论了微泡、细胞的物理参数,超声参数、细胞微环境等对药物递送效果的影响。微泡在细胞或者黏弹性各异的生物物质旁发生空化现象,从而实现增强细胞内药物递送的目的。Dollet等[15]近期的综述从理论到实验观测回顾了生物物质的存在对微泡声学动态响应的影响。
对微泡膜的修饰,进一步增强了微泡的功能性,可以实现微泡对目标细胞的靶向附着,或者成为药物的载体,实现药物的靶向释放。Kooiman等[16]使用超高分辨显微成像观测了不同化学成分的膜所包裹的微泡,与基质相连所形成的不同的附着面积和形变。Rong等[17]使用了独特的成像策略,观察到了靶向微泡与细胞相连后,所呈现出的6种不同的形态,如图3(a)所示。图3(a)中第一行代表靶向微泡与细胞相连的形态的示意图,第二行代表两通道叠加的荧光图像,第三行代表每种形态对应的边界检测结果。在大多数情况下,靶向微泡会有一小部分黏附在细胞膜上,这使得微泡在超声激励下不能进行各向同性的球面振动。Lajoinie等[18]提出了非球面、轴对称的数学模型,描述了靶向微泡在声场中的体积振动,如图3(b)所示。图3(b)中的上图为相同微泡大小(R0=2.4µm)和不同压力(kPa)(颜色)下,塌缩阶段的尖端的形状(左图),z表示在微泡形状的不同位置高度,r表示微泡对应位置z的横切面半径。磷脂表面积S的是仰角θ的函数(右图);下图为具有不同初始半径R0的靶向微泡在210 kPa压强驱动下的模拟形状。该模型被用于预测加载在微泡膜上的药物分子随微泡振动而释放的过程。Baresch等[19]实现了单束涡旋声场在复杂环境中对微泡的捕获和操控,以及微泡振动而导致的可控的载药释放。

图3 靶向微泡形态及振动模拟Fig.3 Morphology and oscillation simulation of targeted microbubbles
2 细胞响应
2.1 细胞膜上出现瞬态、可逆的小孔
当较为剧烈的声空化发生在细胞附近时,会在细胞膜上打开小孔。小孔的形成首先是在超声作用后迅速固定的细胞上得到证实。Prentice等[5]使用原子力显微镜,观察到了细胞上直径为16µm的小孔(图4(a))。Schlicher等[20]以及Qiu等[21]使用扫描电镜和透射电镜,观察到了细胞膜上直径在1µm左右的小孔(图4(b))。随后,一些实时技术被引入到了声孔的观测中。Zhou等[22]和Fan等[23]使用全细胞膜片钳,监测整个细胞的过膜电流的实时变化。当有小孔打开时,过膜电流会突然增大,而后随着小孔的闭合而逐渐减小直至恢复为零;并通过对过膜电流的拟合,估算出可逆小孔的直径在10~200 nm(图4(c))。Hu等[24]使用共聚焦荧光显微成像,对荧光染色的细胞膜进行了实时直接观测;观察到了直径为5.3µm的可逆小孔(图4(d))。
Prentice等[5]使用原子力显微镜观察到了深为1µm的小孔,以及一些穿透细胞直达基质的孔。Helfield等[7]使用实施共聚焦荧光显微镜观察到了空化所致的小孔穿透了细胞的上下表层。Rong等[25]在超声作用后迅速固定的细胞中观察到了细胞核内、细胞底部都出现了质粒DNA。这些结果表明,小孔的深度可以穿透整个细胞。
在声空化作用下,质膜上孔是否发生以及发生位置会受到微泡大小和微泡与细胞之间距离的影响[26−27]。不同的细胞之间距离与微泡直径的相对大小对应于不同的膜穿孔效率[26,28−30]。因此,改变膜穿孔效率可以通过调整微泡与细胞之间的距离(d)与微泡大小(D)的比值(d/D)来实现[26,28−30]。除了改变超声发生模式外,也可以采用利用配体或抗体修饰微泡的方式,即将被修饰的微泡与细胞表面受体相结合进而改善输送效率。该方式作为应用于靶向药物输送的新的途径,具有相当大的临床治疗价值。
小分子物质碘化丙啶是不可渗透细胞膜的,在细胞外不显荧光;当它进入细胞与核酸结合后,会显示出红色荧光。碘化丙啶的这种荧光特性使其成为实时指示细胞膜上的小孔的理想指示剂,在声孔效应的机理性研究中广泛使用。碘化丙啶的实时荧光显微成像显示,在空化现象发生后,细胞膜上的小孔随即迅速打开,之后逐渐收缩至闭合;成功闭合的过程一般在100 s之内[7−8,17,23,30−31]。全细胞膜片钳记录过膜电流,比荧光成像具有更高的时间分辨率(0.5 ms),但是由于超声振动极易振掉膜片钳与细胞膜形成的紧密吸附,限制了膜片钳的记录能力。Zhou等[22]和Fan等[23]使用全细胞膜片钳记录到的小孔成功闭合发生在10 s之内。Hu等[24]对荧光染色的细胞膜进行了实时直接观测,结果显示小孔成功闭合的过程在50 s之内。总之,小孔的直径、位置、深度和闭合时间由多种因素共同决定,包括超声参数[32]、微泡特性[8]、微泡和细胞的距离[29,33]等。这些小孔的存在增加了血管通透性,有助于膜上药物的转移。
关于小孔闭合的机制,多项研究表明[34−36],钙离子经小孔流入细胞内是小孔成功闭合的必要条件。Leow等[35]观察到在靶向微泡附着的位置,在超声作用后,仅在存活的细胞的细胞膜上出现起泡的现象,因此推测细胞膜的起泡是帮助细胞恢复平衡状态的方式。声孔尺寸很小,且在存活的细胞中是瞬态存在,这给研究小孔闭合的生物学机制提出了不小的挑战。作为一种机械损伤,声孔很可能也是经历扩张、收缩和闭合3个阶段;细胞经历感知小孔、修复小孔、闭合小孔和重塑细胞膜及细胞骨架的过程;修复过程可能由钙肌动蛋白和肌球蛋白驱动,由细胞膜的流动性、内吞、胞吐作用参与完成[37]。小孔的闭合能够实现是保证细胞维持活性的必要条件,对于临床应用来说也是保证超声联合微泡技术应用的安全性和实用性的必然要求。
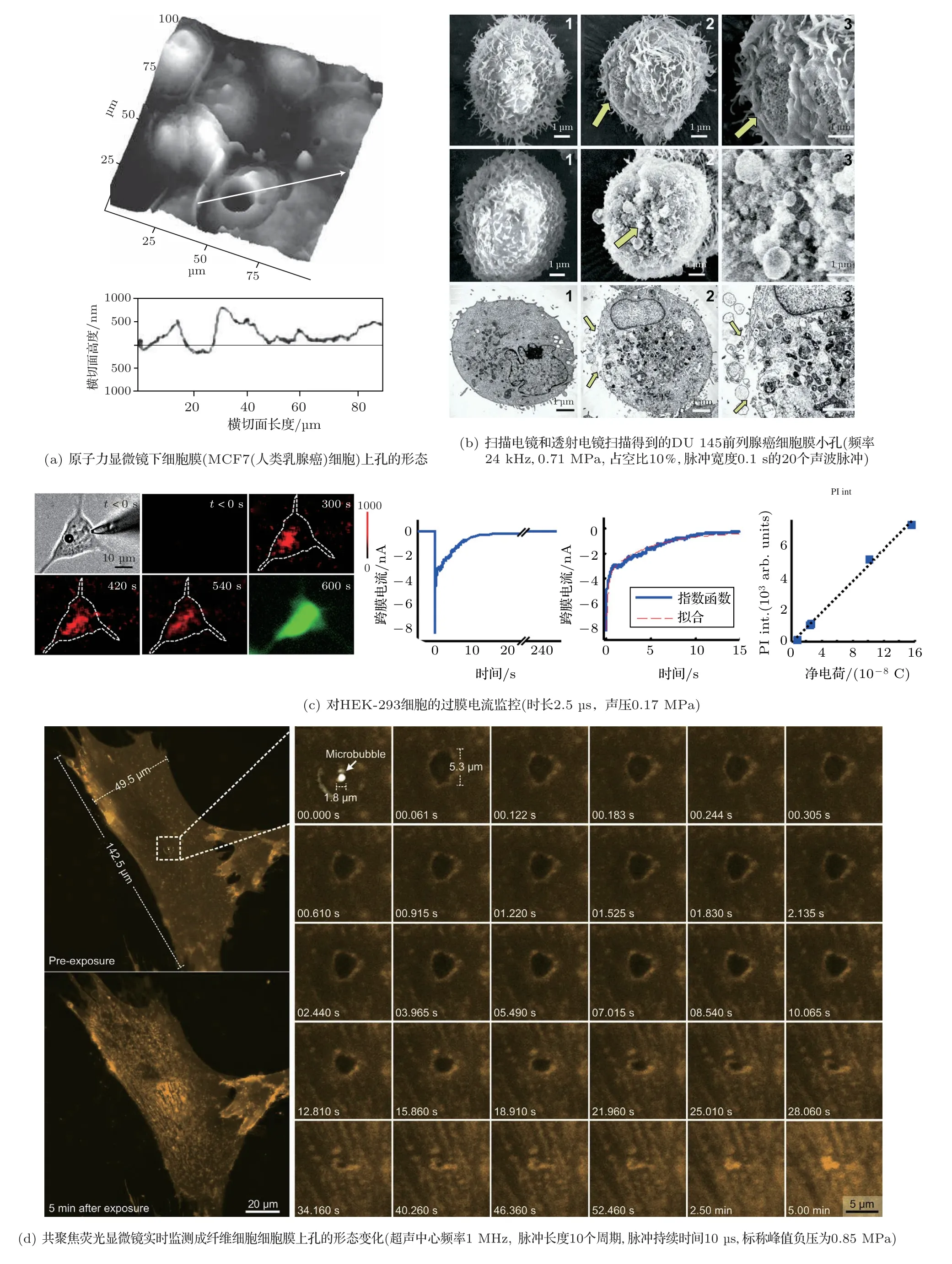
图4 细胞膜上小孔的形态和实时监测Fig.4 Morphology and real-time monitoring of the pores on the cell membrane
2.2 其他细胞层响应
当有小孔打开时,实时荧光显微成像可观察到同时发生的自小孔流入的钙离子流。由于细胞内外存在的巨大的自由钙离子浓度的差异(细胞培养液的钙离子浓度为0.9 mM,细胞内的钙离子浓度在100 nM以下),在浓度梯度的驱使下,钙离子迅速的从小孔进入细胞,在5~10 s内达到浓度峰值,之后逐渐恢复到平衡态(大约100 s左右)[23,38]。随后,与发生声孔效应相邻的一些细胞会出现延迟的、峰值更小的钙离子浓度的波动(即细胞间的钙波)[23,38]。钙离子是重要的第二信使,参与诸多细胞功能的调控,因此声孔效应所引发的钙波有可能参与较为长期、更大范围的生物效应的调控。
细胞骨架与细胞膜相连,是贯穿整个细胞的重要细胞结构。细胞骨架为细胞提供机械强度和力学支撑,在维持细胞形态、实现细胞形变和迁移和细胞内物质运输等方面发挥着重要作用。Chen等[39]、Fan等[31]以及Wang等[33]都观察到声孔效应迅速引发细胞骨架的分解,从声孔处发展到整个细胞,即使细胞存活下来,细胞骨架在很长时间内(60 min)未能恢复。
当细胞受到空化作用刺激时,内吞作用被触发。一方面,如前文所述,内吞作用促进了膜的重新闭合,另一方面空化刺激的内吞作用也被认为是一种主动传递途径,大分子物质可以被吸收进入细胞。但由于内吞作用的触发主要与声空化作用刺激相关的生物或/和物理信号有关,从而引起细胞本身活跃的行为,因此很难得到内吞作用与微泡作用域之间的空间关系。
内皮细胞间往往通过多种蛋白质大分子相互连接,而其中部分种类的蛋白质又往往与细胞内的细胞骨架相连。空化作用可能会引起膜穿孔,进而引起细胞骨架、内皮间连接(包括紧密连接、黏附连接和间隙连接)和黏着斑的变化,并且这一过程中可能伴随着细胞的收缩。在这些生物效应的影响和作用下,内皮间隙形成[26]。内皮间隙的形成往往可以改变血管的完整性,便于大分子物质输送到血管外组织中。除此之外,像声空化作用下细胞膜小孔的打开和封闭一样,内皮细胞之间的连接也存在恢复机制。这一机制也为暂时打开血脑屏障(Blood brain barrier,BBB)提供了可能[40]。内皮细胞间连接的打开和恢复的程度和动力学既取决于超声联合微泡作用的模式和强度也包括微泡与细胞相对位置关系。但是,由于技术原因,目前对于声空化与内皮细胞间隙变化的动力学之间的关系了解仍不足[26]。除了以上提到可逆小孔的形成、钙离子内流、细胞骨架的分解和打开细胞与细胞间的连接以外,细胞对声穿孔的响应也包括活性氧族(Reactive oxygen species,ROS)的释放[26]。2018年,Jia等[41]发现声孔作用下细胞中的ROS水平与声穿孔程度有关。Qin等[26]近期的综述中对声空化引发的生物效应进行了全面的回顾。
3 细胞外物质进入细胞的动态过程
不可渗透细胞膜的小分子物质,如碘化丙啶(分子量668 Da),进入细胞的方式是通过在细胞膜上打开的瞬态的小孔,在浓度梯度的驱动下流入细胞内部[7,38]。进入细胞内的小分子物质往往呈连续均匀分布,如图5(a)所示。小孔闭合后,其在细胞内分布的动态变化可以用二维无源扩散问题进行拟合,在几分钟之内达到平衡状态[23]。通过小孔是不可渗透细胞膜的小分子物质经声空化介导进入细胞的最主要的方式(小分子物质的进入位置与微泡的位置完全对应,且没有微泡处没有小分子物质的进入)。而随着细胞外物质的分子量的增加(如分子量为4 kDa和2 MDa的右旋糖苷,直径分别约为1.23 nm和32.78 nm),在经过超声和微泡作用后,其进入细胞的总量逐渐减少,其在细胞内的分布越来越不均匀,呈现出离散的斑点状,与微泡位置的对应关系逐渐减弱[20,32,42](图5(b))。
质粒DNA是环状DNA链,一般有多于1000个碱基对,分子量大于1 MDa,直径大约在几百纳米。与小分子物质相比,质粒DNA在空化作用下进入细胞的方式更为多样,有效的进入时间更长。Mehier-Humbert等[43]观察到与脂质转染(借助内吞作用)相比,超声和微泡作用后,质粒DNA快速地大量地出现在细胞质中(因此作者推测是由小孔进入),但是没有保护的质粒DNA也更快地被DNA酶降解。Liu等[44]观察到了约30%的质粒DNA在超声和微泡作用后30 min以离散的斑点状出现在细胞(包括细胞核)中。Rong等[25]捕捉到在有靶向微泡附着的位置上,质粒DNA正在跨越细胞膜(图5(c)),证明了小孔是质粒DNA进入细胞的一种可行途径;同时还观察到细胞内有多处的质粒DNA与微泡的位置无关,且在较低声压,无声孔效应的条件下,也有质粒DNA快速的进入到细胞内。因此该论文得出结论超声和微泡介导的质粒DNA进入细胞的过程是一个快速的、发生在全细胞尺度的、激发多种过膜机制的(打开小孔、内吞作用和尚未阐明的快速全细胞尺度的进入方式等)动态过程。

图5 不同尺寸物质进入细胞的过程Fig.5 The process of substances of different sizes entering the cell
4 临床试验的进展
癌症组织一般具有致密的结缔组织基质,不仅压迫血管减少了血液灌流[45](从而减少了药物输送),而且使得药物难以穿透基质抵达癌细胞[46]。此外由于癌细胞的无限增殖,癌组织内部的渗透压升高[47],进一步抑制了基于扩散的药物递送。癌组织的这些病理特点严重降低了化疗药物的递送效率。化疗药物主要的作用机制是抑制细胞生长、诱导细胞凋亡,因此对正常细胞具有较大的副作用。靶向给药技术与化疗药物的联合使用,能够增强癌组织对化疗药物的摄取,同时降低化疗药物对全身健康细胞的副作用,因此靶向给药技术对于基于化疗的癌症治疗具有重要的临床应用价值。
增厚的、致密的和药物几乎无法穿透的基质是胰腺癌的显著特征,迫切需要靶向给药技术增强化疗效果。2013年,Kotopoulis等[48]报道了超声、微泡、吉西他滨针对胰腺癌的联合使用,结果显示该疗法增加了患者耐受化疗的周期数,延长了患者的生存期。2016年,Dimcevski等[49]开展了超声、微泡、吉西他滨联合使用治疗胰腺癌的临床试验,评估了治疗的安全性、潜在毒性以及患者的中位生存期,证实了该疗法不会引起额外的毒性或增加化疗药物原有的副作用,延长了患者的寿命,如图6所示。2018年,Wang等[50]报道了一项在我国开展的针对胰腺癌肝转移患者,采用超声、微泡和化疗药物联合使用的临床研究,未引发患者产生其他毒副作用,表明该疗法具有良好的安全性。目前,更大规模的临床试验正在我国开展中。
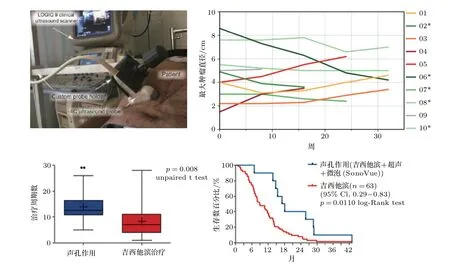
图6 利用超声和微泡治疗胰腺癌的临床试验Fig.6 Clinical trial using ultrasound and microbubbles in the treatment of pancreatic cancer
在进行脑部疾病的药物治疗时,血脑屏障的存在是药物进入脑部患处的巨大障碍。超声联合微泡技术凭借其可实现声空化的特点能够短暂和局部打开血脑屏障,为解决这一问题提供了新的选择[51]。同时,这也为靶向输送化疗药物到脑部肿瘤处提供了新的途径。目前已经进行了大量的预临床实验,例如2013年,Fan等[52]通过将抗恶性神经胶质瘤药1,3-双(2-氯乙基)-1-亚硝基脲(BCNU)封装在与VEGF-A配体偶联的靶向微泡中,实现靶向药物的输送和释放,减少了肿瘤发展;2014年,Burke等[53]将纳米粒子(Nano-particles,NP)药物载体偶联到MBs形成MB-NP复合剂(MB-NP composite agents,MNCA),改善了纳米载体的递送并且在超声的作用下增加了NP向肿瘤的递送,抑制了肿瘤生长,小鼠存活率显着提高。临床试验也正在进行中,2016年,Carpentier等[54]开展的临床试验中证明了脉冲超声联合微泡技术对于复发成胶质细胞瘤患者是安全且耐受性良好的。
除了利用超声联合微泡技术研究胰腺癌和脑肿瘤之外,人们也将目光投向其他癌症希望能够通过这项技术实现抗肿瘤药物的增敏效果,提高化疗药物对肿瘤组织的杀伤效果。目前针对于原发性结肠癌导致的肝转移和乳腺癌患者的临床试验也正在进行中[51]。
超声和微泡的联合使用是一项具有广泛应用性的靶向给药技术,除了用于增强化疗药物的靶向提送、提高癌症治疗效果以外,其他活跃的研究领域还包括:用于增加血脑屏障的通透性,提高针对神经和精神类疾病药物在大脑的富集;促进针对心血管疾病药物的靶向递送;增加血管-脊髓屏障的渗透性,提高药物进入脊髓的效率;增加药物的经皮给药效率等。Stride等[55]近期的综述对超声联合微泡在临床应用中的进展进行了回顾。
5 总结与展望
超声联合微泡增强药物递送技术经过20余年的发展,在微泡声空化的物理机制、细胞的各种生物响应、药物进入细胞的动力学特征等方面均取得了丰富的研究成果,使得人们对该技术发生机理的认知不断加深。目前,该技术已经进入临床试验的阶段,安全性和有效性得到了初步的验证。
围绕机理性研究,作者有以下几点建议和思考。(1)在更为接近体内环境的实验条件下开展机理性研究。目前已有的机理性研究中所用的细胞均为悬浮状态或为附着于硬质基底上的单细胞层。这与细胞的体内生存状态(如附着在细胞外基质上、暴露在一定的物理化学分子条件中、与组织中其他细胞相互作用等)相差很大。而且体内具有复杂的三维结构。以癌症治疗为例,经静脉注射进入血液循环后,微泡需要首先在目标组织中跨越血管壁(同时尽量避免出血),穿越细胞外基质后,抵达癌细胞。随后,微泡在超声照射下,增加癌细胞的通透性。随着组织工程、生物材料、3D打印等技术的发展,构建出能够反映体内三维结构的体外组织模型,并在其中开展机理性研究,将大大推进人们对于该技术在体内的发生机理的认识,更好地指导临床试验中治疗策略的制定、参数设计等工作,提高治疗效果。(2)深入研究在稳态声空化下更为广泛的生物效应。由于临床应用的基础是保障安全(尽量避免出血、健康组织不可逆的损伤等),因此临床应用更青睐安全性更好的较低的超声照射。目前已有的机理性研究多聚焦于声孔效应,未来可加大在较低超声强度下稳态声空化引发的更为广泛的生物效应,比如激发免疫细胞活性、抑制癌细胞癌变进程或者迁移能力和降低癌组织基质细胞的分泌能力等。这些生物效应可能是间接但安全有效地增强药物靶向递送的途径。(3)探究减小声空化所带来的不良生物效应的措施。在将超声联合微泡的靶向给药技术不断向临床应用推进的进程中,大量细胞死亡、出血等是超声空化所引起的各种不良生物效应[26,56]。除了调整微泡剂量和超声参数来减小不良生物效应外,也可以采用缩短空化作用下膜孔的开启和闭合的窗口时间的方法。该方法有助于提高基于声孔效应的药物递送的效率和安全性[26]。例如,可以考虑从生化角度去影响膜闭合,利用细胞内Ca2+水平触发细胞的内吞和胞吐作用进而促进膜孔封闭的特点,来影响Ca2+相关的信号通路[26]。此外,采用更小的微泡也有可能减小不良生物效应。与作用于细胞和组织微米级小泡相比,直径在1µm以下的纳米小泡可以渗透过血管壁,并可能在癌组织基质中有更深的渗透深度,因此很有可能能够减少出血。纳米级微泡的制备技术在近年来发展很快。纳米级小泡尺寸过小,且包含气体,因此在发展之初难以观察和研究其动态响应等。关注纳米级微泡的声学响应及药物递送机理是十分必要的。相信成像技术的快速发展必将允许人们对纳米级小泡的声学响应及药物递送机理开展更为深入的研究。
与此同时,一些新的工程方法的引入,扩展了基于声空化的细胞药物递送的实现方式,推进了其向着高度可控、高通量的体外细胞转染技术的方向发展。Li等[57]利用声子晶体增强的近壁声流实现了可逆的声孔效应。Belling等[58]利用在毛细管中的声流实现了高通量的基于声孔效应的向多种人类细胞的基因转染。
总之,作为一项非侵入式的、非病毒的药物递送技术,超声和微泡的联合使用在临床应用上具有独特的优势(具有良好的靶向性、可实现实时图像引导等)。经过20余年的发展,人们已经在其发生机理上积累了相当的认知。同时也应该客观地认识到,目前的临床试验结果和理想的治疗效果之间还存在很大差距。未来,需要在临床医生、物理学家、化学家和生物学家的共同努力下,不断提高该技术的安全性、靶向性和有效性,最终使患者受益。

