冷休克处理提高嗜酸乳杆菌的冻干存活率
王晓萌,甄 妮,田启远,叶聪艳,曾小群*,潘道东,陈小虎
(1 省部共建农产品质量安全危害因子与风险防控国家重点实验室 浙江宁波315211 2 浙江省动物蛋白食品精深加工技术重点实验室 宁波大学食品与药学学院 浙江宁波315211)
嗜酸乳杆菌(Lactobacillus acidophilus)作为第3 代乳酸菌发酵剂,广泛用于发酵乳制品、微生态制剂和药物制剂生产中[1],可缓解乳糖不耐症,抑制肠道中的致病菌,增强免疫力,抑制癌症的发展等[2]。冷冻干燥法是有效保存菌种和制备直投式发酵剂的方法之一,包括预冻、升华、解析3 个过程。菌体的细胞在低温和干燥双重胁迫下,会遭受损伤,从而导致存活率降低[3]。主要有以下几点原因:首先,细胞在冷冻干燥过程中,细胞质内的溶液处于低温环境下,细胞内、外水分冻结而生成冰晶以及复水时产生的重结晶,会对菌体造成物理伤害,丧失正常的生理代谢功能而死亡[4];其次,细胞膜的结构发生改变,破坏其完整性和流动性,导致生物膜功能丧失,最终使细胞的正常生理代谢发生紊乱[5-8];同时,冷冻会改变细胞膜的脂质结构,让细胞内、外物质的转换过程失去正常控制[9]。
当前,针对乳酸菌冻干保护的研究集中在以下4 个方面。第一,添加冻干保护剂,主要包括糖类物质、氨基酸类物质、醇类物质和脱脂乳等[10];第二,优化菌体生长培养条件,包括优化培养基的组成,调节菌体的生长环境,控制菌体的生长时间,选择合适的菌体培养时间[11];第三,优化冷冻干燥条件,包括温度及浓缩菌体方式等[12];第四,胁迫预处理,主要包括冷胁迫和饥饿胁迫等[13]。本试验以嗜酸乳杆菌为模式菌株,优化提高冻干存活率的冷休克预处理条件,并结合复合冻干保护剂,获得一种提高乳酸菌冻干存活率的新方法,为制备活性直投式发酵剂提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
实验室的嗜酸乳杆菌ATCC4356、MRS 肉汤、MRS 琼脂、甘油、葡萄糖、脱脂乳、山梨糖醇、生理盐水、无菌水等。
1.2 设备及仪器
LDZX-50KB 立式压力蒸汽灭菌器,上海申安医疗器械厂;离心机,长沙湘仪离心机仪器有限公司;JB090312-02 超净工作台,苏州华科净化设备有限公司;SPX-150 37 ℃恒温培养箱,常州华冠仪器制造有限公司;LGJ-10 普通实验型真空冷冻干燥机,北京松源华兴科技发展有限公司;DW-86L828J-80 ℃超低温冰箱,杭州诺丁科学器材。
1.3 试验方法
1.3.1 菌种活化和扩大培养 将-40 ℃下的嗜酸乳杆菌菌种,接种至MRS 培养基中,37 ℃放置8 h,活化得到种子培养液。然后以1%的接种量,接种至7 瓶100 mL 的培养基中,37 ℃培养12 h后得到发酵液。菌种活化和扩大培养都需要在超净工作台中进行,以确保整个过程不会受到其它菌种的影响[14-16]。
1.3.2 生长曲线的测定 活化后的菌种以1%的接种量接种至MRS 培养基中,37 ℃放置32 h,每隔4 h 取100 μL 样液,测定600 nm 处OD 值,并用逐级稀释涂布法测定每个时间点的活菌数,绘制生长曲线[17]。
1.3.3 冷冻干燥条件及存活率的测定 冷冻干燥条件:发酵液中的细胞进行离心(5 000 r/min,10 min),并用10 mL 生理盐水洗净3 次后,收集菌体,弃发酵液上清,将沉淀在-80 ℃冰箱预冷12 h后冷冻干燥(真空9 Pa,冷凝温度-49 ℃)24 h。
活菌数的测定采用平板计数法。将各菌液梯度稀释至10-7,10-8,取这2 个浓度梯度菌液均匀涂布于MRS 琼脂的平板上,37 ℃放置24 h 后计数,分别做3 个平行,最后结果取其平均数[18]。
1.3.4 单因素试验
1)菌体收集时间 将嗜酸乳杆菌以1%的接种量,接种至100 mL MRS 肉汤培养基中,37 ℃恒温培养6,8,10,12,14 h 后,各平均分为2 部分,试验组4 ℃冰箱冷休克处理15 h,对照组在37 ℃培养箱继续培养相同时间,调两个组的OD 值至相同数值后,进行离心、预冻、冻干等操作。测定两组冻干前后的活菌数,找出存活率最高的菌体收集时间。
2)冷休克处理温度 将菌液37 ℃培养10 h后,试验组分别以0,4,8,12,16 ℃冷休克处理15 h,对照组在37 ℃培养箱继续培养相同时间,调两个组的OD 值至相同数值后,进行离心、预冻、冻干等操作,计算存活率。
3)冷休克处理时间 将活化后的嗜酸乳杆菌于37 ℃培养10 h 后,试验组4 ℃冷休克分别处理5,10,15,20,25 h;对照组于37 ℃继续培养相同时间。试验组和对照组调至相同的OD 值,再离心、预冻、冻干,计算冻干前、后的存活率。
1.3.5 响应面试验设计 根据单因素试验结果,运用Design Expert 8.0.6 内Box-Behnken 设计试验,选择各因素适合的参数,把嗜酸乳杆菌的冻干存活率作为响应值,把菌体收集时间、冷休克处理温度、冷休克处理时间作为三因素三水平的中心组合进行响应面试验[19],试验设计见表1。
1.3.6 冷休克处理结合复合冻干保护剂 根据单因素试验优化结果确定的最佳冷休克条件,设计4 组试验P1(冷休克,添加保护剂),P2(未冷休克,添加保护剂),P3(冷休克,未添加保护剂),P4(未冷休克,未添加保护剂),探究冷休克和冻干保护剂对嗜酸乳杆菌冻干存活率的交互影响[20-22]。添加复合冻干保护剂配方为脱脂乳10%、葡萄糖10%、山梨糖醇1.5%及甘油2.5%。
2 结果与分析
2.1 生长曲线的测定
如图1a 所示,嗜酸乳杆菌在8~12 h 生长最快,12 h 菌数达最大值,进入稳定期。以生长曲线为参考,选定6,8,10,12,14 h 作为菌体培养的收集时间进行试验。
2.2 单因素试验测定结果
2.2.1 菌体收集时间对嗜酸乳杆菌冻干存活率的影响 嗜酸乳杆菌菌体收集时间即冷休克处理前菌的培养时间。经冷休克处理的各试验组菌的存活率显著,均高于各对应的对照组(图1b)(P<0.05)。试验组和对照组菌的存活率均在10 h 达到最高,第6~10 小时呈上升趋势,第10~14 小时呈下降趋势。故选取培养至对数末期(第10 小时)作为最佳菌体收集时间,再进行冷休克处理。
2.2.2 冷休克处理温度对嗜酸乳杆菌冻干存活率的影响 冷休克对照组的嗜酸乳杆菌存活率仅为45%左右,而冷休克组的嗜酸乳杆菌存活率高达55%~60%,说明冷休克处理可显著提高嗜酸乳杆菌存活率(图1c)(P<0.05)。其中,在8 ℃下嗜酸乳杆菌存活率最大,为最适冷休克温度。
2.2.3 冷休克处理时间对嗜酸乳杆菌冻干存活率的影响 冷休克对照组的嗜酸乳杆菌存活率仅为18%~28%,而冷休克组的嗜酸乳杆菌存活率都比同一条件下的对照组高,表明冷休克处理可显著提高嗜酸乳杆菌存活率(图1d)(P<0.05)。冷休克处理时间为15 h 时嗜酸乳杆菌存活率最高。

图1 嗜酸乳杆菌在MRS 中的生长曲线(a)、菌体收集时间(b)、冷休克处理温度(c)、冷休克处理时间(d)对嗜酸乳杆菌冻干存活率的影响Fig.1 The growth curve of L.acidophilus in MRS broth (a)and the effect of collection time of bacterial (b),the temperature(c)and treating time (d)for cold shock treatment on the survival rate of L.acidophilus after freeze-drying
2.3 响应面试验设计及结果
响应面试验的因素水平编码见表1;Box-Behnken 试验设计及结果见表2;利用Design-Expert.8.0.6,剔除不显著因子得出经冷休克处理后LA 冻干存活率Y 的回归方程为:
Y=45.54+0.21A-0.26B+0.71C-2.500AB+0.10AC+0.10BC-2.04A2-1.52B2-4.80C2
得到了冷休克处理的最佳条件是:菌体收集时间10 h,冷休克温度8 ℃,冷休克时间15 h。在这个条件组合下,嗜酸乳杆菌的冻干存活率最高。验证试验测得在该条件下,嗜酸乳杆菌冻干存活率为59.76%,其与理论上的60.70%相对误差在1%以内,吻合度高;显著高于未经冷休克处理的冻干存活率(36.68%,P<0.05)。
应用Design-Expert 8.0.6 对表内数据做多元回归拟合和分析模型的方差,如表3。其中F 值是2 814.57,P<0.0001,表明模型极显著。A、B、C 3 个一次项表现得非常显著,表明涉及到的3 个条件对嗜酸乳杆菌冻干存活率均有显著影响;二次项A2、B2、C2偏回归系数达非常显著的水平。由上述的F 值可得出,对LA 冻干存活率的影响能力依次为:C>B>A,即冷休克时间>冷休克温度>菌体收集时间;模型的P>0.05,表明失拟性不显著,方程对试验拟合较好,该模型能够准确模拟出各因素对LA 冻干存活率的影响;R2值为0.9956,拟合度高,可正确描述试验结果。

表1 Box-Behnken 中心因素组合水平编码表(三因素三水平)Table 1 Independent variables and coded levels in Box-Behnken experimental design
2.4 响应面及等高线分析结果
嗜酸乳杆菌的存活率随着菌体收集时间和冷休克温度的升高而先增大后减小,等高线接近于圆形,表明菌体收集时间与冷休克温度之间的相互作用不显著(图2a)。嗜酸乳杆菌存活率随着冷休克处理时间的增加而呈先上升后下降的趋势,冷休克处理时间约为15 h 时达到最高值,轮廓呈现椭圆形,表明冷休克处理时间和菌体收集时间之间相互作用影响显著,且冷休克时间影响更大(图2b)。随着菌体收集时间的增加,嗜酸乳杆菌冻干存活率呈先增大后减小的态势,在冷休克处理时间为15 h,温度为8 ℃时,LA 冻干存活率最高,轮廓呈现椭圆,等高线随时间轴向比较致密,表现出冷休克时间和冷休克温度之间显著的交互作用(图2c)。
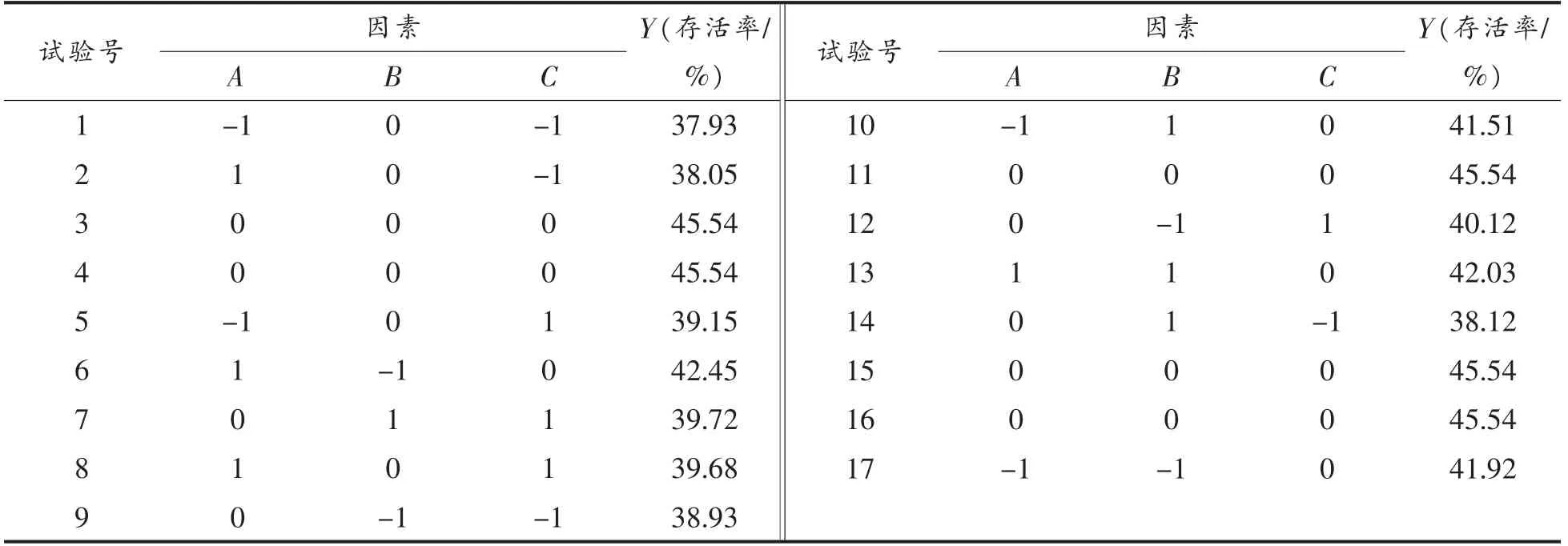
表2 响应面试验方案及结果Table 2 The results of response surface tests
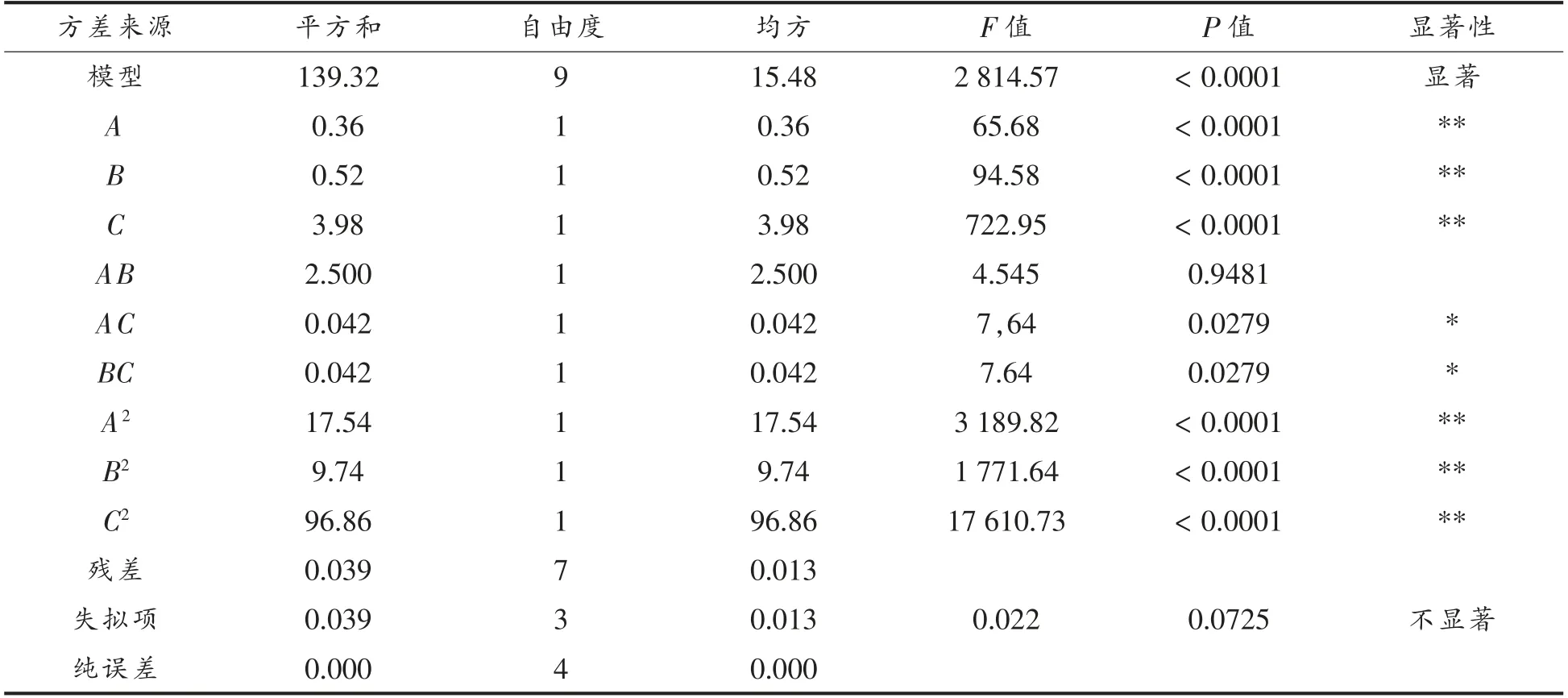
表3 回归模型方差分析结果Table 3 Analysis of variance for the established regression model
2.5 冷休克结合冻干保护剂对冻干存活率影响的探究结果
根据单因素试验优化结果确定的最佳冷休克条件,设计4 组试验探究冷休克和冻干保护剂对嗜酸乳杆菌冻干存活率的交互作用。测得P1、P2、P3、P4 4 组嗜酸乳杆菌存活率分别为96.64%,78.99%,55.38%,21.42%。结果表明经冷休克处理并添加冻干保护剂组最高(96.64%),比未冷休克、添加冻干保护剂组(78.99%),冷休克、未添加冻干保护剂组(55.38%),未冷休克、未添加冻干保护剂组(21.42%)分别提高了17.65%,41.26%,75.22%。说明冷休克和冻干保护剂的交互作用对嗜酸乳杆菌冻干存活率有显著提高。

图2 冷休克温度与冷休克时间(a)、菌体收集时间与冷休克时间(b)、菌体收集时间与冷休克温度(c)交互作用对嗜酸乳杆菌冻干存活率的影响响应面图Fig.2 Response surface diagram for the interaction effect of cold shock temperature and cold shock time (a),bacterial collection time and cold shock time (b),bacterial collection time and cold shock temperature (c)on L.acidophilus freeze storage rate
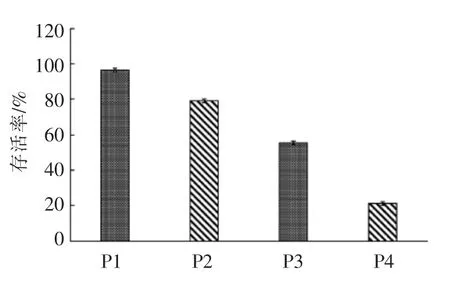
图3 冷休克结合冻干保护剂对冻干存活率影响结果Fig.3 Effect of cold shock combined with freeze-drying protectant on the survival rate after freeze-drying
3 结果与讨论
冷休克处理提高菌体冻干存活率的作用机理与冷休克蛋白、细胞膜的流动性、嗜冷酶作用有关[23-26]。Jeffery 等[23]发现菌体经冷休克后,产生了冷休克蛋白(Csps),使细胞膜上的酶不容易发生变化,防止酶发生变性而损害细胞。经冷休克处理后,细胞膜中的不饱和脂肪酸含量增加,有利于维持细胞膜的流动性,提高微生物细胞对冷冻干燥的耐受性[24-25]。Eroglu 等[26]报道了微生物菌体内的嗜冷酶在冷休克低温条件下,其蛋白质的空间结构稳定,保持了与底物的结合能力,仍具有较高的催化活性,提高了细胞的抗冻干能力。
冻干保护剂的应用越来越广泛。曹永梅等[27]研究发现,冻干保护剂能通过抑制氧化酶的活性,阻止菌体在冷冻干燥过程中发生氧化反应,保持细胞的完整性和生理活性。吕加平等[28]认为,保护剂和水的混合物在冷冻干燥时发生了玻璃化,使蛋白质分子表面具有黏性,不容易形成结晶,从而保持其稳定性。Prakash 等[29]通过研究发现,保护剂分子中的羟基能通过冷冻干燥过程中形成的氢键连接蛋白质的极性基团,形成近似于水化膜的保护层,避免蛋白质变性引起细胞损伤。张光磊等[30]提出,细胞膜蛋白优先与水分子结合,保护剂分子在其周围维持内部结构不受破坏。冷冻干燥过程中膜质的相转变为凝胶态,加入冻干保护剂可以降低Tm,防止复水时细胞膜转变回液晶态而导致的细胞膜渗漏,从而提高细胞的存活率[31]。
本试验获得了冷休克处理结合冻干保护剂提高嗜酸乳杆菌存活率的最优条件。嗜酸乳杆菌培养10 h 时收集菌体,于8 ℃冷休克处理15 h,结合复合冻干保护剂,使嗜酸乳杆菌冷冻干燥后的存活率可以提高至96.64%。比未冷休克、添加冻干保护剂组(78.99%),冷休克、未添加冻干保护剂组 (55.38%),未冷休克、未添加冻干保护剂组(21.42%)分别提高了17.65%,41.26%,75.22%;表明在冷冻干燥前进行冷休克预处理,是一种有效提高乳酸菌抗冻干胁迫能力的新途径。本试验得到的冻干存活率高于王菡等[32]仅筛选利用冻干保护剂(72.15%),李春等[33]仅利用8 ℃冷休克处理(62.35%)的嗜酸乳杆菌的存活率。说明冷休克处理结合冻干保护剂,可对菌体细胞形成双重保护作用,效果好于仅使用1 种保护方法,且操作方法方便快捷。这对乳酸菌产品的保存及直投式发酵剂的生产均具有重要的理论与实践意义。

