贮藏期UHT奶中蛋白质组成结构及其糖基化的变化
李星,顾雨香,任青兮,陈浩然,关凯方,刘海燕,李启明,马莺
(1.哈尔滨工业大学化工与化学学院,哈尔滨150090;2.新控国际健康管理有限公司,成都610044;3.乳品营养与功能四川省重点实验室,成都610000;4.新希望乳业股份有限公司,成都610063)
0 引 言
UHT奶经过135℃以上不少于1 s的超高温瞬时灭菌,完全破坏乳中可以生长的微生物和芽孢,结合无菌灌装技术,具有长期常温贮存(6个月),销售携带方便,可远距离运输等优点[1],在液体奶市场中占据主导地位。UHT奶在贮藏过程中经常出现品质和风味劣变问题,如蛋白水解[2-3]、胶凝(age-gelation)[4-6]、沉降(sedimentation)[7]、苦味产生等[3],对UHT奶的生产造成困扰。本研究针对UHT奶在贮藏过程中感官和流变特性的改变,探究乳蛋白在贮藏过程中组成分布改变、乳蛋白的水解和糖基化修饰,为UHT奶的科学生产和贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
UHT奶经过141℃/2 s间接加热杀菌。杀菌后无菌灌装,在25℃恒温箱中贮藏6个月,每月取样。
牛 乳蛋白标 准 品:αs-酪蛋 白(αs-CN),lot C-6780;β-酪蛋白(β-CN),lot C-6950;κ-酪蛋白(κ-CN),lot C-0406;β-乳 球 蛋 白(β-lg),lot L-3908;α-乳白蛋白(α-la),lot L-5385;纤溶酶活试剂盒,三氟乙酸(TFA),乙腈,超纯水购于Sigma-Aldrich公司(St.Louis,MO,USA)。其他试剂都为分析纯。
1.2 菌落总数及纤溶酶测定
参考Wehr等[8]的方法,对原乳及其UHT奶样品中菌落总数测定进行测定。纤溶酶(plasmin)酶活通过三明治法ELISA法试剂盒进行测定,利用纤溶酶水解合成底物(Suc-Ala-Phe-Lys-AMC)而释放荧光标记物AMC,从而建立纤溶酶含量与荧光强度线性关系。激发波长为450 nm,发射波长为360 nm。
1.3 氮分布测定
参照李海梅等人的方法[9],采用凯氏定氮法测定乳中总氮(TN)、非蛋白氮(NPN)。乳中非酪蛋白氮(NCN)的测定参照Michael等所述的方法[10]。采用醋酸沉淀样品中的酪蛋白,上清液中的非酪蛋白含量采用凯氏定氮法测定。乳中氮分布按下式计算,乳中每种蛋白质的含量在测得的NPN和NCN最终乘上系数6.38。乳清蛋白氮(WPN)和酪蛋白氮(CN)的计算方法如下:

1.4 酪蛋白胶束粒径及zeta电位测定
利用动态光散射原理(DLS)测定酪蛋白胶束的粒径。参考Li等的方法[11],脱脂乳用超纯水稀释10倍后对其进行粒径及zeta电位测定,散射角为173度,测试模式为自动模式,分析模式为蛋白分析。
1.5 牛乳流变性测定
通过流变仪对样品流变学特征进行测试:巴氏奶测定温度为4℃,UHT奶测定温度为25℃。剪切率由0.01到100 s-1,共采集41个数据点。每个样品平行测定3次。牛乳作为非牛顿流体,简单的黏度这一指标并无法说明其流变特性[12-14]。采用“power law”模型来描述其流变特性(R2>0.99)。

τ为剪切应力(Pa),γ为剪切速率(s-1),K为黏度系数(Pa·Sn),n为流动行为指数(无量纲)。当n=1时,该流体为牛顿流体;当n<1时,该流体为剪切变稀流体。
1.6 牛乳色泽测定
通过色差仪对样品色泽进行测试。标准白板校准后取一定量的样品进行测定,每个样品测定3次取平均值。以总色泽值E表示色泽的变化。

L为白度,0为黑,100为白;a为红绿值,>0为红,<0为绿;b为黄蓝值,>0为黄,<0为蓝。
1.7 乳蛋白在胶束相和乳清相分布
1.7.1样品制备
取25 mL乳样用超速离心机进行超高速离心(90 000g,40 min,25℃),分别收集上清液和下层凝胶定容于25 mL。上清液为乳清相,下层凝胶为酪蛋白胶束相。分别取1 mL脱脂乳、胶束相、乳清相用3倍裂解液(6 mol/L GdnHCl,0.1 mol/L Bis-Tris和5.37 mmol/L柠檬酸钠,p H 7)溶解稀释,经孔径0.45μm的纤维素滤膜过滤后,直接上机分析。
1.7.2高效液相色谱测定乳蛋白
参考李海梅等人方法并改进[9],采用反向高效液相色谱法测定样品中蛋白含量。色谱柱为Jupiter C8 column(250 mm×4.6 mm,300Å-sized pores,5μm sized particles)。流动相A为含0.1%(体积分数)TFA的超纯水溶液,流动相B为含0.1%TFA的乙腈溶液;柱温为25℃;检测波长为218 nm;进样量为20μL;流速为0.8 mL/min;梯度洗脱程序:0~40 min B液浓度从30%升到50%;40~42 min B液浓度从50%升到100%;42~43 min B液浓度为100%;43~46 min B液浓度从100%降到30%,最后用初始浓度30%B洗脱5 min。洗脱时间(包含柱平衡时间)共计51 min。
1.8 蛋白糖基化位点测定
1.8.1样品制备
脱脂牛乳样品用超纯水10倍稀释,取100 mg稀释样品溶于200μL 100 mmol/L NH4HCO3溶液中,析出蛋白复溶于裂解液(7 mol/L尿素,2 mol/L硫脲,50 mmol/L DTT和50 mmol/L Tris)中,25℃孵育18 h。蛋白通过甲醇氯仿溶液沉淀并复溶于50μL 100 mmol/L NH4HCO3溶液中。加入20μL 150 mmol/L碘乙酰胺溶液,混匀后于25℃避光孵育30 min。加入5μg测序级胰蛋白酶(Promega)于37℃过夜消化。冷却至室温后过3 ku滤膜,制得肽段溶液。
1.8.2 UHPLC-MS-MS测定蛋白肽
参考Liu等人的方法并改进[15],待测肽段溶液采用超高效液相色谱与静电场轨道离子阱质谱联用(UHPLC-Q-Orbitrap,Thermo Fisher Scientific,MO,USA)分析。10μL样品上样于C18色谱柱(Thermo Scientific Easy Column,3μm,100 mm×75μm),流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸的84%乙腈溶液;梯度条件为:0~50 min B液浓度0%~35%,50~55 min B液浓度35%~100%,55~60 min B液浓度为100%。质谱参数如下:喷雾电压:2.2 k V;毛细管温度:200℃;质谱扫描方式为Full MS(top10)模式;质谱轴范围:300~1 800 m/z;目标AGC值:3e6;最大注入时间:10 ms。
1.9 数据分析
数据库搜索采用MaxQuant software version 1.3.0.5。修饰化位点为:lactulosyllysine on Lys(+324.105647),fructosyllysine on Lys(+162.052824),Nε-carboxymethy llysine(CML)on Lys(+58.005479)。修饰化位点的相对定量是以对照组是以原乳中各修饰化位点信号强度为1,巴氏奶和UHT奶与其的比值作为分值。实验数据处理及图表的制作使用Origin 9.0软件,显著性分析使用SPSSStatistics 19.0软件。
2 结果与分析
2.1 UHT奶贮藏过程中基本性质的变化
UHT奶在贮藏过程中p H,菌落总数,纤溶酶含量,总蛋白氮(TN),非蛋白氮(NPN),乳清蛋白氮(WPN)和酪蛋白氮(CN)变化如表1所示。结果表明:UHT奶在6个月的常温贮藏过程中,p H从6.88降低到6.68,TN含量变化不显著(P>0.05),CN从4.53 g/L下降到3.88 g/L,WPN从0.66 g/L下降到0.53 g/L,NPN从0.27 g/L增加到1.74 g/L。UHT奶在贮藏过程中,菌落总数在长期贮藏中变化并不显著(P>0.05)。纤溶酶含量呈现先增加后降低的趋势。

表1 贮藏过程中UHT奶pH,总蛋白氮,非蛋白氮,乳清蛋白氮,酪蛋白氮,菌落总数和纤溶酶含量变化
非蛋白氮含量发生了增长,说明在贮藏过程中乳蛋白都发生了一定程度的水解。UHT工艺相对较强的加热强度,使得只有28%的纤溶酶存在于UHT奶,这与之前的报道结果(30%~40%存在于UHT奶中)基本一致[16]。但该加热强度对纤溶酶原及其激活剂并没有影响,相反导致纤溶酶抑制剂失活。因此,在常温贮藏0~4个月过程中,纤溶酶含量逐渐上升。而在4个月之后,纤溶酶含量产生一定程度的下降,原因目前尚不清楚,可能是因为蛋白的水解等因素造成纤溶酶含量产生下降。
2.2 酪蛋白胶束平均粒径和zeta电位变化
采用动态光散射(DLS)方法测定贮藏过程中牛乳酪蛋白胶束粒径和Zeta电位,结果如图1所示。原乳中酪蛋白胶束平均粒径为~189 nm。经过UHT工艺后酪蛋白胶束平均粒径增加了~26 nm。在6个月常温贮藏中,平均粒径从215 nm增大到296 nm。同时酪蛋白胶束的zeta电位发生显著增大(P<0.05)。

图1 贮藏期间UHT奶中胶束平均粒径及zeta电位的变化
热处理会导致乳清蛋白的变性,变性的乳清蛋白会结合到酪蛋白胶束表面,进而使其粒径增大[17]。常温长期贮藏过程中酪蛋白粒径和zeta电位增大,说明蛋白结构发生改变,稳定性下降,蛋白相互作用程度更多强烈,使乳中发生更显著的蛋白团聚、胶凝现象,这种蛋白团聚会影响胶束光散射特性使粒径测定结果增大。
2.3 UHT奶在贮藏期中流变性的变化
黏度系数K反映流体的表观黏度,而n反映流体的剪切能力,n值越大,说明流体呈现出越强的剪切变稠能力。对贮藏期UHT奶的流变特性进行测定,结果如图2所示。UHT奶在加热和贮藏过程中黏度系K数逐渐增大,流动行为指数n逐渐降低。
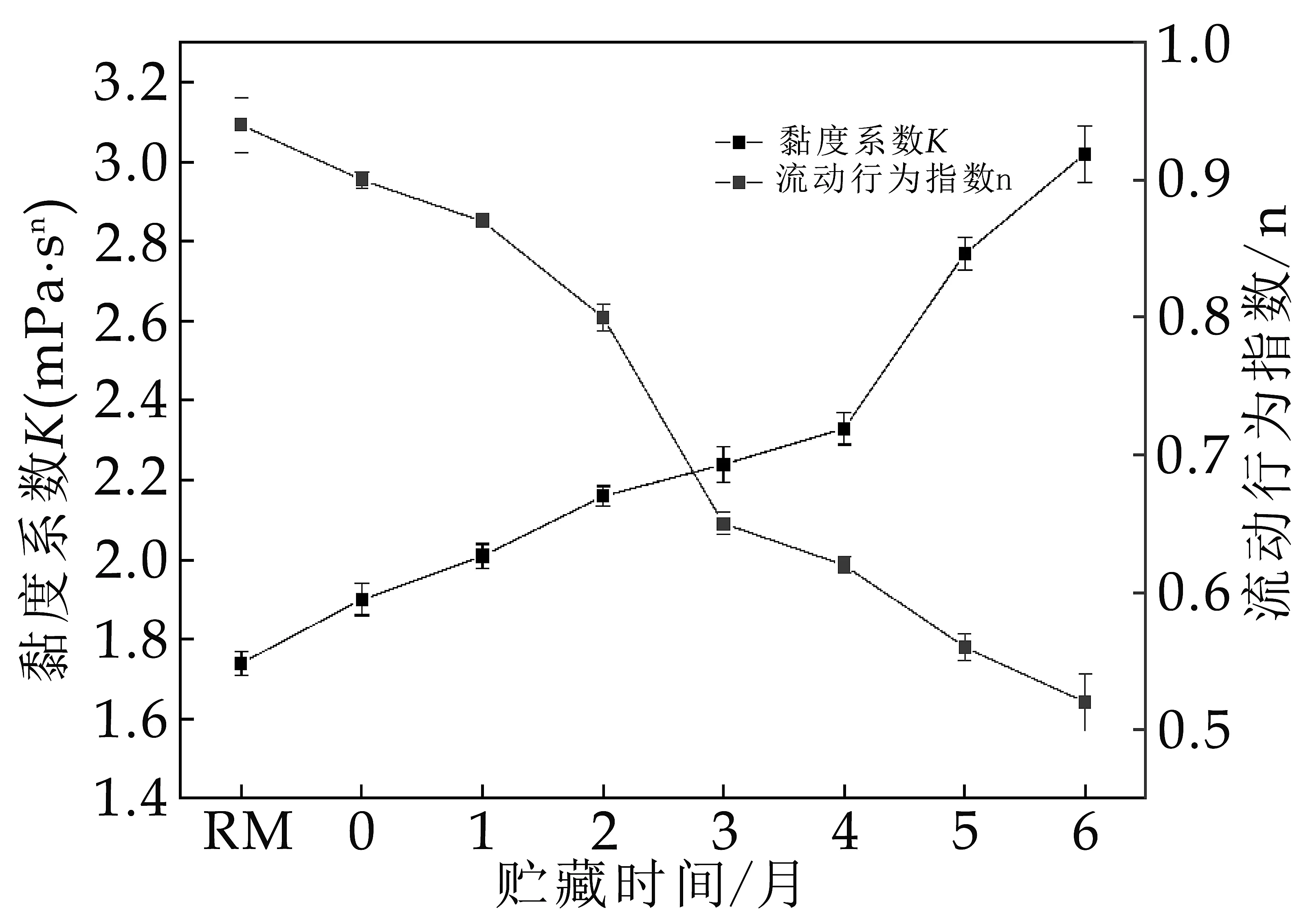
图2 贮藏过程中巴氏奶和UHT奶的黏度系数和流动行为指数的变化
热处理后K值增大是因为热处理后变性的乳清蛋白结合在胶束表面增加了胶束粒径,同时热诱导聚合物的形成共同导致了K的增大。而在贮藏过程中,胶束粒径增大,蛋白团聚等原因共同造成了K的增大[18]。而n<1说明液体奶是剪切变稀型流体,随贮藏时间的延长呈现出更明显的剪切变稀能力,说明整个液态奶体系稳定性趋于下降。这与贮藏过程酶的水解,胶束呈现更加松散结构有着必然关系[5]。
2.4 UHT奶和巴氏奶贮藏过程乳蛋白组分的变化
采用HPLC测定贮藏过程中每种蛋白组分含量(见表2)。UHT奶在贮藏过程中,酪蛋白和乳清蛋白都发生不同程度的水解,κ-CN从4.00 g/L下降到3.64 g/L,αs-CN从14.44 g/L下降到13.30 g/L,β-CN从10.30 g/L下降到5.64 g/L,β-lg从3.86 g/L下降到3.13 g/L,α-la从1.42 g/L下降到1.14 g/L。其中β-CN最为显著(β-CN含量减少45%)。
蛋白水解的原因除热处理造成少量蛋白水解外[19],主要是因为内源性和外源性酶对乳蛋白的水解[5]。纤溶酶作为主要的内源性酶,倾向于水解β-CN,其次为αs-CN,对κ-CN基本不水解[20]。UHT奶中含有0.8 mg/L的纤溶酶在室温条件下贮藏6周会导致60%以上的β-CN水解[21]。而存活于UHT奶中的耐热菌荧光假单胞菌分泌的AprX酶倾向于水解αs-CN,β-CN和κ-CN[21],Zhang[21]等人研究发现UHT奶中含有10 mg/L的AprX酶在室温条件下贮藏6周会导致κ-CN水解80%,αs1-CN水解20%,β-CN水解15%。UHT奶中纤溶酶含量和菌落总数都相对较低,因此UHT奶在6个月常温贮藏中κ-CN含量减少9%,αs-CN减少8%,β-CN减少45%。

表2 UHT奶中各主要蛋白在贮藏过程中含量变化
2.5 乳蛋白在胶束相和乳清相中的分布
采用RP-HPLC测定了原乳和贮藏期内UHT奶和巴氏奶中酪蛋白和乳清蛋白组分在胶束相和乳清相中的分布,结果如图3所示。热处理后,更多的酪蛋白进入乳清相中,其中κ-CN最为显著(34%κ-CN从胶束相进入乳清相),而乳清蛋白在胶束相中的比例升高(30%β-lg进入胶束相)。在常温贮藏过程中,αs-CN,β-CN在两相的分布变化并不显著,κ-CN,β-lg,α-la在胶束相中比例不断增大(κ-CN从65%增大到80%,β-lg从32%增大到50%,α-la从20%增大到38%)。蛋白分布的改变主要集中在前2个月。
热处理会引起乳清蛋白变性且与κ-CN通过二硫键结合形成κ-CN/乳清蛋白热诱导聚合物,其在胶束表面和乳清中皆有分布[22]。在贮藏过程中,部分变性的乳清蛋白和从胶束上解聚κ-CN重新结合在胶束表面。液相测的κ-CN和乳清蛋白在胶束相中的增加量比例都约为1:2.5,这与乳清相中热诱导聚合物中κ-CN/乳清蛋白的比例基本一致[23-24],意味着κ-CN和乳清蛋白可能是以乳清中游离的热诱导聚合物的形式重新结合到胶束表面。
2.6 UHT奶贮藏过程中色泽变化
色泽是反映牛乳在加工贮藏过程中美拉德反应程度最直接的指标。在加工贮藏中,UHT奶色泽发生了显著变化(P<0.05)(如图4)。UHT奶的色泽E值增大,是由于乳清蛋白变性程度较大,在乳清相中形成大量热诱导聚合物,热诱导聚合物对光线反射率增强,从而使UHT奶的色泽E值增大[25]。但是在UHT奶贮藏过程中,色泽E值逐渐降低,说明UHT奶在长期贮藏过程中发生非酶褐变,即美拉德反应。
2.7 乳蛋白乳糖基化位点
通过LC-MSMS对乳蛋白中乳糖基化位点进行测定,通过与原乳中各位点的信号强度比较,对乳糖基化位点进行相对定量测定,如表3和表4所示。热处理后主要乳蛋白都产生不同程度的乳糖基化,酪蛋白乳糖基化的位点明显多于乳清蛋白,αs1-CN修饰位点最多(4个)。αs2-CN的Lys173和κ-CN的Lys46位点含量变化最为显著,说明这两个位点对热强度变化最为敏感,是潜在的热强度指示物。在贮藏过程中,糖基赖氨酸和CML含量都随着贮藏时间而逐渐增大,这意味着美拉德反应在贮藏过程中继续产生,这与色泽变化结果相一致。
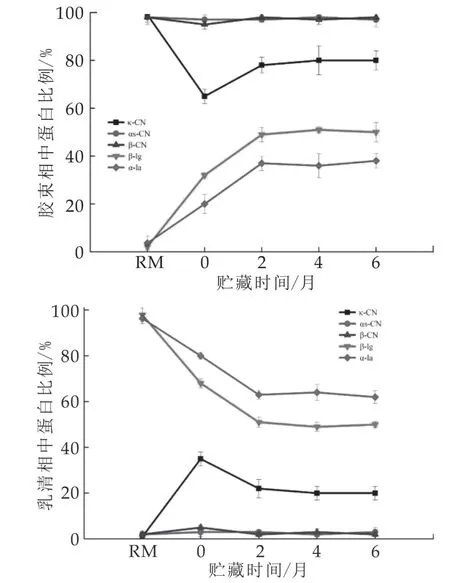
图3 贮藏过程中UHT奶中5种主要蛋白在胶束相和乳清相中的分布(%)

图4 贮藏过程中液体奶色泽变化

表3 贮藏过程中Nε-羧甲基赖氨酸(CML)的相对含量*

表4 贮藏过程中半乳糖基赖氨酸的相对含量*
3 结 论
UHT奶中纤溶酶含量增大而菌落总数变化并不显著。在内外源酶的作用下主要蛋白都发生不同程度水解,因而非蛋白氮含量增大。酪蛋白胶束平均粒径在贮藏过程增大81 nm,zeta电位逐渐降低,说明胶束稳定性逐渐下降。在贮藏过程中UHT奶黏度系数K逐渐增大,流动行为指数n逐渐降低,意味着牛乳随着贮藏时间的延长表观黏度增大,且呈现出更明显的剪切变稀能力。通过HPLC对乳蛋白在胶束相和乳清相中的分布进行定量分析:热处理后,UHT奶中34%的κ-CN进入乳清相。而贮藏过程中胶束相中κ-CN,β-lg,α-la比例不断增大,其中15%的κ-CN,18%的β-lg,18%的α-la进入胶束相。这些蛋白可能是以热诱导聚合物的形式重新结合到胶束表面,导致粒径增大。贮藏过程中UHT奶色泽逐渐降低,半乳糖基赖氨酸和CML含量不断增加,说明UHT奶在长期贮藏过程中美拉德反应持续进行。

