低温胁迫对不同种源蒙古莸叶绿素荧光特性的影响*
曲乘民,叶冬梅,何炎红,白玉娥,林涛
(内蒙古农业大学 林学院,内蒙古 呼和浩特 010020)
光是植物进行光合作用和生长发育过程中必需的外部环境因子,但植物光合机构所能够利用的光能是有限的[1],当植物吸收的光能超过植物光合作用所能利用的范围,就会出现光抑制和光破坏[2]。为了防止光抑制和光破坏对植物的光合系统造成损伤,植物形成了系统的保护机制[3]。叶绿素荧光动力学参数可以反映叶片光合机构在强光下的内在变化情况[4],是目前最为先进的无损伤测定植物光合作用能量吸收、传递、耗散、分配的重要研究内容和方法[5]。
蒙古莸(Caryopterismongolica),别名白蒿,属马鞭草科(Verbenaceae)莸属(Caryopteris)旱生半灌木[5]。主要分布在蒙古高原的典型草原、荒漠化草原和荒漠区、黄土高原北部及西北部的典型草原区内[6]。因其可入药、提炼芳香油、做饲料而具有较高的经济价值,同时作为干旱区重要的水土保持和园林观赏植物具有较高的生态价值[5,7-9]。近年来蒙古莸分布范围日渐缩小[10-11]。前人已对蒙古莸在地理分布[6]、生殖生物学特征[12]、生态学[8,13]、化学成分分析[7]以及抗旱性[14]等方面进行了研究,但对其进行叶绿素荧光参数及抗寒性的研究较少。因此,本研究以来自4个种源的蒙古莸种子培育出的实生苗为试材,分析了不同低温胁迫条件下各种源蒙古莸在不同光强度下叶绿素荧光参数变化规律,探讨其对光照环境条件变化的适应能力。
1 材料和方法
1.1 试验材料
于2019年2月20日将采自4个种源地的蒙古莸种子播种于内蒙古农业大学智能温室内进行实生苗的培育,其培育期间利用智能温室自动化控制温度、光照、土壤水分。2019年7月5日起苗,将幼苗移栽至统一规格(18 cm×15 cm)营养钵中,每钵分装1.3 kg沙土,足水栽培进行缓苗。种源地地理及气候因子见表1。

表1 材料来源
1.2 试验方法
1.2.1 处理方法
于2019年7月20日,对各种源选取长势一致,生长状况良好的蒙古莸苗木,利用恒温光照培养箱进行人工低温胁迫处理,光照强度1 000 Lx(每日12 h),共设置4个温度梯度(3、7、11和15 ℃)。其中以15 ℃处理为对照,各种源每处理6株苗木,处理21 d后,自上而下选取植株第4~8片叶片进行叶绿素荧光参数的测定,各种源每处理测定6片叶片。
1.2.2 测定方法
利用LI-6400光合荧光测定仪装配的荧光叶室测定叶绿素荧光参数,利用LI-6400可控光源设置光合有效辐射(PARi)为0、50、80、100、200、300、600、900、1 200 μmol/(m2·s)共9个梯度,测定前用遮光夹对待测叶片进行40 min的遮光处理。具体测定指标为最大荧光产量(Fm)、固定荧光(Fo)、作用光关闭时的原初荧光(Fo’)、恒态荧光(Fs)、作用光打开时的最大荧光产量(Fm’)、表观电子传递速率(ETR)、光化学淬灭系数(qp)、非光化学淬灭系数(NPQ)、最大光化学效率(Fv/Fm)。利用所测指标根据耿庆伟等[15]和朱弘等[16]的方法分别求出PSⅠ和PSⅡ光系统间激发能不平衡系数(β/α-1)和PSⅡ实际光化学效率(Yield)。求算公式如下:
α=f/(1+f)
①
β=1/(1+f)
②
f=(Fm’-Fs)/(Fm’-Fo’)
③
Yield=(Fm’-Fs)/Fm’
④
将各样本所测得指标的值根据光合有效辐射强度进行平均,以所得平均值进行数据处理。
1.2.3 数据处理
利用Excel处理数据及绘图,利用SPSS 23软件对数据进行回归分析、方差分析。
2 结果与分析
2.1 低温胁迫后不同光强下表观电子传递速率(ETR)变化
本着误差小的原则采用方程⑤进行拟合,并计算其转折点[17-18]。
y=a+b〔1-Exp(-kx)〕
⑤
式中:y为ETR的值,x为PARi的值,a、b、k为参数,见表2。ETR代表PSⅡ到PSⅠ的电子传递[19]。同等光强下ETR的值越大,光合器官形成的活跃化学能越多,为暗反应的光合碳同化积累越多能量[20-21]。如图1与表2所示,随着光强的增加,电子传递速率先快速增加,当到达转折点后电子传递速率基本保持不变。随着温度的降低,各种源蒙古莸的电子传递速率减缓,且转折点处的ETR值和光强度均减小。ETR转折点的大小可反映植物对光强敏感度的强弱[17]。本试验中蒙古莸在低温胁迫后ETR较对照组均减小,这说明面对寒冷胁迫蒙古莸采取了降低ETR的策略,且随着胁迫程度的加深,其对光的敏感度不断加强,但7 ℃和11 ℃条件下各种源蒙古莸对光的敏感度差异不大。不同温度下各种源蒙古莸对光的敏感度由强到弱依次为3 ℃(XS、LJD、JB、BLG)、7 ℃(LJD、XS、BLG、JB)、11 ℃(BLG、LJD、XS、JB)、15 ℃(LJD、XS、BLG、JB)。
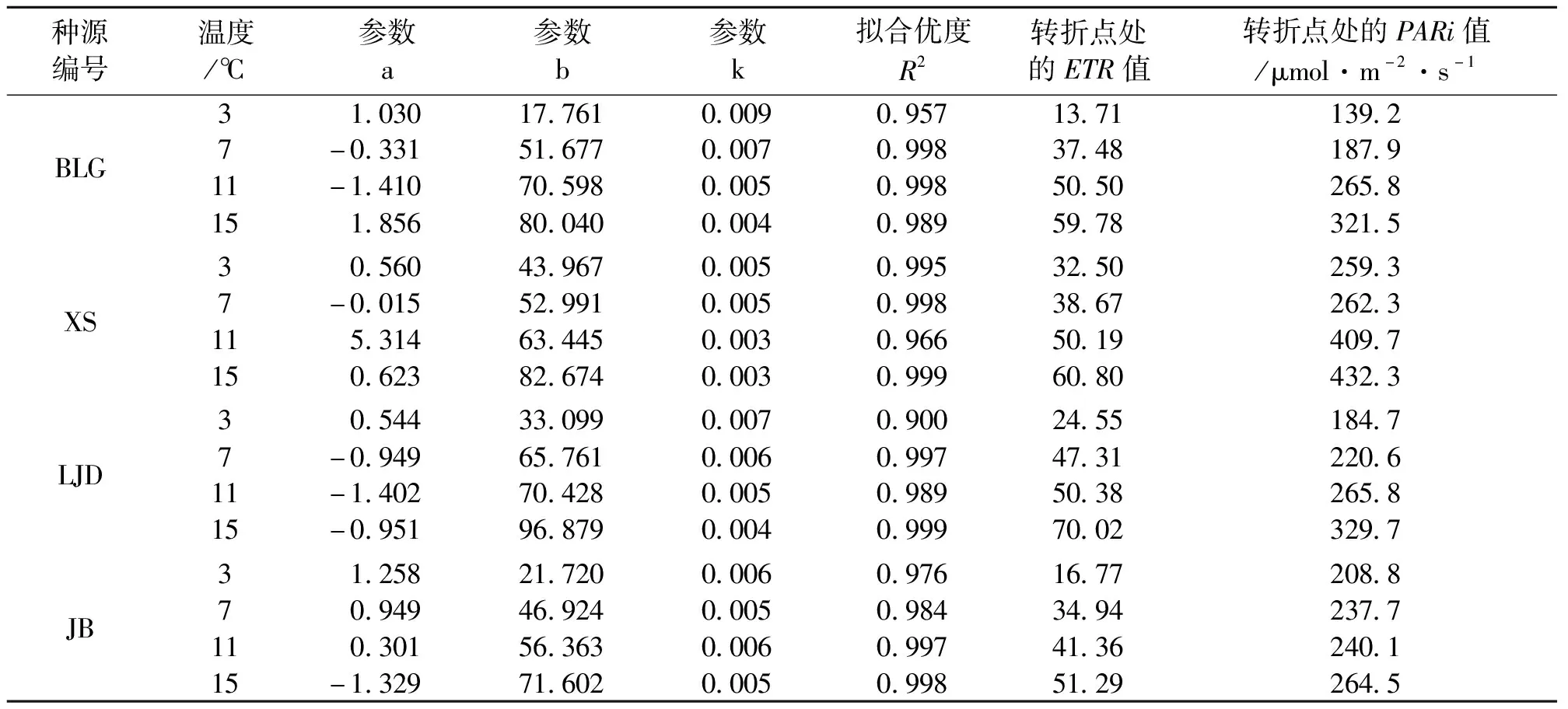
表2 不同种源蒙古莸表观电子传递速率(ETR)的光响应曲线参数

图1 不同种源蒙古莸表观电子传递速率(ETR)的光响应曲线
2.2 低温胁迫后不同光强下PSⅡ实际光化学效率(Yield)变化
采用方程⑥进行拟合,并计算其转折点。
y=a+b〔1-Exp(-kx)〕
⑥
式中:y为Yield的值,x为PARi的值,a、b、k为参数,见表3。Yield也称为 PS Ⅱ的实际光化学效率,反映植物叶片用于光合电子传递的能量占所吸收光能的比例[22],如图2与表3所示,随着光强的增加,实际光化学效率先快速下降,当到达转折点后其值基本保持不变。随着温度的降低,各种源的实际光化学效率减缓,且转折点处的Yield值和光强度均减小。随着温度的降低,相同光强下的Yield不断下降,说明低温胁迫降低了蒙古莸的光能捕获效率。当温度低至3 ℃时,各种源苗木转折点处Yield较对照组下降幅度(即温度对强光适应性的削弱影响)由大到小为BLG(78.75%)、JB(57.38%)、LJD(42.93%)、XS(22.52%)。
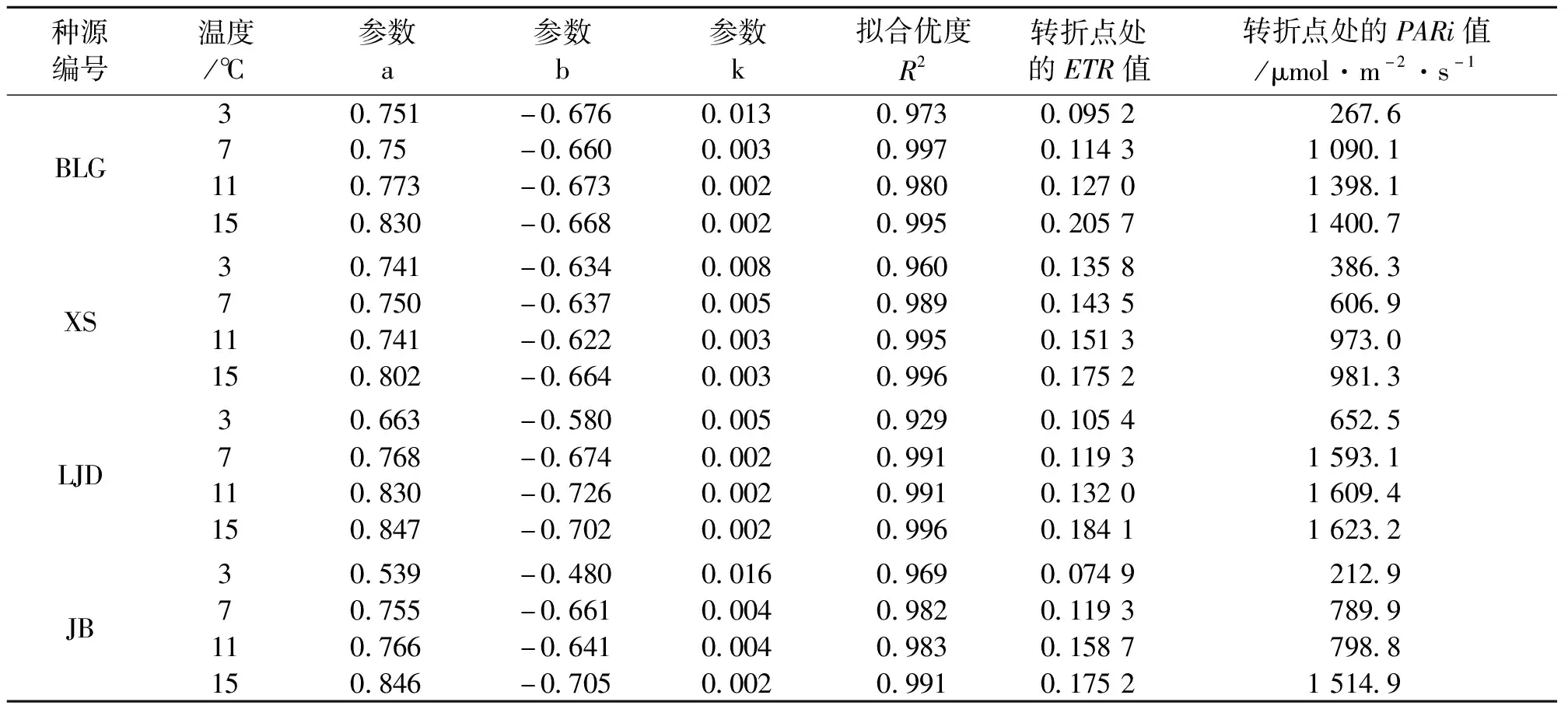
表3 不同种源蒙古莸PSⅡ实际光化学效率(Yield)的光响应曲线参数

图2 不同种源蒙古莸PSⅡ实际光化学效率(Yield)的光响应曲线
2.3 低温胁迫后不同光强下光化学淬灭系数(qp)变化
采用方程⑦进行拟合,并计算其转折点。
y=a+b·〔1-Exp(-kx)〕
⑦
式中:y为qp的值,x为PARi的值,a、b、k为参数,见表4。qp可说明植物光反应耗散能量的大小,其光响应曲线转折点处qp值越大,树木对光能利用效率越高[23]。如图3与表4所示,随着光强的增加,光化学淬灭系数先快速下降,当到达转折点后其值缓慢减小直至基本保持不变。随着温度的降低,各种源蒙古莸的光化学淬灭系数减小,且转折点处的qp值和光强度均减小。随着温度的降低,相同光强下蒙古莸光合效率减慢。不同温度下各种源蒙古莸对光能的利用效率由强到弱依次为3℃(JB、BLG、XS、LJD)、7℃(XS、JB、BLG、LJD)、11℃(XS、JB、BLG、LJD)、15℃(XS、BLG、JB、LJD),由此可知不论是否收到胁迫LJD种源的蒙古莸在4种源地中对光能的利用效率均最低。
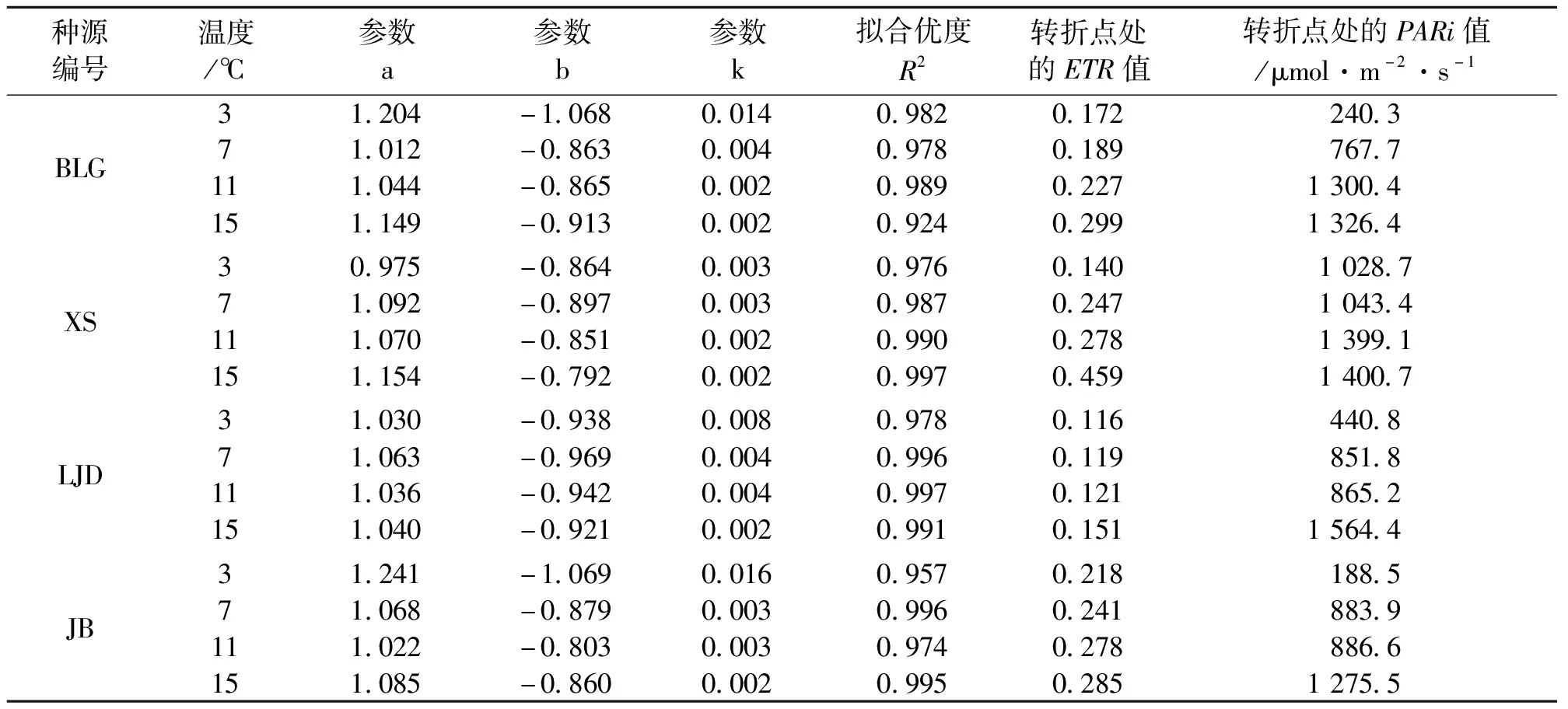
表4 不同种源蒙古莸光化学淬灭系数(qp)的光响应曲线参数

图3 不同种源蒙古莸光化学淬灭系数(qp)的光响应曲线
2.4 低温胁迫后不同光强下非光化学淬灭系数(NPQ)变化
采用方程⑧进行拟合,并计算其转折点。
y=a+b·〔1-Exp(-kx)〕
⑧
式中:y为NPQ的值,x为PARi的值,a、b、k为参数,见表5。非光化学淬灭系数NPQ表示天然色素吸收的光能中不能用于光合电子传递而以热的形式耗散的部分,是植物的一种自我保护机制[24],其光响应曲线转折点的光强作为光抑制的初始点,可依此评价树木对光胁迫的适应能力和对光胁迫伤害的保护能力[23]。如图4与表5所示,随着光强的增加,非光化学淬灭系数先快速上升,当到达转折点后其值增长缓慢,后基本保持不变。随着温度的降低,各种源蒙古莸的非光化学淬灭系数减小,且转折点处的NPQ值和光强度均减小。不同温度下,各种源蒙古莸对光胁迫伤害的保护能力由强到弱依次为3℃(XS、BLG、JB、LJD)、7 ℃(BLG、XS、JB、LJD)、11 ℃(BLG、XS、JB、LJD)、15 ℃(BLG、XS、JB、LJD)。

表5 不同种源蒙古莸非光化学淬灭系数(NPQ)的光响应曲线参数
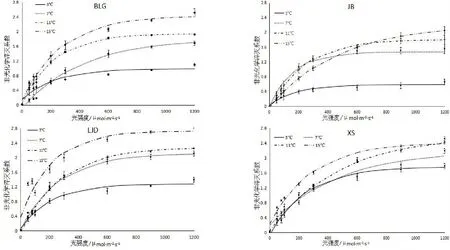
图4 不同种源蒙古莸非光化学淬灭系数(NPQ)的光响应曲线
2.5 低温胁迫后不同光强下PSⅠ和PSⅡ光系统间激发能不平衡系数(β/α-1)变化
采用方程⑨进行拟合。
y=c·x+b
⑨
式中:y为(β/α-1)的值,x为PARi的值,c为曲线斜率,b为参数,见表6。PSⅠ和PSⅡ光系统间激发能不平衡系数(β/α-1)代表激发能在2个光系统间分配偏离程度[15],其光响应曲线斜率越大,其随着光强增强所偏离的程度就越大。随着低温胁迫程度的加大,激发能在2个光系统间分配偏离程度越大,如图5与表6所示。光强为0时,双光系统间激发能不平衡系数接近于0,随着光强的增加,不平衡系数快速增加。随着温度的降低,各种源蒙古莸的双光系统间激发能不平衡系数的光响应曲线斜率有不同程度上的增大,各种源在7、11、15 ℃时其曲线斜率均较为接近,3 ℃时曲线斜率较其他3个温度的曲线斜率有较大的差距。3 ℃条件下,各种源蒙古莸光系统间激发能不平衡系数光响应曲线斜率由大到小依次为XS、BLG、JB、LJD。
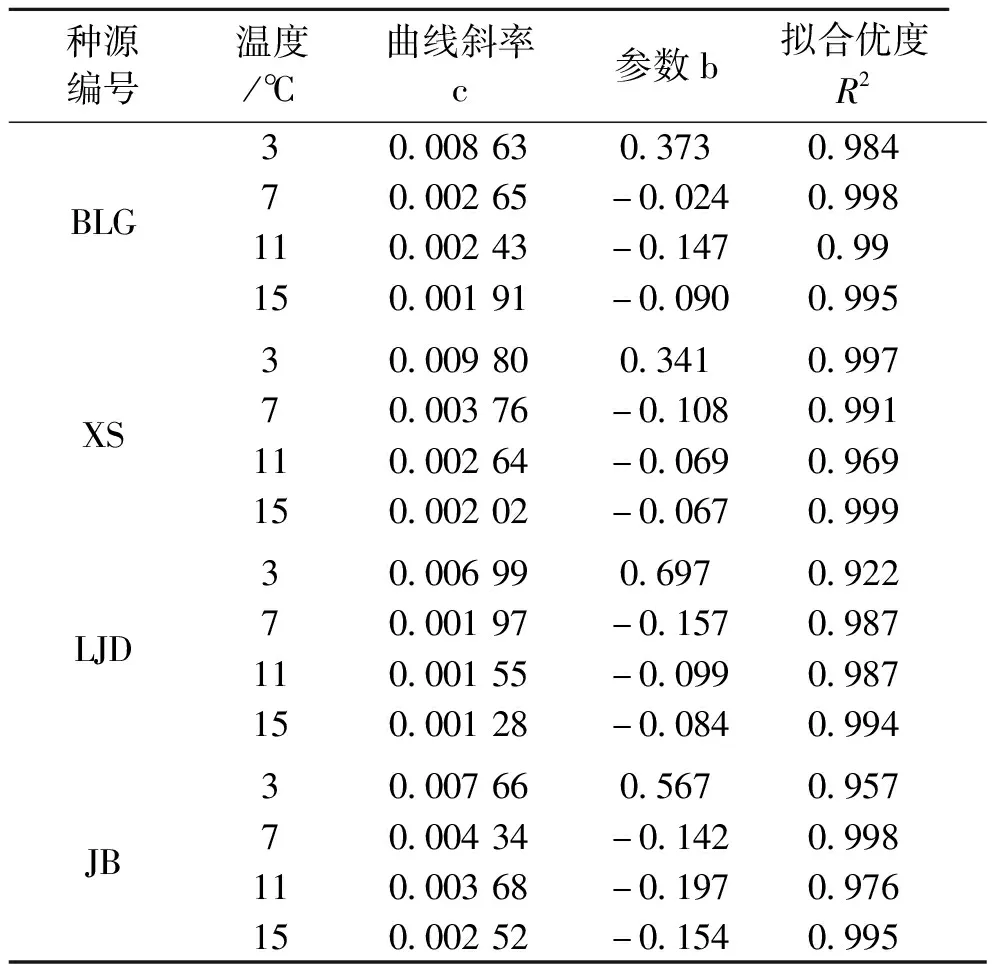
表6 不同种源蒙古莸双光系统间激发能不平衡系数(β/α-1)的光响应曲线参数表

图5 不同种源蒙古莸双光系统间激发能不平衡系数(β/α-1)的光响应曲线
2.6 低温胁迫后各种源蒙古莸最大光化学效率(Fv/Fm)的变化
Fv/Fm被作为表征光合性能的敏感指标[25],Fv/Fm下降越多,表明 PSⅡ损伤越大[26]。由表7可知,各种源蒙古莸在低温胁迫后,Fv/Fm均有所降低,XS、LJD、JB种源在3 ℃时与其他温度均存在显著差异,其中LJD种源在7 ℃时与其他温度也存在显著差异,BLG种源7 ℃时与其他温度均无显著差异,各种源在11 ℃与15 ℃时均不存在显著差异。各种源中随温度降低,Fv/Fm下降最显著的是LJD。

表7 不同程度低温胁迫对各种源蒙古莸最大光化学效率(Fv/Fm)的影响
3 讨论与结论
当植物处于逆境胁迫时,PSⅡ反应中心会变得敏感,而叶绿素荧光参数可以很好地反映PSⅡ的生理状态[27-28],因此可通过叶绿素荧光参数了解光合器官针对逆境胁迫做出的许多调节过程。目前,在各项叶绿素荧光指标中NPQ与植物光合能力的关系存在争议[29],本次研究发现随着光强度的增加,qp减小而NPQ加大,两者呈负相关关系,因而可认为相同条件下较大的NPQ值有利于光能耗散,会降低光化学淬灭能力,阻碍植物将捕获的光能有效的利用于光合作用,NPQ值愈高,植物光合性能愈差[29-30]。这与郑淑霞等[31]在研究部分阔叶树种叶绿素荧光特性时发现的qp与NPQ的值呈显著正相关相反。但不同低温胁迫下,蒙古莸各叶绿素荧光动力学参数对不同光强度的响应表明提高NPQ不是其面对光破坏的主要策略,因此不能笼统地用NPQ的值评价不同种源蒙古莸的光合性能。
不同种源苗木在低温胁迫后对光破坏防御能力的差异可能与其种源地立地条件有关,或为植物对外界环境长期适应的结果[32-34],LJD种源地蒙古莸的苗木对光破坏防御能力最差,其种源地为半阳坡,因而光照条件相对较差,无霜期短但其生长季内均温为各种源地最高,这或许导致其对低温胁迫更加敏感。
本试验得出:相同光强度下随着温度的降低,PSⅡ反应中心功能下降,更易失活;蒙古莸主要通过降低电子传递速率(ETR)并降低实际光化学效率(Yield)的方式降低光能捕捉效率,减少过剩光能的积累,并以此减弱光抑制带来的伤害;低温胁迫后对光破坏防御能力最差的是LJD种源,而BLG、JB、XS种源蒙古莸的苗木对光破坏防御能力相对较强。

