TRIP6在乳腺癌中的作用及其机制研究
王春建,聂 刚,毛 艳
1.山东省肿瘤医院乳腺科,山东 济南 250000;2.青岛大学附属医院乳腺病诊疗中心,山东 青岛 266555
乳腺癌是临床常见的恶性肿瘤,是女性癌症死亡的常见原因,浸润性乳腺癌是最常见的病理学类型。中国乳腺癌病例数约占全世界的11%,并且近年来患病率呈上升趋势[1]。随着乳腺癌诊断和治疗技术的发展,患者5年生存率明显提高[2]。复发和远处转移仍然是影响乳腺癌患者预后的主要因素。阐明乳腺癌的发病机制并寻找潜在治疗靶点对改善预后有重要意义。
乳腺是激素依赖性器官,甲状腺激素可以调控乳腺细胞的生长、分化和发育。越来越多的研究表明,甲状腺激素及其受体可以通过影响乳腺癌细胞的增殖、侵袭、分化和代谢等,参与乳腺癌的发生、发展过程,可能是因为甲状腺激素具有类雌激素样作用[3]。甲状腺激素受体相互作用蛋白6(thyroid receptor-interacting protein 6,TRIP6)可以与甲状腺受体相互作用,可作为细胞黏附分子参与细胞骨架重组和细胞迁移等。近年来,多项研究发现,TRIP6可能参与肿瘤细胞的增殖、侵袭和迁移,包括骨肉瘤[4]、子宫内膜癌[5]和胰腺癌[6]等。TRIP6在乳腺癌中的作用及机制既往少有报道。
转录因子叉头框蛋白C1(forkhead box C1,FOXC1)是叉头框超家族的一个重要成员,对细胞增殖、分化、迁移和侵袭有重要影响,可能作为癌基因在乳腺癌中发挥作用[7]。FOXC1基因是TRIP6的靶基因[8]。本研究采用免疫组织化学染色法和蛋白质印迹法(Western blot)检测乳腺癌组织及其配对的癌旁组织、乳腺良性纤维腺瘤组织中TRIP6和FOXC1的表达,另外,通过下调TRIP6基因的表达观察乳腺癌细胞增殖、侵袭和迁移的变化,探讨TRIP6在乳腺癌中的作用及可能机制。
1 材料和方法
1.1 细胞、试剂和仪器
正常乳腺上皮细胞MCF-10A和乳腺癌细胞(BT474、MCF7和MDA-MB-231)均购自中国科学院典型培养物保藏委员会细胞库,胎牛血清、DMEM培养基、SP免疫组织化学试剂盒、BCA蛋白定量检测试剂盒和凝胶快速制备试剂盒购自生工生物工程(上海)股份有限公司,TRIP6兔抗人多克隆抗体(规格:0.2 mL/200 μg,批号:YK0316)、山羊抗兔IgG二抗、β-actin内参抗体均购自上海禾午生物科技有限公司,LipoFiterTM脂质体转染试剂购自上海恒圆生物科技有限公司,TRIP6 si-RNA(序列为5’-CGTACCTTCCACTCGCTTTCT-3’)及si-control(序列为5’-GGAAGUUAGACAAAGAUGAGA-3’)均由上海吉玛制药技术有限公司合成并提供,细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂盒、transwell小室均购自上海沪震实业有限公司。
细胞培养箱购自常州金坛良友仪器有限公司,IX71倒置显微镜购自日本Olympus公司,164-5050电泳仪和iMark酶标仪均购自美国Bio-Rad公司,UVCI-2300凝胶成像仪购自美国Major Science公司。
1.2 患者资料及组织样本
选取2011年1月—2013年12月山东省肿瘤医院手术切除的268例乳腺癌组织及其配对的癌旁组织(距癌组织≥5 cm)。患者均为女性,年龄29~73岁,平均(49.36±9.80)岁。所有患者术前均未接受放疗或化疗。组织石蜡包埋切片由山东省肿瘤医院病理科制作并储存(切片厚度为4 μm)。术后对所有患者进行门诊和电话随访,随访截至2018年12月。另选取乳腺良性纤维腺瘤组织80例作为对照。
1.3 细胞培养
MCF-10A、BT474、MCF7和MDA-MB-231细胞置于含10%胎牛血清、100 μg/mL链霉素及100 U/mL青霉素的DMEM培养液中进行培养,培养条件为37 ℃、CO2体积分数为5%。当细胞融合度达80%时进行传代,用胰蛋白酶消化,以1∶3传代。取5~15代对数生长期生长状态良好的细胞进行后续实验。
1.4 免疫组织化学法检测组织中TRIP6和FOXC1的蛋白水平
取组织石蜡包埋切片,脱蜡至水。将切片放置于柠檬酸盐缓冲液中微波煮沸5 min,冷却至室温。用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤2次,每次5 min,再用蒸馏水洗涤2次,每次3 min。滴加3%过氧化氢除去内源性过氧化物酶,室温温育10 min。随后用山羊血清室温下封闭10 min,滴加TRIP6兔抗人多克隆抗体,4 ℃温育过夜。用PBS洗涤3次,每次3 min,再用蒸馏水洗涤3次,每次3 min。滴加生物素标记的羊抗兔二抗,37 ℃下温育1 h,用PBS洗涤3次,每次3 min。滴加DAB显色液,苏木紫复染。经过脱水、透明、封片处理后在显微镜下观察。
每张切片随机取10个视野,每个视野计数100个癌细胞。参考Ebili等[9]的研究,根据细胞的染色强度及阳性细胞比例判断TRIP6表达情况:①阴性染色记0分,浅黄色1分,棕黄色2分,棕褐色3分;②0%≤阳性细胞数≤10%记1分,10%<阳性细胞数≤50%记2分,50%<阳性细胞数≤80%记3分,80%<阳性细胞数≤100%记4分。将上述2个评分相乘得出最终结果:0分为阴性,1~3分为弱阳性,4~8分为中等阳性,9~12分为强阳性;0~3分为TRIP6低表达,4~12分为TRIP6高表达。
FOXC1的检测方法同上。
1.5 Western blot检测细胞中TRIP6和FOXC1的蛋白水平
取MCF-10A、BT474、MCF7和MDA-M B-231 细胞,用RAPI 裂解液提取总蛋白,用BCA 试剂盒检测蛋白浓度,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,用半干转移法将蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。5%脱脂奶粉封闭2 h,加入抗TRIP6(1∶500)4 ℃温育过夜,第2天除去一抗,用洗膜缓冲液(tris buffered saline Tween,TBST)缓冲液洗涤3次后加入羊抗兔二抗(1∶500),封闭1 h。以β-actin作为内参,电化学发光(electrochemical luminescence,ECL)仪进行蛋白成像,Image J软件分析灰度值。
FOXC1的检测方法同上。
1.6 细胞转染
以2×105个细胞/孔的密度将MDA-MB-231细胞接种于6孔板中。转染前用PBS洗涤细胞2次,加入1.8 mL无血清培养基。分别用100 μL无血清培养基稀释10 μL LipoFiterTM和10 mL TRIP6 si-RNA(或si-control),静置5 min后将两者混匀,随后将混合物加入6孔培养板中。转染24 h后进行后续实验。
1.7 克隆形成实验和CCK-8细胞增殖实验
转染后用胰蛋白酶消化MDA-MB-231细胞,将细胞接种于6孔板中(密度为1 000个细胞/孔),37 ℃、CO2体积分数为5%的条件下培养3周,每2 d换液1次。当出现菌落时停止培养,弃去培养基。4%多聚甲醛溶液固定30 min后用结晶紫染色,计算每孔细胞克隆数目。
将MDA-MB-231细胞接种于6孔板中(密度为1×104个细胞/孔),用CCK-8试剂盒检测细胞活性,在培养24、48、72和96 h时,向每个培养孔中添加10 μL CCK-8试剂,继续培养4 h。用酶标仪在490 nm波长处读取吸光度(D)值,以反映细胞增殖活力。
1.8 Transwell小室实验检测细胞侵袭能力
在transwell迁移板上室铺基质胶,随后将MDA-MB-231细胞接种于transwell小室(24孔,孔径5.0 μm)中,以2×105个细胞/mL的密度将细胞加入上室中;下室中加入培养基。培养48 h后取出小室,用棉签拭去微孔膜上室的细胞。用PBS冲洗小室3遍。用4%多聚甲醛溶液固定黏附于下室微孔膜下面的细胞,结晶紫染色15 min,干燥后在显微镜下观察,计算侵袭细胞数。
1.9 细胞划痕实验检测细胞迁移能力
转染后以5×104个细胞/孔的密度将MDAMB-231细胞接种于6孔板中,当细胞融合度达90%时用无菌枪头进行划痕处理。首先吸去原培养基,然后用PBS洗涤3次,随后加入无血清培养基继续培养。在培养0、24 h时用显微镜拍照,划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%[10]。
1.10 统计学处理
本研究的各项实验均重复5次。应用SPSS 20.0统计软件处理数据,计量资料以表示,两两比较采用独立样本t检验。多组间比较采用方差分析,组内两两比较采用LSD检验。计数资料用率表示,组间比较采用χ2检验。多因素分析采用COX比例风险回归模型。等级资料比较采用非参数检验。生存分析采用Kaplan-Meier法,组间生存率比较采用log-rank检验。相关性分析采用Spearman秩相关分析或Pearson相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 TRIP6和FOXC1在乳腺癌组织和细胞中的表达
采用免疫组织化学染色法检测268例乳腺癌组织及其配对的癌旁组织、80例乳腺良性纤维腺瘤组织中TRIP6和FOXC1的表达,结果显示,TRIP6和FOXC1均主要在细胞质中表达(图1)。乳腺癌组织中TRIP6及FOXC1的阳性表达率分别为85.08%和88.06%,均高于良性纤维腺瘤组织(25.00%和15.00%)和乳腺癌癌旁组织(55.97%和62.31%)(P均<0.01,表1)。Spearman秩相关分析结果显示,乳腺癌组织中TRIP6与FOXC1的阳性表达率呈正相关(r=0.771,P<0.001)。
Western blot检测结果显示,MDA-MB-231细胞中TRIP6和FOXC1蛋白的相对表达量分别为1.38±0.16和1.20±0.20,MCF-7细胞分别为0.59±0.08和0.41±0.09,BT474细胞分别为1.26±0.21和0.92±0.25,均高于MCF10A细胞的0.32±0.05和0.38±0.05(P均<0.05,图2A)。MDA-MB-231细胞中TRIP6与FOXC1蛋白相对表达量呈正相关(r=0.908,P=0.033,图2B)。
2.2 TRIP6和FOXC1与乳腺癌预后的关系
单因素和COX多因素分析结果显示,淋巴结转移、TNM分期为Ⅲ~Ⅳ期、TRIP6高表达和FOXC1高表达是乳腺癌患者总生存时间(overall survival,OS)和无进展生存时间(progression-free survival,PFS)的独立影响因素(P均<0.05,表2)。生存曲线分析显示,TRIP6高表达乳腺癌患者的OS率和PFS率均低于TRIP6低表达患者(χ2=31.112,P<0.001;χ2=30.073,P<0.001);FOXC1高表达乳腺癌患者的OS率和PFS率均低于FOXC1低表达患者(χ2=45.897,P<0.001;χ2=57.324,P<0.001,图3)。
2.3 沉默TRIP6基因对MDA-MB-231细胞增殖、侵袭和迁移的影响
Western blot检测结果显示,TRIP6 si-RNA组TRIP6蛋白相对表达量为0.42±0.09,明显低于si-control组的1.21±0.08(P<0.001,图4)。克隆形成实验检测细胞增殖的结果显示,TRIP6 si-RNA组克隆细胞数为(49.70±10.34)个,明显低于si-control组的(149.56±63.78)个(P<0.001,图5A)。CCK-8实验检测细胞增殖活力的结果显示,TRIP6 si-RNA组细胞培养第72和96 h时D值分别为0.39±0.05和0.53±0.07,均低于si-control组的0.58±0.03和0.76±0.07(P均<0.01,图5B)。Transwell小室实验检测细胞侵袭的结果显示,TRIP6 si-RNA组细胞侵袭数为(31.67±10.17)个,明显低于si-control组的(103.56±31.74)个(P<0.001,图5C)。细胞划痕实验检测细胞迁移的结果显示,TRIP6 si-RNA组细胞迁移率为(19.12±3.87)%,明显低于sicontrol组的(38.82±8.51)%(P<0.01,图5D)。
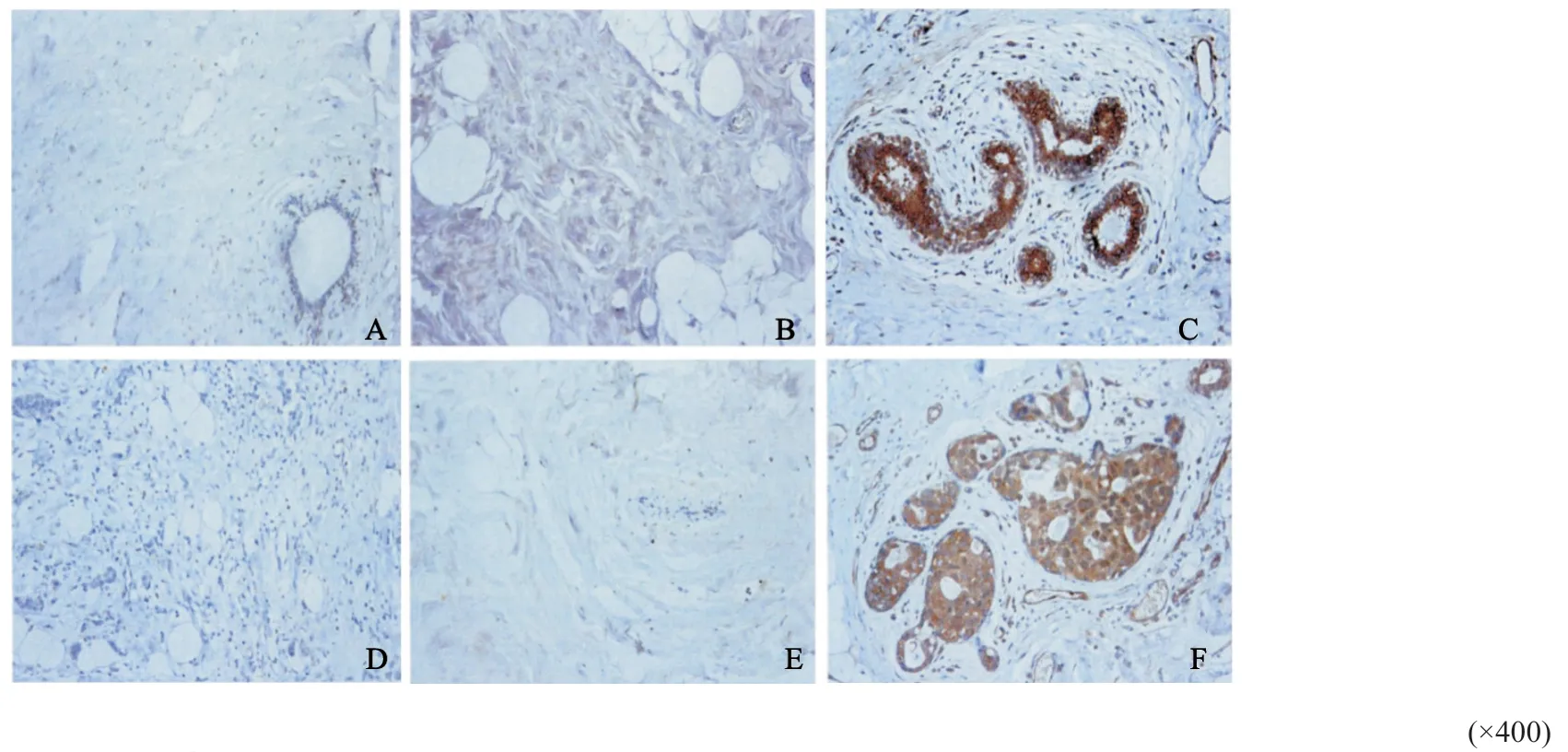
图1 免疫组织化学染色法检测良性纤维腺瘤组织、乳腺癌癌旁组织和乳腺癌组织中TRIP6和FOXC1的表达Fig.1 Immunohistochemical staining to detect the expressions of TRIP6 and FOXC1 in benign fibroadenoma tissue,breast cancer adjacent tissue and breast cancer tissue

表1 TRIP6和FOXC1在良性纤维腺瘤组织、乳腺癌癌旁组织和乳腺癌组织中的表达情况Table.1 Expression of TRIP6 and FOXC1 in benign fibroadenoma tissue,breast cancer adjacent tissue and breast cancer tissue[n (%)]

图2 Western blot检测细胞中TRIP6和FOXC1的表达Fig.2 Western blot was uesd to detect the expressions of TRIP6 and FOXC1 in cells

表2 单因素和多因素分析乳腺癌患者的总体生存预后Tab.2 Univariate and multivariate analyses of the total survival of breast cancer patients

图3 乳腺癌患者的生存曲线分析Fig.3 Analysis of survival curve of patients with breast cancer
2.4 沉默TRIP6基因对FOXC1蛋白水平的影响
Western blot检测结果显示,TRIP6 si-RNA组TRIP6蛋白相对表达量为0.18±0.06,明显低于si-control组的1.01±0.08(P<0.001,图6)。

图4 沉默TRIP6基因对MDA-MB-231细胞TRIP6蛋白表达的影响Fig.4 Effect of TRIP6 gene silencing on TRIP6 protein expression in MDA-MB-231 cells

图5 沉默TRIP6基因对MDA-MB-231细胞增殖、侵袭和迁移的影响Fig.5 Effects of silencing TRIP6 gene on proliferation,invasion and migration of MDA-MB-231 cells

图6 沉默TRIP6基因对FOXC1蛋白表达的影响Fig.6 Effect of silencing TRIP6 gene on FOXC1 protein expression
3 讨 论
乳腺癌是女性最常见的恶性肿瘤,严重影响患者的健康与生命[11]。寻找乳腺癌潜在的生物学标志物对改善患者的生存预后有重要意义。TRIP6又被称为Zyxin相关蛋白,属于LIM蛋白Zyxin家族的一种调节蛋白[6]。TRIP6最早被发现可以与甲状腺素受体相互作用,之后越来越多的研究[6,12]证实,TRIP6可以作为黏附分子而发挥作用,参与细胞骨架重组、细胞间黏附、细胞凋亡、细胞侵袭、迁移和转录调控等。既往研究发现,TRIP6在骨肉瘤[4]、子宫内膜癌[5]、胰腺癌[6,13]、肝细胞癌[8]和胃癌[14-15]等肿瘤中高表达,可能参与肿瘤的发生、发展,其机制可能涉及:①TRIP6与α-生育酚转运蛋白相互结合,激活Wnt/β-catenin信号通路[16],促进癌细胞增殖,TRIP6通过抑制FOXO3a来抑制癌细胞增殖[17];②TRIP6与TRAF6协同调节LPA2受体信号转导,导致慢性炎症、抗凋亡和细胞侵袭[18];③TRIP6通过PI3K/AKT、Nothch和MMP信号通路等促进癌细胞迁移[6]。
本研究采用免疫组织化学染色法检测了组织中TRIP6的表达,采用Western blot检测了细胞中TRIP6的表达,结果显示,乳腺癌组织中TRIP6的阳性表达率均高于乳腺良性纤维腺瘤组织和乳腺癌癌旁组织,乳腺癌细胞中TRIP6的相对表达水平明显高于正常乳腺上皮细胞,提示TRIP6可能参与乳腺癌的发生、发展过程。甲状腺激素及其受体可以通过影响乳腺癌细胞的增殖、侵袭和分化,进而促进乳腺癌的发展。TRIP6可以与甲状腺激素受体相互作用,进而可能调控乳腺癌的发展,然而既往鲜有相关报道。Zhao等[19]研究发现,TRIP6可能通过Wnt/β-catenin信号转导通路增强乳腺癌的干细胞特性,进而可能促进癌细胞的侵袭。本研究发现,乳腺癌组织中、MDAMB-231细胞中TRIP6与FOXC1的表达呈正相关,提示TRIP6可能通过FOXC1来发挥作用。既往在肝细胞癌的研究中,Wang等[8]已经证实FOXC1是TRIP6的靶基因。既往研究证实,FOXC1可能是乳腺癌的生物标志物,与乳腺癌的发生、发展、化疗敏感性、预后密切相关[20-22]。本研究发现,沉默TRIP6基因后,MDA-MB-231细胞的增殖、侵袭和迁移能力明显下降,进一步证实TRIP6可能通过FOXC1在乳腺癌中发挥作用。
本研究的COX多因素分析和生存曲线分析显示,TRIP6和FOXC1均与乳腺癌患者的生存预后有关,其表达水平越高,患者生存预后越差,提示对TRIP6/FOXC1信号转导通路的靶向干预可能有助于改善乳腺癌患者的预后。
综上所述,TRIP6在乳腺癌的发生、发展中起重要作用,沉默TRIP6基因可以抑制乳腺癌细胞的增殖、侵袭和迁移,并抑制FOXC1的蛋白表达。TRIP6和FOXC1均是乳腺癌患者不良生存预后的独立影响因素,提示对TRIP6/FOXC1信号转导通路的靶向干预可能有助于改善预后。本研究也存在一些局限性,例如,未检测乳腺癌患者血清中TRIP6的表达水平,其对乳腺癌早期诊断及鉴别诊断的价值需要未来进一步分析,也没有直接分析TRIP6与乳腺癌患者甲状腺受体的相互关系,未分析TRIP6与凋亡、细胞周期和化疗敏感性等的关系,而这些对深入理解乳腺癌的发生、发展过程具有重要的意义。

