miR-324-3P对宫颈癌细胞增殖、侵袭和转移的作用及其机制研究
李一鸣,陈 华,袁晓燕,郭东风
海军军医大学附属公利医院,上海 200135 1妇科;2 全科医学科
宫颈癌是常见的妇科肿瘤,是全世界女性,尤其是发展中国家女性肿瘤相关死亡的主要原因[1]。随着宫颈癌早期筛查、诊断技术和治疗手段的不断发展,近年来宫颈癌的发病率和死亡率有所降低,但宫颈癌患者的长期预后仍不容乐观[2]。微RNA(microRNA,miRNA)是一种小的非蛋白质RNA,由19 ~ 25个核苷酸组成,在许多与肿瘤恶性进展密切相关的生物学过程中发挥重要的调节作用[3-4]。miR-324-3P与多种恶性肿瘤密切相关,其可通过多种途径参与非小细胞肺癌、鼻咽癌和胃癌等恶性肿瘤的发生、发展,可起到促癌因子的作用,也可起到抑癌因子的作用[5-7]。miR-324-3P在宫颈癌中的表达未见相关报道。miRNA存在很多靶基因,其主要通过调控不同的靶基因发挥不同的生物学功能,如miR-324-3p通过靶向调控WNT2b在鼻咽癌中发挥抑癌作用[6]。WNT3a为经典的Wnt信号通路中的重要蛋白,与胃癌等恶性肿瘤的发生、发展密切相关,对细胞的分化成熟有重要作用[8]。本研究采用TargetScan7.1软件预测miR-324-3P可能的靶基因,分析miR-324-3P及其靶基因在宫颈癌患者组织中的表达情况及其对癌 细胞增殖、侵袭和转移的作用。
材料与方法
1 主要试剂和材料 Trizol试剂、PrimeScriptTMRT reagent Kit逆转录试剂盒和SYBR Premix EX TaqTMⅡqRT-PCR试剂盒,日本TaKaRa公司;miR-324-3P、WNT3a、内参GAPDH引物,上海生工生物工程有限公司合成;FBS、高糖培养基和胰酶,美国Giboc公司;宫颈癌细胞(HeLa细胞),美国ATCC细胞库;过表达WNT3a质粒、pGLO-WNT3a-野生型质粒(WNT3a-wt)和pGLOWNT3a-突变型质粒(WNT3a-mut),上海吉凯公司;双荧光素酶报道基因检测试剂盒,上海碧云天生物试剂有限公司;miR-324-3P mimic,广州瑞博生物技术有限公司;MTt试剂,北京索莱宝试剂有限公司;Boyden小室,美国BD公司;Transwell小室,美国Coring公司;RIPA和BCA,美国Thermo公司;WNT3a和β-catenin抗体 ,美国Proteintech公司。
2 宫颈组织来源 选择2018年1月- 2019年1月入住我院的原发性宫颈癌患者术后样本40例,纳入标准:1)术后经病理诊断,确诊为宫颈癌;2)患者未接受过任何形式的抗肿瘤治疗。排除标准:1)合并其他类型的恶性肿瘤;2)合并有严重器质性病变;3)不同意参与本次研究。另选取同期我院收治的因子宫疾病切除正常宫颈组织样本40例。所有患者均对本次研究内容知情同意 。所有操作均符合我院伦理委员会要求批件。
3 实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)检测mRNA相对表达量 加入Trizol试剂,依次加入氯仿、异丙醇和乙醇提取RNA。按照PrimeScriptTMRT reagent Kit配制反应体系,85℃ 5 s,37℃ 15 min将RNA逆转录为cDNA。以cDNA为模板,按照SYBR Premix EX TaqTMⅡqRT-PCR配制反应体系,95℃ 5 s,40个95℃ 5 s、65℃ 34 s循环进行PCR扩增,测得各孔循环阈值(threshold cvcle,Ct),按照2−ΔΔCt公式以GAPDH为内参分别计算miR-324-3P和WNT3a mRNA相对表达量。miR-324-3P引物序列F:5′-ACTGC CCCAGGTGCTGCTGG-3′,R:5′- GCGAGCACAG AATTAATACGAC-3′。WNT3a引物序列F:5′-AGCTACCCGATCTGGTGGTC-3′,R:5′-CAAACTCG ATGTCCTCGCTAC-3′。GAPDH引物序列F:5′- GT GAACCATGAGAAGTATG-3′,R:5′-CGGCCATC A CGCCACAGTTTC-3′。
4 细胞培养和转染 宫颈癌细胞(HeLa细胞)复苏后重悬至含有10% FBS的高糖培养基中,置于37℃、5% CO2、全湿度培养箱中培养。细胞融合度为95%左右时,以一传三进行细胞传代。细胞长满时采用胰酶消化,1×105/孔接种至6孔板中,分为对照组(NC组)、miR-324-3P mimic组和miR-324-3P mimic+oe-WNT3a组。细胞接种12 h后采用Lipofectamine 2000转染试剂进行质粒转染,无关序列转染NC组细胞,miR-324-3P模拟物(mimic)转染miR-324-3P mimic组细胞,miR-324-3P mimic和WNT3a过表达质粒同时转染miR-324-3P mimic+o e-WNT3a组细胞,放至培养箱中培养。
5 验证miR-324-3P靶向调控WNT3a TargetScan 7.1软件(http://www.targetscan.org)预测miR-324-3P可能的靶基因。HeLa细胞长满时采用胰酶消化,2 000/孔接种到96孔板中,分为:NC+WNT3a-wt组;miR-324-3P+WNT3a-wt组;NC+WNT3a-mut组;miR-324-3P+WNT3a-mut组,无关序列与WNT3a-wt同时转染NC+WNT3a-wt组细胞,miR-324-3P mimic与WNT3a-wt同时转染miR-324-3P+WNT3a-wt组细胞,无关序列与WNT3a-mut同时转染NC+WNT3a-mut组细胞,miR-324-3P mimic与WNT3a-mut同时转染miR-324-3P+WNT3a-mut组细胞,收集转染48 h时的各组细胞,采用双荧光素酶报告基因检测试剂盒检 测各组细胞荧光素酶活性。
6 四 唑 盐 比 色 法(methyl thiazolyl tetrazolium,MTT)实验检测细胞增殖能力 HeLa细胞长满时采用胰酶消化,1 500/孔接种到96孔板中,分为NC组、miR-324-3P mimic组和miR-324-3P mimic+oe-WNT3a组,按照前文中的细胞转染方法进行转染。在细胞转染48 h时,加入20 µL MTT试剂,培养箱中孵育4 h,弃培养基,加入150 µL DMSO试剂溶解晶体。在490 nm处测得各样品的OD值。细胞增殖率=实验组OD值/对照组O D值×100%。
7 Boyden实验检测细胞侵袭能力 各组细胞转染48 h后,胰酶消化收集,PBS洗3次后,100 µL无血清高糖培养基重悬1×105个细胞,加至Boyden小室上室底部的微孔膜上,然后放入含有500 µL高糖完全培养基的24孔板中,使微孔膜下室面与24孔板中的培养基接触。培养箱中培养12 h后取出Boyden小室,微孔膜上室面细胞采用PBS洗去后,下室面细胞经甲醇固定、结晶紫染色后,计算 穿膜的细胞数。
8 Transwell实验检测细胞转移能力 各组细胞转染48 h后,胰酶消化收集,PBS洗3后,100 µL无血清高糖培养基重悬1×105个细胞,加至Transwell小室上室底部的微孔膜上,然后放入含有500 µL高糖完全培养基的24孔板中,使微孔膜下室面与24孔板中的培养基接触。培养箱中培养12 h后取出Transwell小室,微孔膜上室面细胞采用PBS洗去后,下室面细胞经甲醇固定、结晶紫 染色后,计算穿膜的细胞数。
9 Western-blot法检测WNT3a、β-catenin等蛋白表达 各组细胞转染48 h后,胰酶消化收集,PBS洗3次,加入RIPA混匀细胞后震荡裂解30 min,4℃高速离心20 min,将上清蛋白裂解液移至新EP管中,采用BCA蛋白浓度检测试剂盒获得各样品蛋白浓度。蛋白裂解液中加入上样缓冲液,蛋白进行煮沸变性。上样行凝胶电泳分离蛋白,湿性转PVDF膜,8%脱脂牛奶孵育PVDF膜,一抗稀释液WNT3a和β-catenin 4℃孵育过夜,二抗室温孵育1 h,ECL化学发光法曝光蛋 白条带。
10 统计学分析 使用SPSS22.0统计软件进行分析。计量数据均通过正态性检验,以±s 表示,两组间的比较为成组t检验或校正t检验(统计量为t),多组间的比较为单因素方差分析(统计量为F)+两两比较LSD-t检验(统计量LSD-t)。检验水准 α=0.05。
结 果
1 miR-324-3P对WNT3a的靶向调控作用 Target Scan 7.1软件在线预测显示,WNT3a启动子区与miR-324-3P具有结合位点(图1)。双荧光素酶报告基因试验结果显示:与NC+WNT3a-wt共转染组相比,miR-324-3P+WNT3a-wt共转染组的荧光素酶 活 性 降 低(1.00±0.05 vs 0.53±0.08,t=12.203,P=0.000);而NC+WNT3a-mut组与miR-324-3P+WNT3a-mut组间的荧光素酶活性差异无统计学意义(1.00±0.03 vs 0.93±0.15,t=1.121,P=0.289)。与NC组相比,miR-324-3P mimic组中WNT3a mRNA的 表 达 降 低(1.00±0.01 vs 0.43±0.08,t=17.318,P =0.000)。miR-324-3P靶向负调控WNT3a(图2)。
2 宫颈癌组织中miR-324-3P和WNT3a的表达水平 miR-324-3P在宫颈癌组织中的相对表达量为0.79±0.39,在宫颈正常组织中为1.00±0.34,与宫颈正常组织相比,宫颈癌组织中miR-324-3P的表达水平下降(t=2.567,P=0.012),见图3A。WNT3a mRNA在宫颈癌组织中的相对表达量为1.46±0.53,在宫颈正常组织中为1.00±0.30,与宫颈正常组织相比,宫颈癌组织中WNT3a mRNA的表达水平升高 (t=4.777,P=0.000),见图3B。

图 1 WNT3a启动子区与miR-324-3P的结合位点F ig.1 Binding site of WNT3a promoter region with miR-324-3p

图 2 miR-324-3P对WNT3a的靶向调控作用 (aP<0.05)F ig.2 Targeted regulation of miR-324-3p on WNT3a (aP<0.05)
3 miR-324-3P与WNT3a在宫颈癌组织中表达的相关性 Pearson分析结果显示,宫颈癌组织中miR-324-3P与WNT3a mRNA表达呈负相关(r=− 0.503,P=0.000)。
4 miR-324-3P调控WNT3a对TE1细胞增殖能力的影响 MTT实验检测结果显示,NC组细胞增殖率为100.14%±6.35%,miR-324-3P mimic组细胞增殖率为28.54%±4.58%,miR-324-3P mimic+oe-WNT3a组细胞增殖率为59.97%±7.48%。与NC组相比,miR-324-3P mimic组和miR-324-3P mimic+oe-WNT3a组细胞增殖能力降低(t=22.401、10.028,P=0.000、0.000)。而 与miR-324-3P mimic组 相比,miR-324-3P mimic+oe-WNT3a组细胞增殖能力增强(t=8.778,P=0.000),提示WNT3a削弱了miR-324-3P对细胞增殖能力的抑制作用。见图 4。

图 3 miR-324-3P(A)、WNT3a(B)在宫颈癌和宫颈正常组织中的表达水平Fig.3 Expression levels of miR-324-3p (A) and WNT3a (B) in cervical cancer and normal cervical tissues

图 4 miR-324-3P调控WNT3a对TE1细胞增殖能力的影响(aP<0.05)Fig.4 Effect of miR-324-3p on proliferation of TE1 cells regulated by WNT3a (aP<0.05)
5 miR-324-3P调控WNT3a对TE1细胞侵袭能力的影响 Boyden检测结果显示,NC组穿膜细胞数为71.33±5.98,miR-324-3P mimic组穿膜细胞数为25.67±6.55,miR-324-3P mimic+oe-WNT3a组穿膜细胞数为49.33±2.85。与NC组相比,miR-324-3P mimic组和miR-324-3P mimic+oe-WNT3a组细胞侵袭能力降低(t=12.610、8.135,P=0.000、0.000)。与miR-324-3P mimic组相比,miR-324-3P mimic+oe-WNT3a组细胞侵袭能力增强(t=8.113,P=0.000),提示WNT3a削弱了miR-324-3P对细胞侵 袭能力的抑制作用。见图5。
6 miR-324-3P调控WNT3a对TE1细胞转移能力的影响 Transwell检测结果显示,NC组穿膜细胞数为89.67±4.22,miR-324-3P mimic组穿膜细胞数为40.33±3.84,miR-324-3P mimic+oe-WNT3a组穿膜细胞数为63.33±2.88。与NC组相比,miR-324-3P mimic组和miR-324-3P mimic+oe-WNT3a组细胞转移能力降低(t=21.182、12.628,P=0.000、0.000)。与miR-324-3P mimic组相比,miR-324-3P mimic+oe-WNT3a组细胞转移能力增加(t=11.737,P=0.000),提示WNT3a削弱了miR-324-3P对细胞转 移能力的抑制作用。见图6。
7 miR-324-3P调控WNT3a对wnt/β-catenin的影响 Western blot检测结果显示,与NC组相比,miR-324-3P mimic组 和 miR-324-3P mimic+oe-WNT3a组细胞中WNT3a和β-catenin蛋白表达降低(P<0.05)。与miR-324-3P mimic组相比,miR-324-3P mimic+oe-WNT3a组细胞中WNT3a和βcatenin蛋白表达升高(P<0.05),提示WNT3a削弱 了miR-324-3P对β-catenin的抑制作用。见图7。
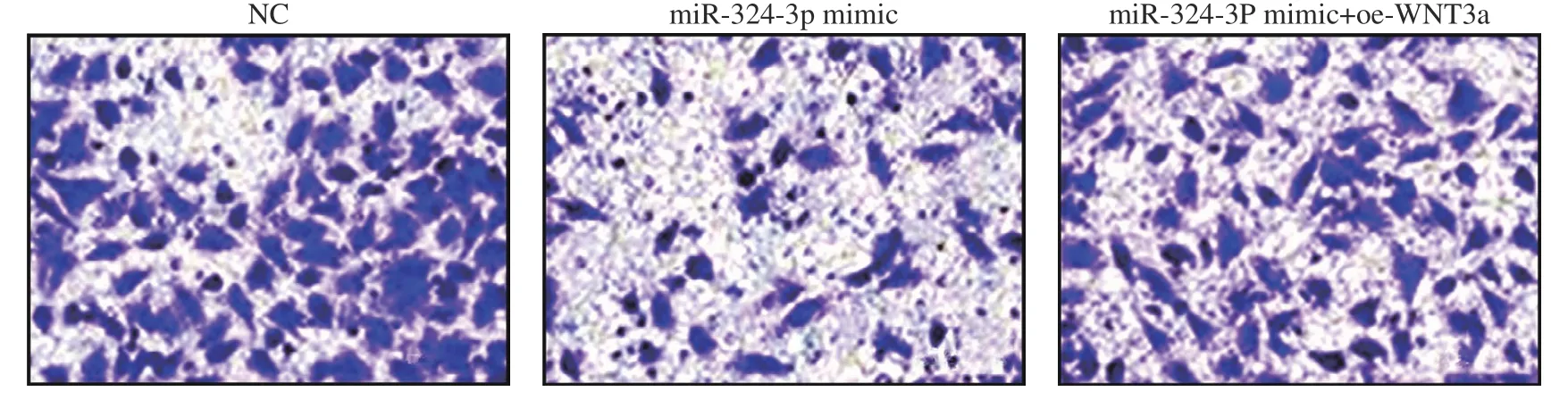
图 5 miR-324-3P调控WNT3a对MKN1细胞侵袭能力的影响(200×)Fig.5 Effect of miR-324-3p on invasion of MKN1 cells under WNT3a regulation (200×)

图 6 miR-324-3P调控WNT3a对MKN1细胞转移能力的影响(200×)F i g.6 Effect of miR-324-3p on the metastatic ability of MKN1 cells under WNT3a regulation (200×)

图 7 miR-324-3P负靶向调控WNT3a对wnt/β-catenin的影响 (aP<0.05)F ig.7 Effect of miR-324-3p negative targeting WNT3a on wnt/β-Catenin (aP<0.05)
讨 论
2018年全球约有57万名女性被诊断出患有宫颈癌,有31万例左右患者死于宫颈癌[9]。当前的新辅助放疗和化疗组合对于早期宫颈癌患者具有较好的疗效,然而对于晚期宫颈癌患者的治疗效果仍然不能令人满意,转移性晚期宫颈癌患者的5年生存率仅为16.5%[10]。目前宫颈癌具体的发病机制尚未明确,因此需深入研究宫颈癌发病的分子机制,为寻找宫颈癌新的治疗策略提供参考。
研究发现miR-324-3p在非小细胞肺癌组织样本中表达降低,并可与长链非编码RNA LOXL1-AS1影响非小细胞肺癌增殖和侵袭能力[5]。miR-324-3p在鼻咽癌组织中表达下调,其可通过影响上皮-间质转化的E-钙黏蛋白和波形蛋白等生物标志物的表达水平抑制鼻咽癌细胞的迁移和侵袭能力[11]。Sun等[7]报道胃癌组织中miR-324-3p表达增加,并促进了胃癌细胞生长和迁移,抑制细胞的凋亡。miR-324-3p可发挥促癌和抑癌的双重作用。研究结果显示,与正常宫颈组织相比,宫颈癌组织中miR-324-3p的表达下降。在HeLa细胞中转染miR-324-3p mimic后,MTT、Transwell和Boyden功能实验发现过表达miR-324-3p的HeLa细胞增殖、侵袭和转移能力降低,表明低表达的miR-324-3p在宫颈癌组织中有抑癌作用。
报道显示,在胃癌细胞中miR-324-3p通过抑制Smad4的表达激活Wnt/β-catenin信号通路,进而参与肿瘤的恶性进展[7]。Wnt/β-catenin信号通路是促进肿瘤发生发展的重要信号途径,其激活后可增强肿瘤细胞的增殖、侵袭和转移能力[12-13]。miR-324-3p可靶向调控WNT2b[6],WNT2b为Wnt蛋白家族之一,Wnt家族蛋白在启动Wnt/βcatenin信号通路活化过程中发挥重要作用[14]。以上文献提示miR-324-3p可能与Wnt/β-catenin信号通路相关,本研究采用TargetScan 7.1软件在线预测发现WNT3a可能是miR-324-3p的靶基因。WNT3a属于Wnt蛋白家族之一,在宫颈癌中表达增加,发挥促癌作用[15]。本研究结果显示,WNT3a在宫颈癌组织中表达增加,与已有的研究结果一致。同时Pearson相关分析发现,miR-324-3p与WNT3a在宫颈癌组织中表达呈负相关性,且在过表达miR-324-3p的宫颈癌细胞中WNT3a mRNA的表达降低,结合双荧光素酶报道基因试验结果表明miR-324-3p可负靶向调控WNT3a。在过表达miR-324-3p的宫颈癌细胞中过表达WNT3a的功能实验发现,WNT3a可以削弱miR-324-3p抑制的宫颈癌细胞增殖、侵袭和转移能力,表明miR-324-3p通过靶向WNT3a抑制宫颈癌的恶性进展。β-catenin是Wnt/β-catenin信号通路中重要的功能蛋白,通过与转录因子相互作用促进信号途径的转导[16-17]。本文Westernblot检测发现,WNT3a可部分恢复过表达miR-324-3p宫颈癌细胞中的β-catenin蛋白,表明miR-324-3p可靶向WNT3a调控Wnt/β-catenin信号通路。
综上所述,miR-324-3p在宫颈癌组织中表达下调,并靶向WNT3a抑制宫颈癌细胞增殖、侵袭和转移能力,可能是通过调控Wnt/β-catenin信号通路发挥作用。提高miR-324-3p的表达可能是宫颈癌治疗的新策略。

