NCX1通过介导钙离子内流损伤足细胞的机制研究
崔少远,傅 博,王 旭,陈香美
解放军总医院第一医学中心 肾脏病科,肾脏疾病国家重点实验室,北京 100853
蛋白尿是原发性肾小球疾病基本的临床表现,也是慢性肾脏疾病(chronic kidney disease,CKD)进展的独立危险因素,其通过改变肾小球血流动力学、损伤肾小球毛细血管壁及系膜细胞等造成肾小球硬化,大量蛋白尿的持续存使肾损伤进行性加重,最终导致终末期肾病[1]。降低蛋白尿是治疗肾病的关键,对早期防治CKD具有重要意义。
目前认为蛋白尿发生的主要原因是肾小球滤过屏障结构和功能改变,肾小球滤过屏障主要由足细胞及足细胞足突裂隙膜(slit diaphragm,SD)组成,足突附着在肾小球基底膜(glomerular basement membrane,GBM)的肾小球毛细血管上,形成细胞间连接,从而产生隔膜滤过屏障,帮助维持正常肾功能[2];足细胞损伤后足突消失、细胞凋亡,导致肾小球滤过屏障破坏,是局灶节段性肾小球硬化、微小病变肾病以及糖尿病肾病等疾病患者发生蛋白尿的关键因素[3]。足细胞结构蛋白Nephrin、NEPH1、P-cadherin、FAT、ephrin-B1、TRPC6等关键分子组成SD复合物,细胞骨架协同蛋白Synaptopodin、ZO-1、Podocin、CD2AP、MAGI等连接裂隙膜与细胞骨架,这些蛋白调节足细胞骨架维持足突的复杂结构,使其行使正常的滤过功能[4-5]。而在一些有害因素的刺激下,足细胞内钙离子浓度可持续性升高,即钙超载,钙超载会对足细胞产生不可逆损伤,使足细胞凋亡、分离,足突结构改变及数量减少,破坏肾小球结构动态平衡,改变肾小球滤过系数,导致蛋白尿的发生[6]。
Ca2+是机体各项生理活动不可缺少的离子,作为第二信使参与多条信号通路转导发挥重要作用,维持胞内钙稳态主要指维持内质网钙库、质膜钙泵及钙离子通道的钙稳态[7]。NCX1作为调控Ca2+的重要通道,是广泛分布于膜结构(如细胞质膜、线粒体膜、内质网膜等)的阳离子转运蛋白,功能上具有两种转运模式:介导Na+内流、Ca2+外排的前向模式(forward mode)和作用相反的反向模式(reverse mode)[8]。在有害因素刺激下,NCX1反向模式的异常激活导致胞内Ca2+浓度持续升高,形成钙超载,启动下游钙离子信号通路,导致病理反应[9-10]。
本研究建立被动型海曼肾炎(passive Heymann nephritis,PHN)大鼠模型,探讨钠钙交换蛋白1(sodium-calcium exchanger 1,NCX1)与蛋白尿的关系;体外培养足细胞,建立补体激活足细胞损伤模型,检测胞内Ca2+变化及下游信号通路的激活情况,观察足细胞骨架蛋白及相关蛋白的表达,NCX1反向作用抑制剂KB-R7943能否有效减轻足细胞损伤,阐明NCX1在足细胞损伤中的重要 作用和可能机制。
材料和方法
1 实验材料 SD大鼠购自北京维通利华实验动物技术有限公司,于解放军总医院第一医学中心SPF级屏障实验动物中心饲养;小鼠足细胞条件永生系MPC-5为美国Bronx大学的Dr. Peter Mundel惠赠;Ca2+探针Fluo-3、F-actin探针购自Thermo Scientific公司,NCX1、Nephrin、Synaptopodin抗体购自CST公司,RhoA、ROCK1、ROCK2抗体购自Abcam公司,体外毒理学检测试剂盒、C6补体血清及不含C6的补体血清、KB-R7943购自S igma-Aldrich公司。
2 建立PHN大鼠模型 近曲肾小管刷状缘抗原Fx1A提取:200 ~ 250 g雄性SPF级SD大鼠25只,3%戊巴比妥钠腹腔麻醉,取腹正中切口,心脏取血后左心室注入0.9%氯化钠注射液灌洗肾致肾变白,取下肾,低温下分离肾皮质。取无血的肾皮质加入甘露醇-Tris-HCl缓冲液(10 mL/g肾皮质),玻璃匀浆器制匀,肾皮质匀浆,加入1 mol/L MgCl2至浓度为10 mmol/L,搅拌15 min,2 200 g离心20 min,取上清,100 000 g 4℃离心45 min,收集沉淀,冷冻干燥,−20℃保存,近曲肾小管刷状缘抗原Fx1A提取已完成。兔抗大鼠Fx1A抗血清制备:雄性新西兰大白兔4只,体质量约2.5 kg,通过足趾一腘窝淋巴结一背部皮内皮下多点注射混合免疫法免疫兔子,末次注射免疫原后10 d试血。从耳静脉采血检测效价达1︰32 000以上时,颈动脉插管放血,分离Fx1A抗血清。使用前56℃灭活补体30 min,大鼠血球吸附,抗血清小量分装,−20℃保存;雄性Wistar大鼠30只,随机分为两组,一组经腹腔一次性注射蒸馏水,剂量为0.8 mL/100g,另外一组经腹腔一次性注射等量兔抗Fx1A抗血清。于第1周末开始测定大鼠24 h尿蛋白定量,金属代谢笼收集24 h尿液,全自动生化分析仪测定尿蛋白,当24 h尿蛋白定量>1 0 mg时认为模型建立成功。
3 建立体外补体激活足细胞损伤模型 对照组(Con组):小鼠足细胞MPC-5用含Rabbit anti-Fx1A抗体5 mg/mL的无血清培养液37℃孵育30 min,孵育后用不含C6补体的血清37℃孵育60 min。补体激活足细胞损伤模型组(C5b-9组):小鼠足细胞MPC-5用含Rabbit anti-Fx1A 抗体5 mg/mL的无血清培养液37℃孵育30 min,然后用含C6补体的亚溶解剂量的补体血清(稀释度为8%)的细胞培养液37℃孵育60 min。Checkerboard titration studies 法确定细胞亚溶解剂量,体外毒理学检测试剂盒(Sigma-Aldrich)测定细胞培养上清液中乳酸脱氢酶的含量确定造模成功。NCX1反向模式抑制剂KB-R7943处理组(KB-R7943组):5µmol/L KB-R7943预处理足细胞24 h,含Rabbit anti-Fx1A抗体5 mg/mL的无血清培养液37℃孵育30 min,然后用含亚溶解剂量的补体血清(稀释度为8%)的细 胞培养液37℃孵育60 min。
4 胞 内Ca2+检 测 Ca2+探 针Fluo-3 5 µmol/L 37℃避光孵育细胞30 min,PBS洗涤3次,激光共聚焦显微镜(Olympus FV1000)上机观察,扫描图 像,数据分析。
5 免疫荧光检测 标本置于预冷的4% 多聚甲醛,4℃ 固定20 min,PBS洗涤3次;0.1%的TritonX-100 4℃透化20 min,PBS洗涤3次;5%BSA室温封闭20 min,加入一抗4℃孵育过夜;洗涤,加入二抗,室温1 h。激光共聚焦显微镜( Olympus FV1000)上机观察,扫描图像。
6 Western blot检测 裂解标本,提取蛋白,变性,电泳分离目标蛋白,转膜,一抗4℃孵育过夜,TBST洗涤;二抗室温孵育1 h。化学发光仪(美国UVP)检测,拍摄图像,灰度分析软件Q uantity One计算灰度值,统计分析。
7 统计学方法 采用Graphpad Prism 7软件进行图表制作及统计分析。观测数据均为计量资料,以 x¯ ±s表示。组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意 义。
结 果
1 PHN大鼠模型中NCX1表达水平的变化 免疫荧光染色结果显示,与对照组比较,PHN模型组大鼠NCX1的表达水平随造模时间逐渐减少,并 在21 d时达到最低(图1)。
2 补体激活足细胞损伤模型中NCX1及Ca2+水平的改变 NCX1荧光染色结果显示,在补体激活足细胞损伤模型组中其表达降低,应用反向模式抑制剂KB-R7943处理后,其表达明显增高(图2A)。Ca2+荧光染色结果显示,与对照组相比,补体激活足细胞损伤模型组的胞内Ca2+浓度明显升高(P<0.05);应用NCX1反向模式抑制剂KB-R7943处理后,胞内Ca2+浓度明显降低(P<0.05)(图2 B和图2C)。
3 足细胞损伤模型中Ca2+下游RhoA/ROCK信号通路分子活性的改变 我们进一步用Western blot分析了补体激活足细胞损伤模型中Ca2+下游RhoA/ROCK信号通路分子活性与表达的改变。结果显示,与对照组比较,补体激活足细胞损伤模型中活化型RhoA (active RhoA)、ROCK1和ROCK2蛋白的表达水平明显增高(P<0.05);应用NCX1反向模式抑制剂KB-R7943处理后,可以有效降低这些信号通路蛋白的活性及表达水平(P<0.05),提示抑制NCX1反向模式可以有效降低RhoA/ROCK信 号通路的激活(图3)。
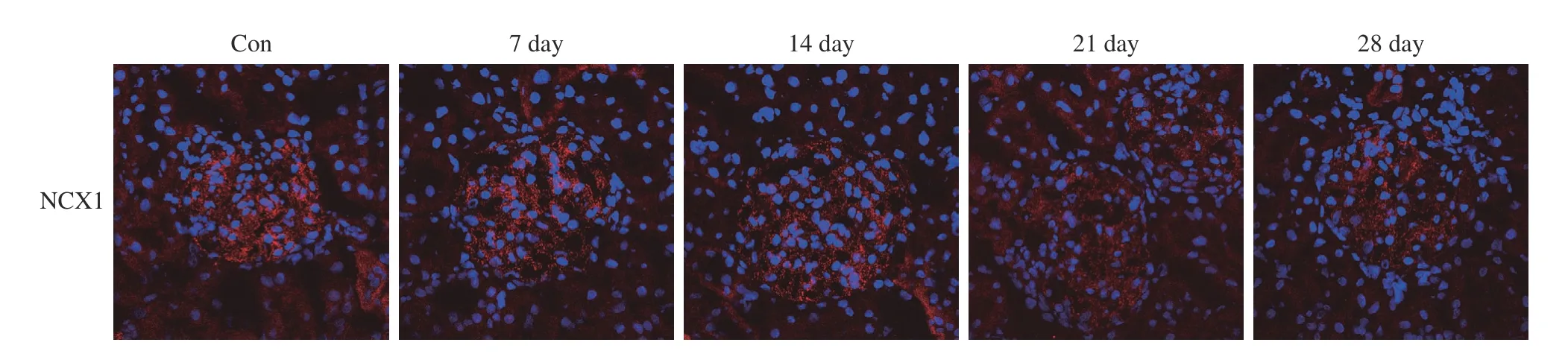
图 1 免疫荧光染色检测PHN大鼠模型中NCX1的表达(Con组:对照组;PHN模型组7 d、14 d、21 d、28 d;蓝色:细胞核)Fig.1 Expression of NCX1 in PHN rat model detected by immunofluorescence staining (Con: control group; PHN model groups for 7 days, 14 days, 21 days, 28 days; Blue: nuclei)
4 NCX1反向模式抑制剂KB-R7943处理有效减轻足细胞损伤 应用激光共聚焦显微镜观察足细胞中细胞骨架蛋白F-actin的表达与结构改变。结果发现对照组细胞骨架沿细胞长轴呈线性分布,骨架结构整齐清晰,足突明显,荧光强度明亮;补体激活足细胞损伤模型组骨架蛋白表达较对照组降低,足细胞皱缩,骨架结构断裂,排列紊乱;而KB-R7943处理组骨架蛋白表达水平恢复,细胞骨架结构明显改善,足细胞损伤明显减轻(P<0.05)。足细胞标志物Nephrin蛋白主要在细胞质中表达,呈颗粒或线装分布。F-actin、Nephrin蛋白、足细胞骨架协同蛋白Synaptopodin在三组间的变换趋势比较一致,补体激活足细胞损伤模型组显著低于对照组(P<0.05);而KB-R7943处理组显著高于补体激活足细胞损伤模型组(P<0.05),而与对照组比较则无统计学差异(图4),说明足细胞损伤后三种蛋白表达均降低,而KBR7943可以逆转这种损伤,使蛋白水平恢复到正常水 平。
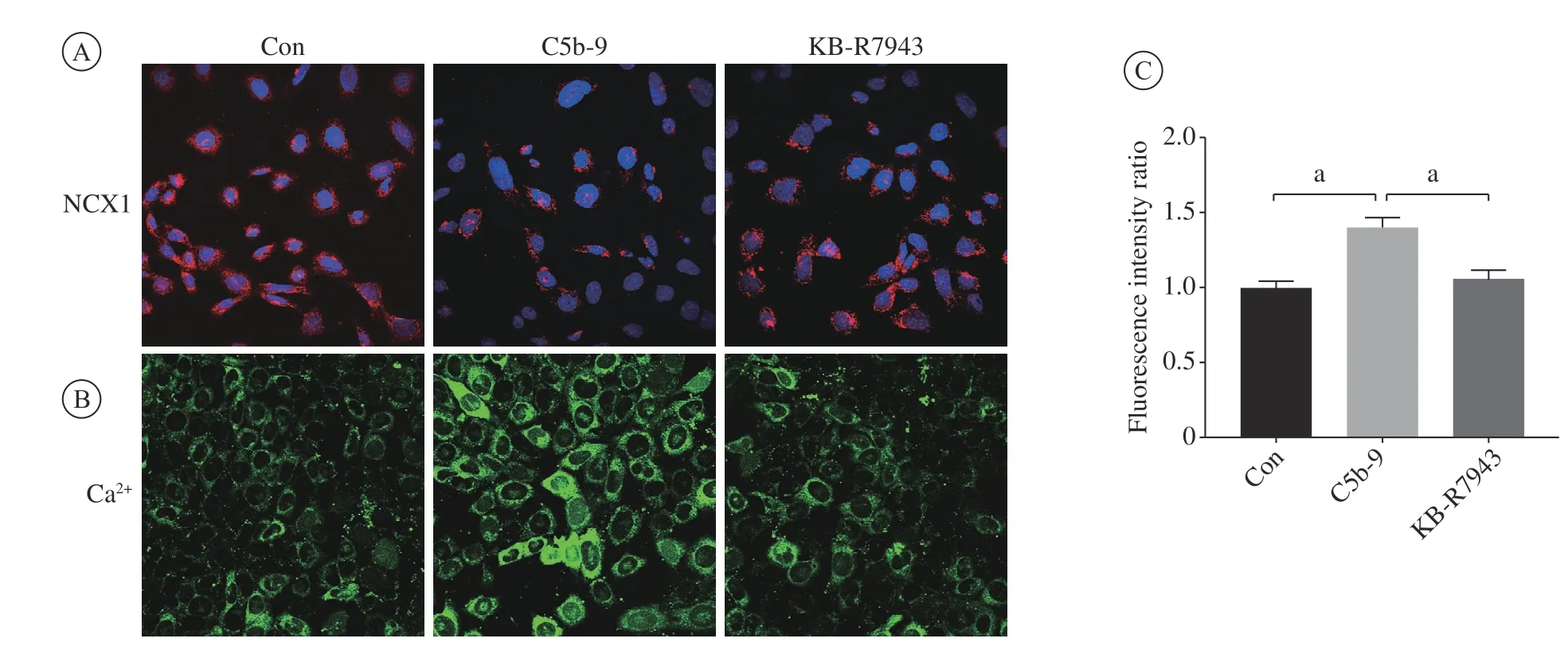
图 2 补体激活足细胞损伤模型中NCX1及Ca2+水平的变化(蓝色:细胞核)A:足细胞免疫荧光染色NCX1;B和C:足细胞Ca2+荧光染色图像及荧光数据分析;Con:对照组;C5b-9:补体激活足细胞损伤模型组;KB-R7943:NCX1反向模式抑制剂KB-R7943处理组(n=10,C5b-9 vs Con,KB-R7943 vs C5b-9,aP<0.05)Fig.2 Immunofluorescence staining of NCX1 and intracellular Ca2+ in podocytes (Blue: nuclei)A: Immunofluorescence staining of NCX1; B and C: Fluorescence imaging and quantitative analysis of Ca2+; Con: Control group; C5b-9: Complement injured podocyte model group; KB-R7943: KB-R7943 treatment group (n=10, C5b-9 vs Con, KB-R7943 vs C5b-9,aP<0.05)
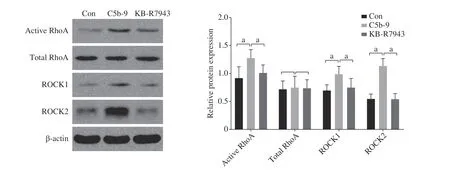
图 3 Western blot检测RhoA/ROCK信号通路蛋白活性Con:对照组;C5b-9:补体激活足细胞损伤模型组;KB-R7943:NCX1反向模式抑制剂KB-R7943处理组(n=5,C5b-9 vs Con,KBR7943 vs C5b-9,aP<0.05)Fig.3 RhoA/ROCK signaling pathway proteins activities detected by Western blot Con: Control group; C5b-9: Complement injured podocyte model group; KB-R7943: KB-R7943 treatment group (n=5, C5b-9 vs Con,KB-R7943 vs C5b-9, aP<0.05)
讨 论
哺乳动物的NCX是由同源蛋白的多基因家族形成,包括3个家族、9个亚型,分别为非K+依赖性的NCX1、NCX2、NCX3;K+依 赖性的NCKX1、NCKX2、NCKX3、NCKX4、NCKX5;阳离子依赖性的NCKX6和NCLX[11]。NCX1广泛分布于哺乳动物器官和组织,NCX2和NCX3主要表达于神经和骨骼肌中,而肾表达以NCX1为主[12]。近年来,各领域对NCX1的研究不断深入,NCX1不仅能够调控Ca2+浓度,还参与调节细胞兴奋性及兴奋耦联功能[13-15],参与细胞生长、分化、凋亡、浸润、迁移等过程[16-18]。在心脏搏动、大脑长程学习效应、血压控制、肾重吸收、免疫应答、神经递质传递、胰岛素分泌等方面发挥重要作用。?

图 4 足细胞F-actin、Nephrin和Synaptopodin的表达与结构改变(蓝色:细胞核 )A:免疫荧光染色检测F-actin、Nephrin和Synaptopodin;B:荧光数据分析;Con:对照组;C5b-9:补体激活足细胞损伤模型组;KBR7943组:NCX1反向模式抑制剂KB-R7943处理组(n=12,C5b-9 vs Con,KB-R7943 vs C5b-9,aP<0.05)Fig.4 Immunofluorescence staining of F-actin, Nephrin and Synaptopodin in podocytes (Blue: nuclei)A: Immunofluorescence imaging of F-actin, Nephrin and Synaptopodin; B: Quantitative analysis of immunofluorescence images; Con:Control group; C5b-9:Complement injured podocyte model group; KB-R7943: KB-R7943 treatment group (n=12, C5b-9 vs Con, KBR7943 vs C5b-9, aP<0.05)
有报道NCX1参与肾Ca2+重吸收,与肾缺血再灌注相关,并诱导肾上皮细胞转分化[19-20]。关于NCX1在肾小球足细胞中作用的研究较少,已报道肾小球足细胞中有NCX1表达;在嘌呤霉素诱导的足细胞损伤研究中发现NCX1表达减少,其前向模式受到抑制而激活反向模式,增加了Ca2+内流导致胞内Ca2+超载,损伤足细胞[21]。NCX1作为调节胞内Ca2+的重要通道,在调节细胞骨架方面发挥重要作用,其调节细胞骨架的作用依赖自身Ca2+结合中心的变构激活,与胞内Ca2+浓度密切相关[22]。我们的工作证实了NCX1通过调控钙离子内流激活了RhoA/ROCK信号通路,从而改变足细胞骨架结构,导致足细胞损伤,应用KB-R7943能有效减轻足细胞损伤。KBR7943属于Benzyloxyphenyl衍生物,NCX反向转运的选择性抑制剂,其广泛应用于心血管相关疾病的研究[23]。KB-R7943可浓度依赖性地舒张高钾预收缩的大鼠离体肾动脉环,为治疗肾性高血压,缓解肾病理损伤提供实验依据[24];KBR7943对缺血再灌注所致的肾功能障碍和组织损伤有保护作用[25-26];本研究证实了其在足细胞中的保护作用,这些研究证实了KB-R7943在肾病治疗中的可能性。
NCX1作为膜蛋白,其在细胞表面不规则分布,胞内呈弱放射线分布,与F-actin张力纤维接触,而且在细胞与细胞连接的区域呈现高表达,同时F-actin亦高表达,这与相邻足细胞连接形成肾小球滤过屏障,调控肾小球滤过的作用极其相似;而足细胞中另外一个重要的Ca2+通道蛋白TRPC6是肾小球裂隙膜蛋白SD复合物分子,其与NCX1的复合物能调控细胞迁移,这对维持肾小球滤过作用很重要,NCX1是否也是SD复合物分子?其与已知的组成裂隙膜的重要结构蛋白质CD2AP、Podocin等存在何种相互作用?这是我们进一步研究的方向,以全面揭示NCX1在足细胞上的作用机制,探索蛋白尿产生的新途径,为临床防治蛋白尿提供新的思路。

