桥本甲状腺炎对甲状腺乳头状癌患者颈淋巴结清扫程度及预后的影响
肖 敏, 周 戌, 李三荣, 赵 强
(1. 湖北省武汉市红十字会医院 甲乳外科, 湖北 武汉, 430012;2. 湖北省武汉市汉口医院 康复科, 湖北 武汉, 430015)
甲状腺乳头状癌(PTC)是最常见的甲状腺癌类型,约占所有确诊甲状腺癌的80%[1]。桥本甲状腺炎(HT)又称慢性淋巴细胞性甲状腺炎,是较常见的甲状腺自身免疫性疾病。研究[2]表明HT是促使PTC发生或发展的独立危险因素,但与单纯PTC相比,伴发HT的PTC患者常表现出良好的预后,如颈淋巴结转移数较少,复发率较低[3]。最近的一项研究[4]表明,伴随HT的PTC与清扫淋巴结数(LNY)增加有关。因而,除转移性淋巴结数(PLN)外,有必要比较颈淋巴结清扫程度,从而减少因手术范围不同而引起的研究偏倚。本研究评估伴随HT的PTC与更广泛的外科淋巴结清扫以及良好的临床结果的相关性,现报告如下。
1 资料与方法
1.1 一般资料
本研究为回顾性研究,纳入2013年1月—2015年12月武汉市红十字会医院甲乳外科病房收治的PTC患者180例。纳入标准: ① 行甲状腺全切除术并行中央区淋巴结清扫术(CLND)者; ② 手术后组织病理学诊断为PTC或伴HT者。HT的病理诊断标准: 在正常甲状腺组织中,存在弥漫性淋巴细胞和浆细胞浸润,以及淋巴滤泡或反应性生发中心形成。排除标准: ① 颈侧区淋巴结有转移,美国癌症联合委员会(AJCC)第8版TNM分期中N1b患者; ② 解剖少于3个淋巴结者; ③ 既往有甲状腺手术史或甲状腺癌病史者。所有患者均签署知情同意书,且通过武汉市红十字会伦理委员会审核并获得批准,批准文号201402。
1.2 方法
收集患者相关资料,包括年龄、性别、术前游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素(TSH)水平以及术后是否伴发HT、肿瘤直径、多灶性、甲状腺外浸润、中央区淋巴结转移等。血清FT3、FT4、TSH的正常范围依次为3.10~6.80 pmol/L、12.00~22.00 pmol/L和0.27~4.20 mIU/L。多灶性是指甲状腺内有2个或多个肿瘤灶。对于多灶性肿瘤,肿瘤直径是指所有肿瘤病灶直径之和[5]。转移性淋巴结比率(LNR)=PLN/LNY×100%。根据初始治疗反应,采用2015年美国甲状腺学会(ATA)指南评估动态风险分层(DRS)。术后随访5年,评估PTC患者结构性复发/持续性疾病的风险因素,比较2组患者无病生存期(DFS)。
1.3 DRS分类及临床转归标准
DRS根据血清甲状腺球蛋白(Tg)、血清甲状腺球蛋白抗体(TgAb)水平和影像学(颈部超声、131I全身显像和胸部CT等)检查分为反应良好(ER)、反应不确切(IDR)、生化反应欠佳(BIR)、结构反应欠佳(SIR)[6]。ER是指影像学阴性,刺激性Tg<1.0 ng/mL或抑制性Tg<0.2 ng/mL; IDR是指无充足的影像学证据,刺激性Tg 1.0~<10.0 ng/mL或抑制性Tg 0.2~<1.0 ng/mL; BIR是指影像学阴性,但刺激性Tg≥10.0 ng/mL或抑制性Tg≥1.0 ng/mL或TgAb值上升; SIR是指有影像学证据证明持续或新发病灶的存在[7]。结构性复发/持续性疾病指经细胞学或组织病理学检查证实的初始治疗后出现转移性病灶和/或影像学检查中出现远处转移性病灶,血清Tg阳性。DFS为从初次手术到发现结构性复发/持续性疾病的时间。
1.4 统计学分析
采用SPSS 22.0统计软件进行统计学分析。采用t检验、Mann-WhitneyU检验、Pearson卡方检验和Fisher检验比较2组患者的临床病理特征和DRS。应用受试者工作特征(ROC)曲线评估PLN、LNY和LNR预测结构性复发/持续性疾病的价值及最佳界值点,并进一步通过Cox比例风险模型评估结构性复发/持续性疾病的风险因素。在单因素分析中,P<0.10的变量被认为是显著的,进入多因素分析。采用Kaplan-Meier法构建DFS曲线, Log-rank检验比较2组DFS。P<0.05为差异有统计学意义。
2 结 果
2.1 PTC伴HT患者的临床病理特征和HT
对颈淋巴结转移和清扫程度的影响180例PTC中, 55例(30.55%)PTC患者术后病理诊断提示合并HT。所有患者平均年龄(52.29±10.49)岁,女144例(80.00%), 平均原发肿瘤大小1.2 cm, 多灶、甲状腺外侵犯和颈中央区淋巴结转移发生率分别为30.00%、30.55%和65.55%。2组患者年龄、原发肿瘤大小、多灶性、甲状腺外侵犯、颈中央区淋巴结转移等差异无统计学意义(P>0.05)。2组患者术前血清FT4和TSH水平无差异,但PTC伴发HT组FT4更低,TSH更高。2组转移性淋巴结中位数差异无统计学意义(P>0.05), 但HT患者的LNY高于无HT患者, LNR低于无HT患者,差异均有统计学意义(P<0.05或P<0.01)。见表1。
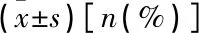
表1 2组患者临床病理特征
2.2 2组患者DRS分类和临床转归
根据初始治疗反应,对2组患者DRS分类进行了比较,其中PTC伴HT组反应良好为41例(74.54%), PTC不伴HT组为90例(72.00%); 3例(5.46%)伴发HT患者和7例(5.60%)不伴HT患者出现结构反应欠佳。2组患者各风险分层比率差异无统计学意义(P>0.05)。见表2。术后随访5年, PTC伴HT组有1例(1.82%)出现结构性复发/持续性疾病,而PTC不伴HT组有16例(12.80%)出现结构性复发/持续性疾病。PTC伴HT组患者的DFS优于PTC不伴HT组,差异有统计学意义(OR=0.12, 95%CI为0.04~0.32,P=0.012)。见图1。

图1 2组患者的DFS比较

表2 2组患者动态风险分层[n(%)]
2.3 转移性淋巴结状态和伴发HT对结构性复发/持续性疾病风险的影响
PLN、LNY、LNR与临床转归的ROC曲线见图2。

图2 PLN、LNY、LNR与临床转归的ROC曲线
PLN、LNY、LNR曲线下面积分别为0.890(95%CI为0.824~0.955)、0.716(95%CI为0.615~0.817)、0.902(95%CI为0.846~0.958), 约登指数最大值分别为2.00、11.00和0.24, 3个变量均是结构性复发/持续性疾病的可能危险因素,纳入Cox回归分析。在单因素分析中,年龄(≥55岁)、肿瘤直径(>1 cm)、多灶性、PLN(>2枚)、LNR(>0.4)、伴发HT与结构性复发/持续性疾病显著相关。多因素分析显示,年龄(≥55岁)、PLN(>2枚)和LNR(>0.4)与结构性复发/持续性疾病显著相关,而伴发HT与结构性复发/持续性疾病的低风险显著相关。见表3。

表3 PTC患者结构性复发/持续性疾病危险因素的单因素和多因素Cox回归分析[n(%)]
3 讨 论
本研究结果表明,与不伴HT的PTC患者相比,PTC伴HT患者具有更长的DFS, 并且预期可获得更好的临床结果。虽然2组转移性淋巴结数无差异,但伴发HT的PTC患者清扫淋巴结数显著增多,因此转移性淋巴结的比率低于不伴HT的PTC患者。多因素Cox回归分析显示, PLN与结构性复发/持续性疾病无关,而LNR显著增高了结构性复发/持续性疾病的风险。在调整淋巴结状态后,伴发HT仍然显著降低了结构性持续复发/持续性疾病的风险。
尽管PTC具有惰性的生物学行为和良好的预后,但30%~60%患者在确诊时伴有颈部淋巴结转移,且多见于颈部中央区[8]。研究[9]表明,淋巴结转移是影响甲状腺癌预后的主要因素之一,并与预后不良相关。目前, HT对颈部淋巴结转移的影响尚存争议[10-11]。QU H等[12]对21项回顾性研究和4项前瞻性研究涉及的7 000余例患者进行大型荟萃分析显示, HT对颈中央区淋巴结转移具有保护作用(OR=0.70), 而男性、肿瘤直径>5 mm、多灶性、包膜浸润、甲状腺外浸润和侧方淋巴结转移与中央区淋巴结受累有关。KIM H S等[13]则报道了不同的研究结果,即HT既不是颈中央区淋巴结转移的阳性预测因子,也不是阴性预测因子,HT与颈中央区淋巴结转移风险无明显关联。然而,以上研究均基于淋巴结转移数目、大小和淋巴结外侵犯等因素,未将LNY纳入考虑。最新的一项研究[14]显示, LNY能反映淋巴结实际清扫程度,是患者生存期的负性相关因素。本研究结果虽未显示HT对颈淋巴结转移的保护作用,但与不伴HT的患者相比,伴发HT的PTC患者LNY更高,提示HT组中央区淋巴结肿大较为常见。由于HT是一种自身免疫性疾病,因此在该病早期,局部淋巴结会发生自身反应性T和B细胞的克隆性增殖,导致颈部淋巴结增大[15], 但这种增大的淋巴结常见于双侧,术前超声检查多无微小钙化、融合征和囊性区等转移性淋巴结特征性改变[16], 术后病理证实主要为反应性增生,说明在外科手术中肉眼发现的一部分肿大淋巴结实际上是假阳性,但这可能导致了外科医生在术中完全清除受累的淋巴结,从而改善PTC患者的临床结果。但作者并不主张每例PTC患者在缺乏临床证据的情况下进行预防性中央区淋巴结清扫术,而应根据术前影像学检查和术中发现明确淋巴结清扫范围,以减少术后并发症的发生。
最新的流行病学和结果数据库(SEER数据库)[17]显示, PTC患者5年生存率高达98%, 因此对于PTC预后的研究应更多地注意其复发风险的问题。AJCC制定的TNM分期一直被指南推荐用于评估PTC患者的死亡风险,但预测结构性复发或持续性疾病风险的能力较差[18]。随着对于风险分层的重视, 2015年ATA正式推荐DRS用于分化型甲状腺癌的术后随访。本研究中,尽管2组患者在DRS各分类的比率无显著差异,但伴发HT的患者中属于ER类的比率高于不伴HT的PTC患者,并且SIR类的比率较低。本研究多因素Cox回归分析显示,伴发HT能显著降低结构性复发/持续性疾病的风险。
综上所述,年龄(≥55岁)、PLN(>2枚)和LNR(>0.4)是PTC患者结构性复发/持续性疾病的独立危险因素。在调整淋巴结状态后,伴发HT的PTC患者具有更好的临床结果,因此HT本身是PTC患者的有利预后因素。

