基于监测、流行病学和结果数据库分析管腔A型乳腺癌辅助化疗效果
曹 禺, 方 芳
(皖南医学院弋矶山医院 甲乳外科, 安徽 芜湖, 241000)
乳腺癌是女性常见的恶性肿瘤之一,发病率和病死率均较高,严重影响患者的身心健康[1]。辅助化疗可降低乳腺癌患者的复发率,含蒽环类药物的化疗方案已被证实优于标准的环磷酰胺、甲氨蝶呤和氟尿嘧啶(CMF)方案[2], 而在辅助化疗中联合应用紫杉烷(或多西紫杉醇)将进一步改善患者的预后[3]。但部分乳腺癌患者并未因此获益,可能因为这些患者对辅助化疗并不敏感[4]。根据基因检测结果进行亚组分型是乳腺癌分型的金标准,然而基因检测由于技术要求高、成本高并未得到广泛应用。目前,临床应用最广泛的乳腺癌分型方法是根据免疫组织化学标记物表达情况将乳腺癌分为4种分型,包括管腔(Luminal) A型、Luminal B型、ERBB2+型和Basal-like型。其中Luminal A型的具体标准为雌激素受体(ER)>1%, 孕激素受体(PR)>20%, 人表皮生长因子受体-2(HER-2)阴性, Ki-67<14%[5]。与其他亚型相比, Luminal A型患者的预后较好,但对化疗的反应率低[6-7]。美国国立综合癌症网络(NCCN)指南中没有明确指出Luminal A型早期乳腺癌(通常被认为是Ⅰ、Ⅱ期乳腺癌)的化疗指征,辅助化疗对Luminal A型早期乳腺癌的作用仍存在争议,尤其是患者腋窝淋巴结为阳性时[8]。本研究基于美国国立癌症研究所(NCI)监测、流行病学和结果数据库(SEER数据库)中大量的乳腺癌相关数据,评价辅助化疗对Luminal A亚型早期乳腺癌的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料
本研究患者数据来自SEER注册研究数据集(18个表单),应用SEER*Stat 8.3.6版软件筛选出2010—2015年被诊断为Luminal A型乳腺癌的患者。纳入标准: 诊断年份2010—2015年,部位为“乳房”,乳腺癌免疫组化分型为Luminal A型,美国癌症联合会(AJCC)第7版肿瘤临床分期为Ⅰ期与Ⅱ期,接受过手术治疗者。本研究纳入变量包括临床分级、淋巴结转移N分期、年龄、病理分级、SEER特定原因死亡、SEER其他死因、生存时间和生存状态,统计时间截至2017年12月底。本研究共纳入207 404例接受过手术治疗的Luminal A型早期乳腺癌病例进行分析。
1.2 方法
根据是否接受辅助化疗将患者分为化疗组(13 789例)与未化疗组(115 625例),并根据不同临床病理特征进行亚组分型。本研究所有数据均采用SPSS 25.0统计学软件进行分析。分类变量采用[n(%)]描述,比较采用χ2检验,比较辅助化疗组与未辅助化疗组的人口学资料和临床特征。采用对数秩检验评估2组生存率的差异,绘制累积风险曲线。所有统计检验均为双侧检验,检验水准α=0.05,P<0.05为差异有统计学意义。由于Luminal A型早期乳腺癌患者生存率较高(>50%), K-M生存分析缺乏中位生存时间,且生存分析曲线过于接近,难以区分,本研究采用K-M生存时间差异显著性P值和累积风险曲线共同描述数据。
2 结 果
化疗组与未化疗组的临床分期、腋窝淋巴结转移N分期、肿瘤长径T分期、年龄、病理分级情况比较,差异均有统计学意义(P<0.01), 但2组性别分布情况比较,差异无统计学意义(P>0.05), 见表1。化疗组与未化疗组的生存时间比较,差异有统计学意义(P<0.01), 见表1。化疗组患者的累积风险曲线明显高于未化疗组,见图1A。
临床分期亚组分析显示: ① 2组的0期、ⅠA期患者和ⅠB期患者的生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组0期、ⅠA期患者和ⅠB期患者的累积风险曲线明显高于未化疗组。② 2组ⅡA期患者的生存时间比较,差异无统计学意义(P>0.05), 见表1。③ 化疗组ⅡB期患者的生存时间与未化疗组比较,差异有统计学意义(P<0.05), 见表1; 化疗组ⅡB期患者的累积风险曲线低于未化疗组,见图1B。
肿瘤长径T分期亚组分析显示: ① 2组的T0~T1期、T2期患者的生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组T0~T1期、T2期患者的累积风险曲线明显高于未化疗组。② 2组T3期患者的生存时间比较,差异无统计学意义(P>0.05), 见表1。
年龄亚组分析显示: 2组的不同年龄段患者的生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组不同年龄段患者的累积风险曲线均明显高于未化疗组。
病理分级亚组分析显示: 2组的不同病理分级患者的生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组不同病理分级患者的累积风险曲线均明显高于未化疗组。
性别亚组分析显示: ① 2组的男性患者生存时间比较,差异无统计学意义(P>0.05), 见表1。② 2组的女性患者生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组女性患者的累积风险曲线明显高于未化疗组。
腋窝淋巴结转移N分期亚组分析显示: ① 2组的N0期、N1mi期患者生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组N0期、N1mi期患者的累积风险曲线均明显高于未化疗组, N1mi期患者的累积风险曲线见图1C。② 2组的N1a、N1b、N1c期患者生存时间比较,差异有统计学意义(P<0.01), 见表1; 化疗组N1a、N1b、N1c期患者的累积风险曲线明显低于未化疗组,见图1D。
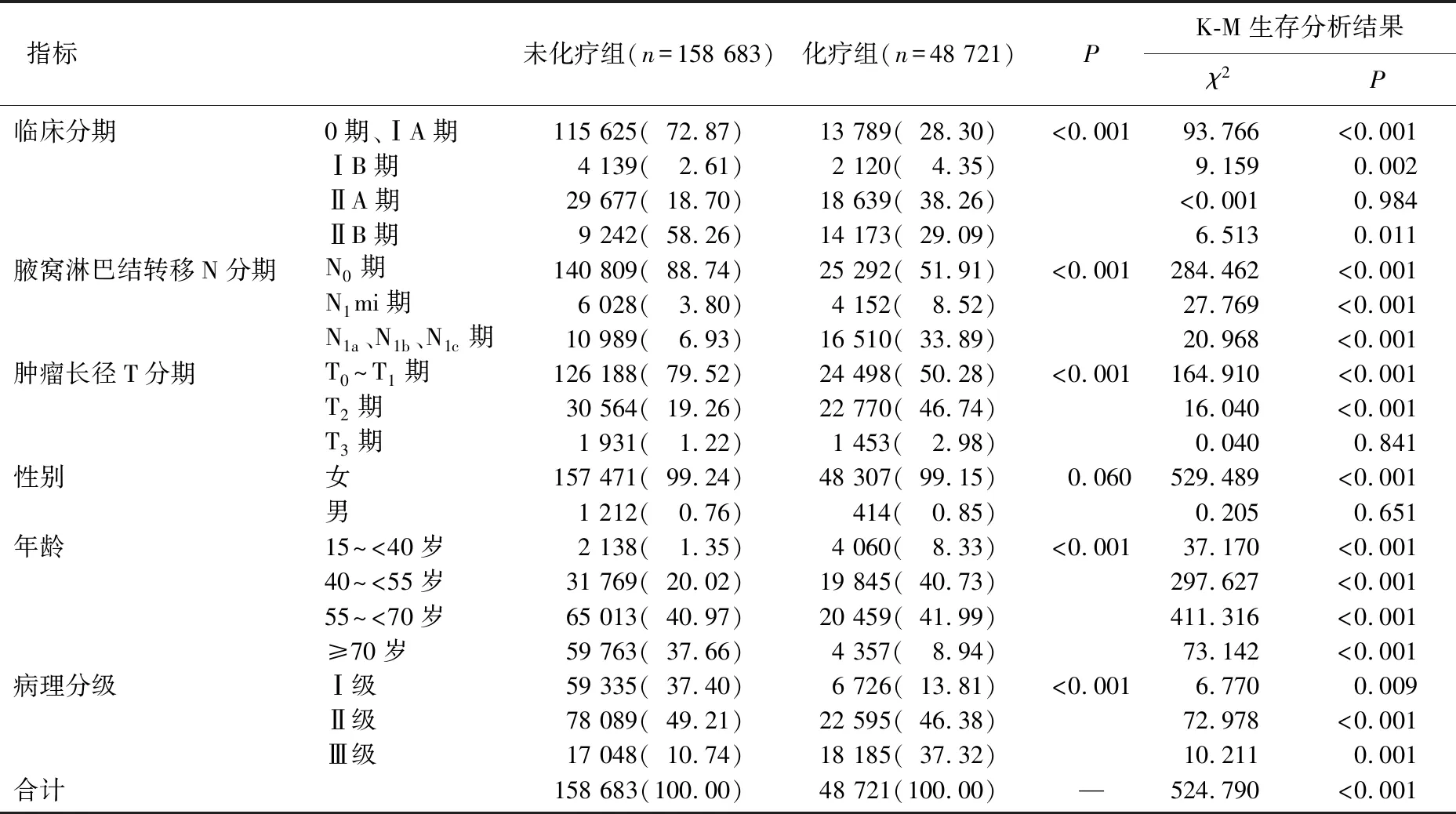
表1 2组人口学资料、临床特征及其K-M生存分析结果[n(%)]

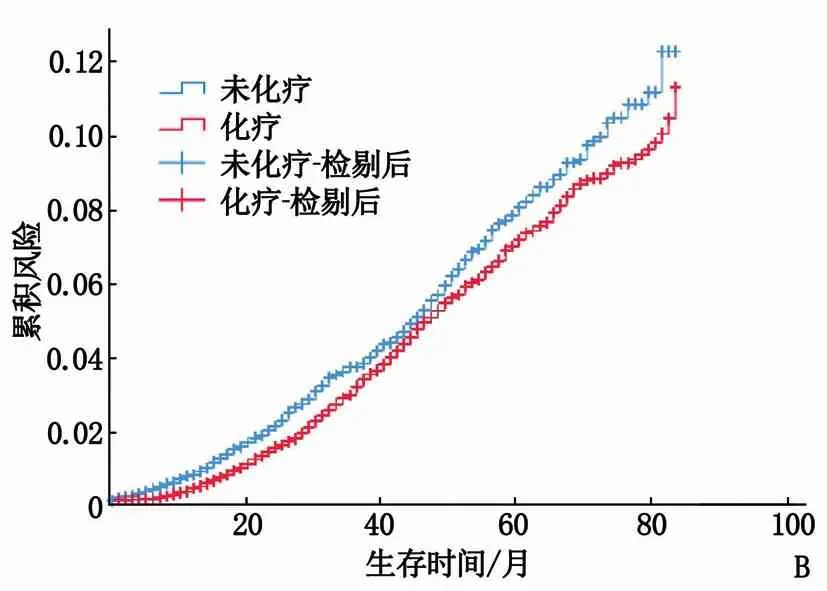

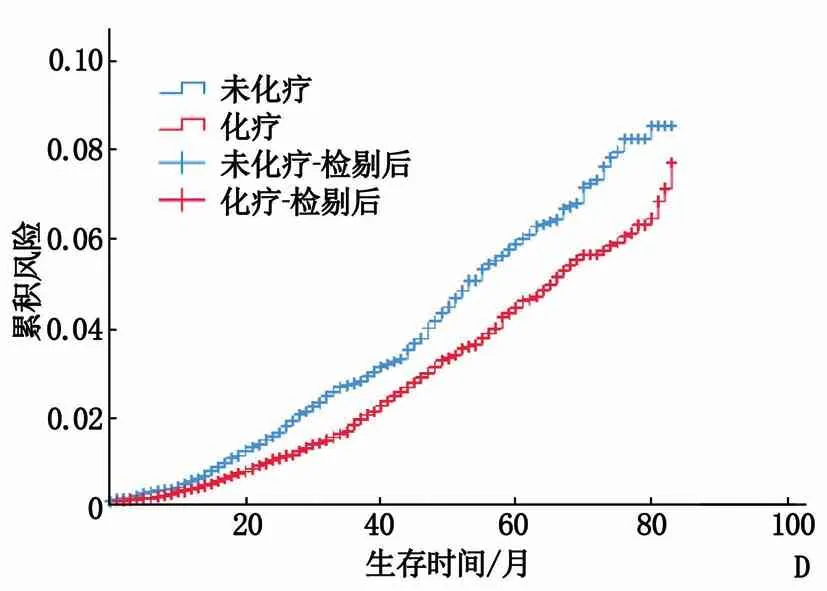
A: 整体累积风险曲线; B: ⅡB期患者的累积风险曲线; C: N1mi期患者的累积风险曲线; D: N1a、N1b、N1c期患者的累积风险曲线。
3 讨 论
相关研究[9]提出,对于早期乳腺癌患者来说,术前辅助化疗(新辅助化疗)除在提高保乳手术比率方面有一定优势外,在整体生存(OS)、无瘤生存(OFS)以及术后局部复发(LRR)方面均与术后辅助化疗组无显著差异,因此无需单独研究术前和术后辅助化疗对Luminal A早期乳腺癌疗效的影响。乳腺癌患者的肿瘤分型和诊断时的临床分级在不同种族之间有很大差异,但不同种族的乳腺癌患者采用同一方案治疗时是否有显著差异尚少有报道,故本研究未考虑种族因素对诊断结果的影响[10]。
化疗不良反应与辅助化疗有关,短期和长期的不良反应会影响部分化疗患者,增加患者额外的医疗费用,降低健康相关生活质量(HRQoL)。化疗期间发生的短期不良反应通常是暂时和可逆的,最常见的有恶心、呕吐、口腔酸痛、腹泻、疲倦、脱发和血液指标(如白细胞、中性粒细胞、血小板、血红蛋白等)暂时降低等。长期的不良反应,如心脏损害以及白血病风险小幅增加等都是不可逆的。虽然化疗可以防止一些患者复发,但并非所有早期乳腺癌女性都会受益,许多女性在未化疗的10年中并没有复发。这一现象给临床医生评估预后和决定早期乳腺癌女性是否进行辅助化疗方面带来了相当大的挑战[11-12]。值得注意的是,虽然ER阳性乳腺癌患者应用内分泌治疗联合化疗后取得了不错的疗效,但也有相当一部分患者治疗过度[12]。
研究[13]显示, ER阳性乳腺癌患者并不能从蒽环类药物中获益,在内分泌治疗中可有较大获益。荟萃分析[14-17]发现, ER阳性且HER-2阴性的早期乳腺癌患者不能从含紫杉类药物的化疗方案中获益。上述研究进一步表明, Luminal A型乳腺癌对化疗的反应较差,其化疗方案的制订取决于疾病对化疗的反应性与复发风险。
目前,越来越多的循证医学证据细化了ER阳性HER-2阴性乳腺癌这一亚群患者的治疗方法,从而帮助临床医生找到更适合患者的治疗方案。荷兰癌症研究所开发的70-基因芯片法已经被美国食品药品监督管理局(FDA)批准上市, 21基因检测技术在辅助治疗中的应用也已经被2008年NCCN指南所推荐。但这些新技术的价值还有待进一步证实,而高昂的检测费用也导致了其在发展中国家使用受限。目前, Luminal A型早期乳腺癌患者的化疗指征尚缺乏明确的临床评价标准[14]。
本研究结果表明, Luminal A型早期乳腺癌患者总体预后良好,但对化疗不敏感,接受化疗可能弊大于利,化疗可能缩短患者生存期,增高累积生存风险,与DIESSNER J等[18]研究结果一致,其认为Luminal A型乳腺癌因其低增殖率对化疗的反应不佳。本研究还发现,患者性别、年龄、种族、病理类型及病理分级这些因素对Luminal A型早期乳腺癌化疗决策影响不大,而临床分期、淋巴结转移N分期对化疗决策具有一定影响。当患者处于ⅡB期或腋窝淋巴结有转移时(N1mi期除外),化疗才开始显示出有限的疗效。本研究结果显示,淋巴结处于N1mi期阶段有可能作为Luminal A型早期乳腺癌患者免除辅助化疗的临床指征,这可以减轻过度治疗对患者造成的损害,并减轻其经济负担,当然,这还需要继续开展临床与基因分析的联合研究来证实。相关研究[8]发现, Luminal A型乳腺癌患者中可能不需要化疗的女性患者群体,有可能扩大到临床高风险的群体(淋巴结阳性或肿瘤长径大于3 cm), 与本研究结论一致。
综上所述, SEER数据库大样本分析结果提示,在缺乏多基因检测结果的情况下,临床可考虑将淋巴结转移N1mi期纳入Luminal A型早期乳腺癌患者免除辅助化疗的参考指标。

